微生物群通过肠-脑回路操控交感神经元?
肠道和大脑之间的连接监视肠道组织及其微生物和饮食含量,调节生理肠道功能,例如营养吸收和运动性,以及通过脑线喂养的行为。因此,有可能存在检测肠道微生物并将其传递到中枢神经系统区域的电路,这些区域进而调节肠道生理。

美国纽约洛克菲勒大学的Paul A. Muller及他的团队通过结合生物组学小鼠模型与转录组学,电路追踪方法和功能操作,来表征微生物群对肠道相关神经元的影响。作者发现肠道微生物组可调节肠道外源性交感神经元:微生物群耗竭可导致神经元转录因子cFos的表达增加,而无菌细菌定殖于产生短链脂肪酸的细菌会抑制肠道交感神经节中cFos的表达。化学遗传学的操作,翻译轮廓和顺行性跟踪确定远端肠投射迷走神经元的子集,其定位在微生物群介导的肠道交感神经元的调节中具有不同的作用。肠道壁逆行的多突触神经元示踪显示了在微生物耗竭过程中激活的脑干感觉神经核,以及调节胃肠道转运的各种交感神经运动前谷氨酸能神经元。这些结果揭示了通过肠道-大脑回路对肠道外源性交感激活的微生物群依赖性控制。
结论:
作者为了确定eEAN细胞体的位置,作者将荧光逆行示踪剂,霍乱毒素β亚基(CTB)注入了不同肠段的壁中,并解剖了伸向肠道的外在神经节,特别是感觉结节神经节和背侧神经节。结果显示,不同的肠道区域的感觉和交感神经支配是由不重叠的周围神经元细胞群体介导的。转录核糖体的CTB示踪对结节神经节的GO分析表明,无菌小鼠中与突触信号传导和神经元激活相关的基因丰富。免疫荧光分析证实,从无菌小鼠中分离出的CG-SMG与SPF对应物相比,显示出更多的cFos +神经核。这些数据表明,缺乏微生物群会导致肠道外源性交感神经活动水平升高。
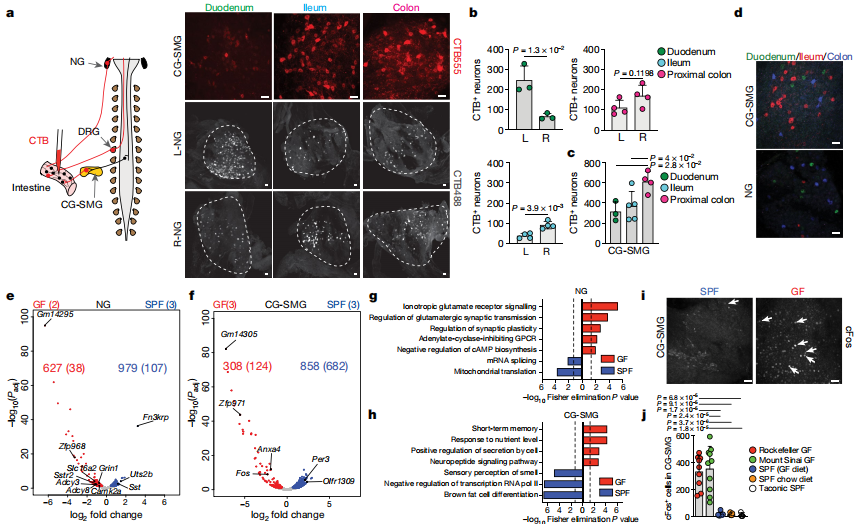
为了解决特定的微生物是否可以介导CG-SMG神经元的强直抑制,作者将粪便从SPF供体转移到无菌小鼠中,可使CG-SMG神经元cFos恢复到与SPF条件相当的水平,这表明微生物群可以抑制肠道外源性交感神经元。用单独的抗生素治疗足以促进交感性cFos表达,表明了细菌的特定亚群能够抑制cFos激活。此外,一次链霉素的口服灌胃会导致灌胃后12小时和24小时CG-SMG神经元活化,治疗后5天恢复到基础水平。通过将荧光CTB注射到经广谱抗生素治疗的FosGFP小鼠回肠CG-SMG中观察到CTB +和cFos +神经元之间的广泛共定位,增强了微生物耗竭后激活的交感神经元投射到肠道的可能性。最后,作者发现对微生物耗尽的小鼠中儿茶酚胺释放的阻滞可以挽救其胃肠道蠕动的变化,这表明交感神经活动的增强部分归因于这些小鼠的运动能力下降。这些结果表明,特定的微生物可以抑制肠道交感神经元中cFos的表达,并且肠道特定的交感活性可以反映肠道微生物群落的变化。作者还观察到,当定义微生物群落时,无菌的操作导致CG-SMG神经元抑制。
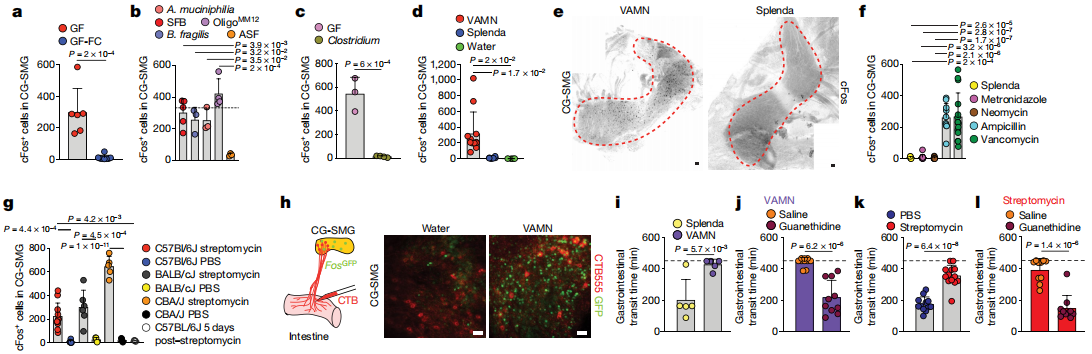
因此,SCFAs抑制交感性cFos的能力最有可能是由周围的过程介导的。SCFAs可以通过激活G蛋白偶联受体抑制组蛋白脱乙酰基酶或通过调节蛋白来调节靶细胞。总体而言,以上结果确定了SCFA和其他肠道相关代谢产物或体液因子是肠道交感神经元活化的生理调节剂。从不同肠段进行的双重PRV示踪表明,每个这些脑干区域中的大多数神经元都连接到肠的多个段。这些实验定义了一组常见的传出的运动前脑干神经元,这些神经元多突触连接到肠道的不同区域并可以控制肠的交感神经活动。结果表明,谷氨酸能LPGi / RVLM脑干神经元可以驱动肠道交感神经活动,从而减慢胃肠道的运输。
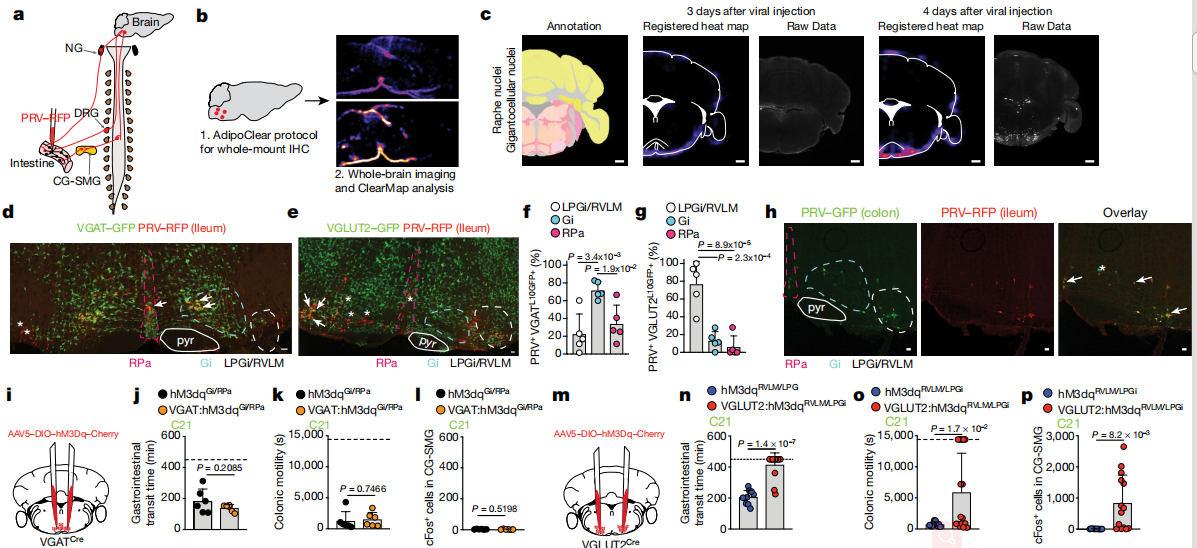
在链霉素治疗后,作者观察到NTS和术后区域的cFos表达总体增加。脑干感觉细胞核经过调整以检测肠道微生物群或其代谢产物的变化。微生物耗竭后,NTS /视网膜后区域中cFos表达的增加表明传入感觉神经元在调节肠道交感神经活动中具有功能性作用。肠道上皮,粘膜和肌层的外在神经元感测主要由结节神经节和DRG25中的感觉传入来执行。
为了确定是单独抑制结节神经节还是抑制结节神经节和DRG都是造成这种表型的原因,作者首先使用了肠道投射TRPV1+传入神经元的化学和遗传消融方法。作者发现这种治疗方法并不能阻止CG-SMG中抗生素诱导的cFos表达,也不能在未治疗的SPF小鼠中诱导cFos表达,这表明在微生物耗竭过程中,DRG感觉神经元在激活的回路中没有主要作用。最后,对特定迷走神经传入的调节足以驱动肠道交感神经活动。

此处进行的功能,回路和基因表达研究表明,直接或间接通过上皮细胞对微生物或其代谢产物进行EAN检测是一种核心感觉系统,微生物组成的改变足以充分激活肠道投射神经元。额外的CG-SMG诸如脾脏,胰脏和肝脏之类的靶标也可能受到微生物群的调节,可能对全身免疫和代谢产生影响。
结论:
作者确定了许多潜在的微生物群来源的信号,可以调节肠道交感神经活动和神经元与肠突触连接。进一步了解自主神经系统的微生物调节以及整合微生物信号的其他回路的特性,可能是了解肠道运动,内脏痛,肠内免疫和免疫调节的关键。与肠脑轴有关的系统性疾病,是确定治疗策略必不可少的知识。
参考文献:
Muller P A , Schneeberger M , Matheis F , et al. Microbiota modulate sympathetic neurons via a gut–brain circuit[J]. Nature, 2020.






