MIR106A-5p与鼻咽癌进展
调节失调的microRNAs(miRNAs)与肿瘤的进展、转移和预后不良有关。MIR106A-5p在细胞遗传学上定位于Xq26.2,在不同的癌症中作为癌基因和抑癌基因。然而,MIR106A-5p致癌作用的调控机制尚未阐明。今天小编为大家带来发表于“Autophagy”上的文章:“MIR106A-5p upregulation suppresses autophagy and accelerates malignant phenotype in nasopharyngeal carcinoma”,给大家详细介绍MIR106A-5p如何参与鼻咽癌(NPC)进展。

我们使用miRNA芯片来表征鼻咽癌组织中MIR106A-5p的表达水平,通过临床资料确定MIR106A-5p与患者预后的关系,后续实验证实了MIR106A-5p在鼻咽癌中调节恶性肿瘤和自噬的机制。最后,我们研究了MIR106A-5p是如何在NPC中上调的。
结果:
1.MIR106A-5p在鼻咽癌中的表达及临床意义
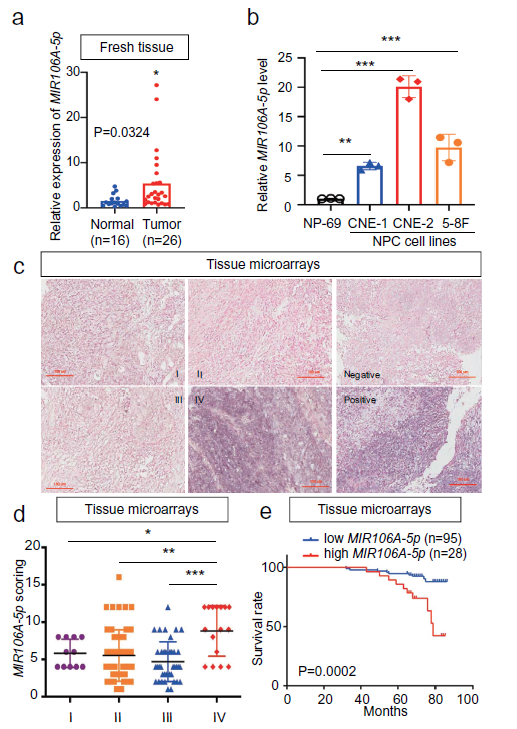
我们使用联合的GEO队列数据库检测NPC miRNAs的表达谱。这些数据表明,在差异表达的miRNAs中,MIR106A-5p在鼻咽癌组织中显著增加了4.8倍。qRT-PCR证实了MIR106A-5p在鼻咽癌组织中的过表达(图1A)。此外,MIR106A-5p在鼻咽癌细胞系中的表达显著增加,尤其是CNE-2和5-8F细胞系(图1B)。其次, ISH显示,临床IV期NPC患者的MIR106A-5p过表达比临床I-III期NPC患者更为突出(图1C,D),这表明MIR106A-5p的失调可能与终末期NPC密切相关。生存率分析表明,MIR106A-5p高表达患者的临床预后比MIR106A-5p低表达的患者差(图1E)。总的来说,这些发现表明鼻咽癌进展与MIR106A-5p上调有关。
2.MIR106A-5p加速鼻咽癌恶性表型的形成
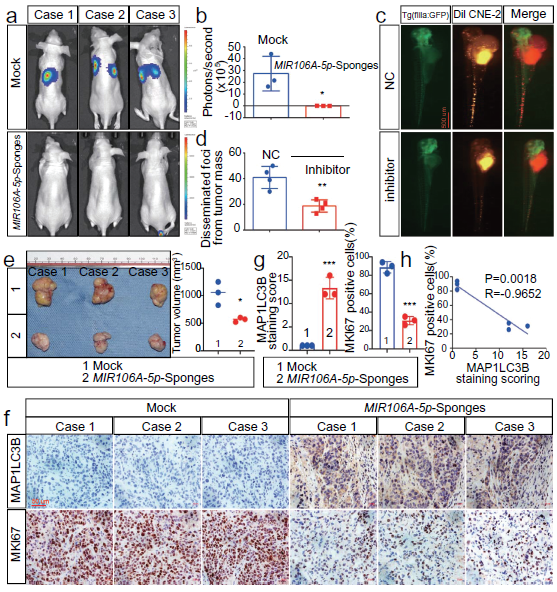
我们采用斑马鱼和BALB/c小鼠动物模型检测MIR106A-5p的体内功能。我们发现MIR106A-5p的敲除显著抑制了CNE-2细胞的转移能力(图2A,B)。MIR106A-5p敲除后鼻咽癌细胞的迁移减少(图2C,D)。在皮下注射高或低MIR106A-5p表达的CNE-2细胞后测量肿瘤大小,注射MIR106A-5p低表达细胞的小鼠肿瘤生长减少(图2E,F)。这些发现共同提供了MIR106A-5p加速鼻咽癌转移和生长的证据。IHC分析显示,低表达MIR106A-5p的异种移植可增加MAP1LC3B的表达水平(图2F,G),MAP1LC3B的表达水平与鼻咽癌异种移植瘤中MKI67(增殖标记物ki-67)的表达呈负相关(图2H)。
3.MIR106A-5p抑制鼻咽癌细胞自噬
我们假设MIR106A-5p表达失调可能影响自噬。因此,我们评价了MIR106A-5p对自噬体和自溶体生成的影响。值得注意的是,沉默MIR106A-5p的表达显著促进了ATG基因的表达,并诱导自噬通量产生自噬体和/或自溶体(图3A,I),这表明MIR106A-5p能有效地抑制鼻咽癌细胞的自噬。

4.MIR106A-5p通过抑制自噬作用加速鼻咽癌恶性表型
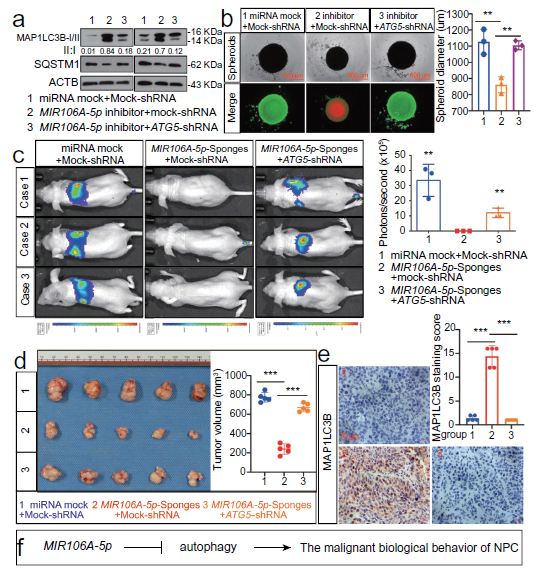
通过评估ATG5基因敲除后细胞的生长和迁移能力,研究了MIR106A-5p抑制的自噬在鼻咽癌发生和转移中的作用。敲除ATG5显著降低MIR106A-5p抑制诱导的自噬(图4A)。由于三维细胞培养模型更接近体内肿瘤微环境,因此三维NPC细胞培养被用来评估细胞的活性和增殖。沉默MIR106A-5p表达可减少球体的形成和细胞生存能力,这个表型部分地被抑制ATG5所挽救(图4B)。此外,在ATG5被抑制后,MIR106A-5p海绵体内诱导的转移和生长减少被消除(图4C-E)。这些发现表明MIR106A-5p抑制的自噬加速了恶性鼻咽癌的表型(图4F)。
5.BTG3是MIR106A-5p的直接靶点,与头颈部癌预后不良相关
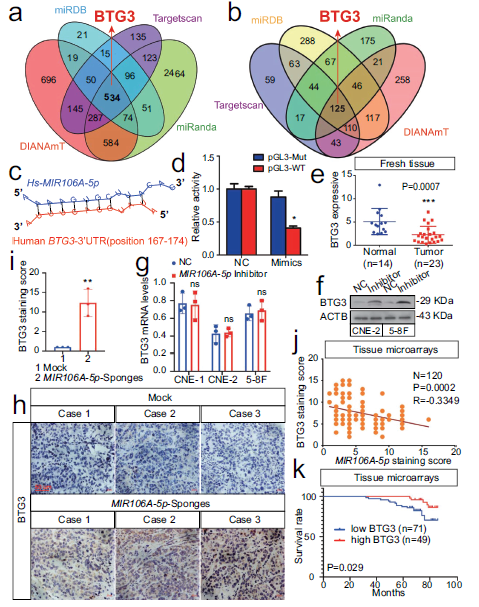
通过四种常见的生物信息学工具来确定MIR106A-5p的自噬相关靶点(图5A,B)。在这些靶基因中,BTG3具有MIR106A-5p潜在的高亲和力结合位点(图5C)。荧光素酶报告分析显示MIR106A-5p和BTG3 3′-UTR之间具有生物有效相互作用(图5D)。此外,鼻咽癌组织中BTG3 mRNA和BTG3蛋白表达降低(图5E)。有趣的是,在MIR106A-5p抑制后,BTG3蛋白水平显著增加,而BTG3的mRNA水平保持不变(图5F-I)。鼻咽癌组织芯片中MIR106A-5p表达与BTG3蛋白水平呈负相关(图5J)。这些结果表明MIR106A-5p可能通过翻译抑制来调节BTG3的表达。最后,Kaplan-Meier分析显示,在鼻咽癌组织芯片中,低BTG3水平与较差的临床结果相关(图5K)。总的来说,这些数据表明MIR106A-5p通过靶向BTG3直接调节自噬。
6.BTG3对MIR106A-5p抑制自噬是必不可少的
通过用siRNA转染鼻咽癌细胞,我们发现BTG3参与了MIR106A-5p相关的自噬抑制(图6A-E)。一系列分析表明,BTG3的敲除消除了MIR106A-5p抑制增加自噬的能力(图6A-E),证明MIR106A-5p抑制自噬依赖于其降低BTG3水平的能力。

7.BTG3对MIR106A-5p加速恶性鼻咽癌表型至关重要
为了进一步证实MIR106A-5p-BTG3轴导致恶性肿瘤加速,对MIR106A-5p海绵处理的鼻咽癌细胞进行慢病毒BTG3 shRNA转导。MIR106A-5p抑制降低了鼻咽癌细胞的转移和生长,但这些作用在BTG3基因敲除后显著降低(图7A-E)。IHC分析显示,恶性表型加速的鼻咽癌异种移植组的自噬也减少(图7F-K),这表明MIR106A-5p的自噬抑制和促肿瘤作用需要BTG3(图7L)。
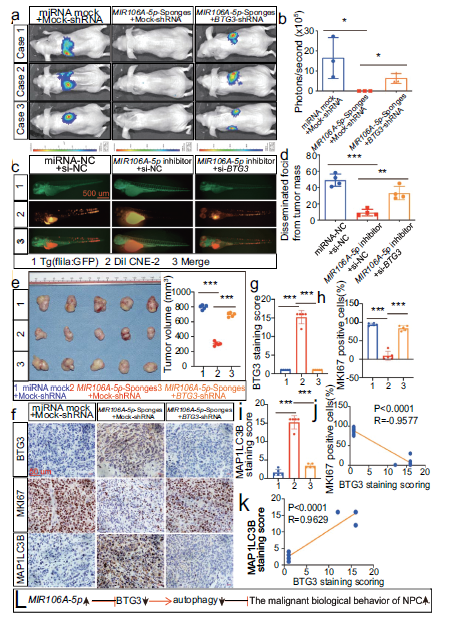
8.MIR106A-5p-BTG3轴通过MAPK途径抑制自噬
接下来,我们试图确定参与MIR106A-5p诱导自噬的BTG3相互作用蛋白。我们对MIR106A-5p靶点进行KEGG途径分析后,确定了MAPK和AKT-MTOR通路。因此,使用这些途径的抑制剂进行拯救实验来研究这些途径对MIR106A-5p-BTG3介导的肿瘤进展的相对贡献。我们发现,只有用PD184352抑制MAP2K1/MEK活性才能显著抑制由MIR106A-5p和BTG3沉默诱导的细胞增殖和迁移;相比之下,MK2206抑制AKT活性未能改变MIR106A-5p-BTG3介导的肿瘤生长和迁移(图8A-D)。此外,我们还检测了鼻咽癌的MIR106A-5p-BTG3轴依赖性自噬抑制是否由MAPK信号的激活引起。当MIR106A-5p抑制或BTG3表达激活自噬时,p-MAP2K1和下游p-MAPK1/ERK和p-MTOR水平降低。在用PD184352抑制MAP2K1活性后,MIR106A-5p和BTG3敲除细胞中的p-MAP2K1、p-MAPK1和p-MTOR水平和ATG表达被挽救(图8E),这表明激活的MAPK信号部分负责NPC中MIR106A-5p-BTG3轴抑制自噬。
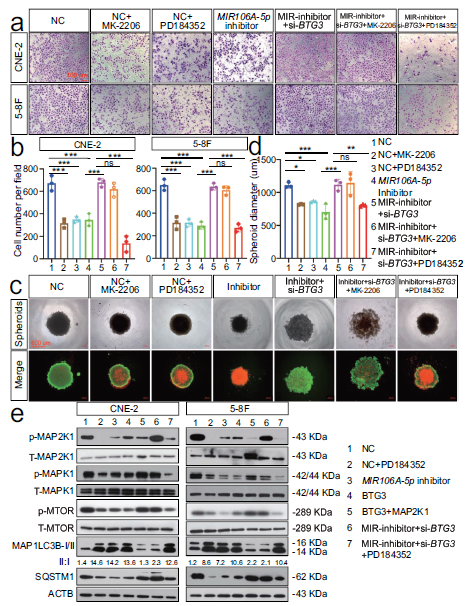
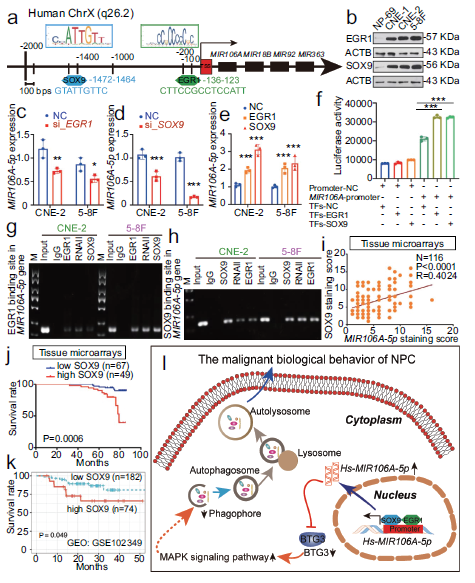
9.鼻咽癌中MIR106A-5p上调是EGR1和SOX9增加反式激活的结果
我们检查了MIR106A-5p在鼻咽癌中是如何上调的。对MIR106A-5p启动子的序列分析确定了EGR1和SOX9分别位于−136和−1472处(图9A),表明EGR1和SOX9调节MIR106A-5p的转录。值得注意的是,在鼻咽癌细胞系中,EGR1和SOX9均上调(图9B)。沉默EGR1和SOX9表达降低MIR106A-5p水平,并且EGR1和SOX9的过表达增加了MIR106A-5p水平(图9C-E)。此外,荧光素酶报告分析和染色质免疫沉淀分析表明,EGR1和SOX9都直接与MIR106A-5p启动子的预测结合位点结合,并反式激活MIR106A-5p(图9F-H)。应用IHC和ISH法对鼻咽癌组织中SOX9和MIR106A-5p表达的相关性表明,SOX9的表达与MIR106A-5p水平呈正相关(图9I)。鼻咽癌生存分析组织微阵列进一步显示,与低表达SOX9的鼻咽癌患者相比,SOX9高表达患者的预后较差(图9J)。GEO和TCGA数据库分析也证实了这些预测结果(图9K)。这些结果表明MIR106A-5p在鼻咽癌中的过表达是由于EGR1和SOX9增加了反式激活。
结论:
本研究揭示MIR106A-5p在鼻咽癌自噬和促进恶性表型中的作用。在鼻咽癌中,MIR106A-5p通过靶向BTG3和激活自噬调节MAPK信号通路促进恶性表型。我们的结果表明MIR106A-5p的定量在治疗前预测复发率和生存率是有用的。综上所述,我们的发现可以为自噬相关鼻咽癌治疗的临床应用提供新的见解。






