癌细胞想存活——硒解毒少不了
微量营养素硒通过硒代半胱氨酸生物合成途径被结合到稀有氨基酸硒代半胱氨酸中,这是硒蛋白如谷胱甘肽过氧化物酶和硫氧还蛋白还原酶所需要的。近日,美国麻省大学医学院的研究人员在Nature Metabolism杂志上发表了题为:Selenium detoxification is required for cancer-cell survival 的研究论文。该研究证实了硒半胱氨酸生物合成途径中的代谢酶——SEPHS2,具有硒解毒作用,而这一解毒作用是癌细胞生存所必须的。在这项研究中,研究团队通过CRISPR-Cas9基因编辑技术敲除已知的解毒酶,进一步筛选分析后,研究小组将研究重点聚焦于SEPHS2。

代谢改变是癌症的标志,产生癌细胞所需代谢产物的酶是治疗的诱人靶标。但是,当肿瘤环境中存在相同的代谢物时,靶向这些酶的功效可能有限,作者试图确定癌细胞中可能需要的代谢酶,以防止有毒代谢产物的积累。为了首先鉴定内源性产生的有毒代谢物,作者使用来自NIH毒理学数据网络(TOXNET)的毒理学数据对人体代谢网络中的代谢物进行了交叉检查。并且将测试扩展到其他癌细胞系和未转化的细胞后,作者发现SEPHS2基因敲除(KO)对22种癌细胞系中的12种具有毒性,但对7种正常细胞系没有毒性。值得注意的是,SEPHS2的丧失对作者测试的所有正常(未转化的永生或初级)细胞系(如乳腺上皮细胞系MCF10A和MCF12A以及初级肺和结肠成纤维细胞)均无毒。因此,SEPHS2是一种在许多癌细胞中生存必不可少的酶,但出乎意料的是在正常细胞中是必需的。在乳腺癌的原位异种移植模型中破坏SEPHS2后,发现SEPHS2是一种在乳腺癌细胞中过表达并且是生存所必需的酶。总体而言,这些发现表明SEPHS2是癌症治疗的极具吸引力的靶标,因为SEPHS2是具有疏水底物口袋的代谢酶,因此可能是可药物治疗的。

25个含有硒代半胱氨酸残基的蛋白质,其中包括抗氧化酶,如谷胱甘肽过氧化物酶4(GPX4)和硫氧还蛋白还原酶1(TXNRD1)。这些酶中任何一种的破坏都会导致硒蛋白水平的急剧下降,包括SEPHS2本身。SEPHS2也是一种硒蛋白,它对于正常细胞的存活不是必需的。MDAMB231癌细胞中的SEPHS2 KO导致生长速率严重降低,并最终在第20天左右恢复。 SEPHS2和几种硒蛋白最初在人群中被消耗掉,但随后在第16天到第20天之间恢复。这表明正常细胞在基础条件下的存活和增殖既不需要SEPHS2也不需要硒蛋白。

由于SEPHS2本身产生的硒蛋白对于细胞存活不是必不可少的,因此作者认为癌细胞可能具有正常细胞所没有的硒排毒需求这一假设。有趣的是,表达SLC7A11水平升高的细胞比正常细胞和很少或没有SLC7A11的细胞吸收更多的硒(即“嗜硒”)。因此,SLC7A11是硒进口和selenite在癌细胞中的毒性作用所必需的。作者假设通过这种机制将selenite还原成硒将足以进口硒,因为硒的挥发性很高。SLC7A11的破坏导致硒蛋白表达降低,表明其在促进硒蛋白生成中的作用。总的来说,这些结果表明SLC7A11参与以下模型:亲脂性癌细胞中SLC7A11的高表达导致胱氨酸的进口增加,细胞中胱氨酸向半胱氨酸的减少,并通过未确定的出口子出口。这导致硫醇(来自半胱氨酸)在细胞外积累,这可以将selenite还原为挥发性硒化物,并可以诱导其进入细胞并引起细胞毒性。作者发现,与非亲脂性正常细胞相比,亲脂性乳腺癌细胞对诱导铁氧化的促氧化剂叔丁基氢过氧化物(TBH)以及对营养饥饿和缺氧的抵抗力增强。
相比之下,通过SEPHS2,PSTK或SEPSECS KO或GPX4自身的KO破坏硒代半胱氨酸的生物合成,会使细胞对TBH敏感,表明硒代半胱氨酸的生物合成途径在抵抗硒性细胞的铁素体侵袭中起着作用。通常对SEPHS2 KO毒性具有抗性的MCF10A细胞中FSP1的KO使它们变得敏感。 FSP1的功能解释了这些细胞如何耐受SEPHS2 KO,即使它导致GPX4丢失。总的来说,硒代半胱氨酸途径的上调通过防止铁死亡病而对癌细胞有利,而由于存在抗铁死亡的机制,其未丢失的细胞可忍受其丢失。此外,SEPHS2 KO对癌细胞的超敏性促进了它们对癌细胞的毒性。
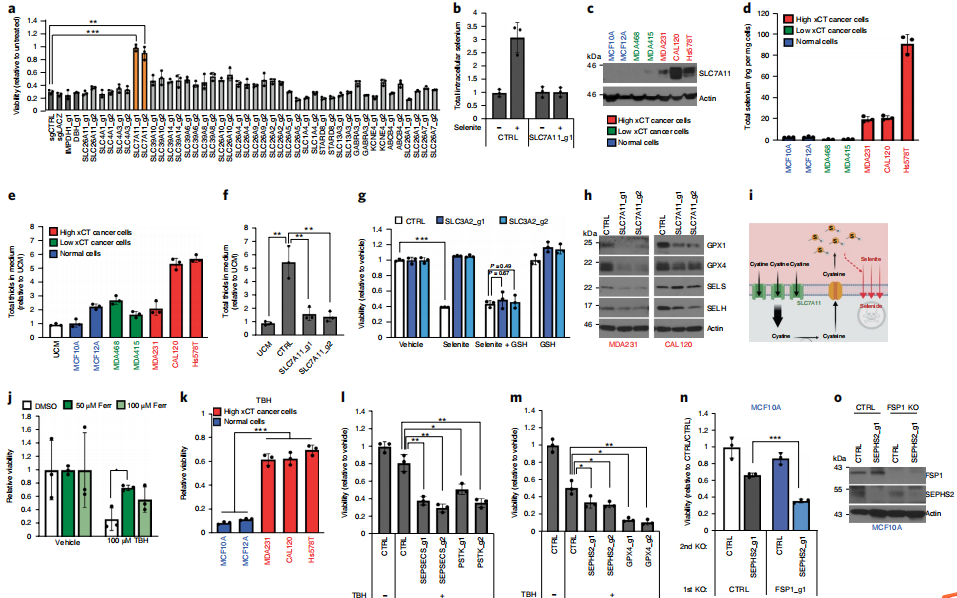
作者发现细胞可以耐受SLC7A11的丢失和防止后续SEPHS2 KO的毒性,表明SLC7A11直接导致对SEPHS2的依赖性,并表明毒性的功能获得方式。作者也检查癌细胞中是否需要SEPHS2来解毒硒代半胱氨酸生物合成途径产生的硒。结果显示,SEPHS2的过表达保护癌细胞免受selenite的毒性,而SEPHS2的丢失则与selenite产生了协同作用。由于硒化物易挥发,无法通过常规液相色谱-质谱(LC-MS)方法检测,也不能作为常规的有毒药物处理,因此作者必须开发一种可控方式处理硒化物至细胞的系统,因为以及直接检测硒化物的方法。首先,观察到颜色变化与距离直接相关,表明在这些斑点中捕获了挥发性硒化物。重要的是,这些斑点的电感耦合等离子体质谱(ICP-MS)表明硒具有稳健的存在,证明作者正在捕获挥发性硒化物气体。作者观察到毒性遵循气体源放射状放射状,毒性与接近度相关。使用该处理系统,作者直接测试了破坏或过度表达SEPHS2对铺板到与硒化物气体源相等距离处的细胞的作用。 SEPHS2致敏的癌细胞对硒的破坏,SEPHS2的过表达保护癌细胞免受硒的侵害。因此,SEPHS2具有硒化物解毒功能。
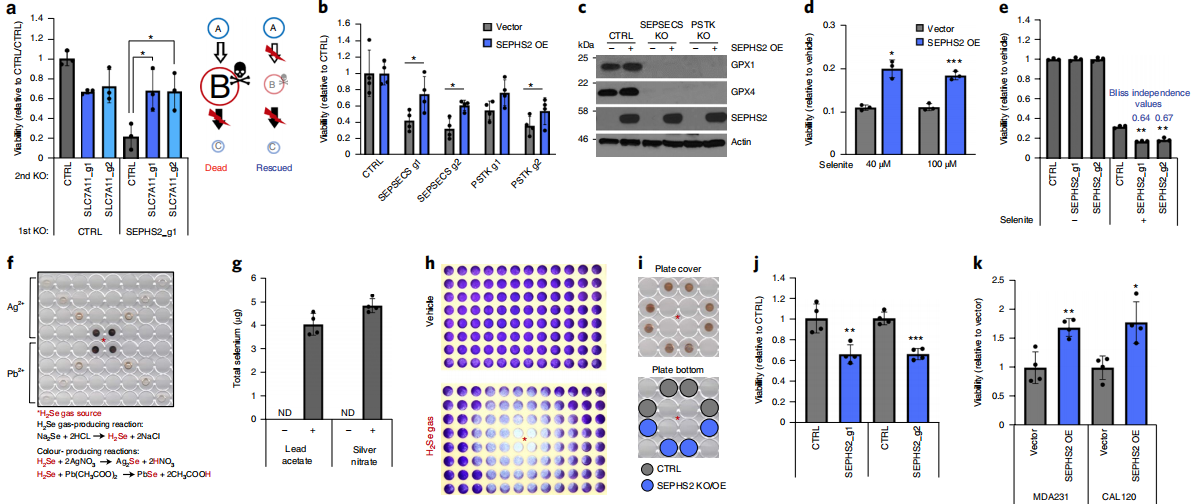
结 论:
总而言之,硒代半胱氨酸生物合成途径中的一种酶——硒代磷酸合成酶2 (SEPHS2),对癌症细胞的存活是必需的。癌细胞需要SEPHS2来解毒硒化物,硒化物是硒代半胱氨酸生物合成过程中形成的中间体。乳腺癌和其他癌症细胞是嗜硒的,这是由于胱氨酸/谷氨酸反转运体SLC7A11的第二功能,其促进硒的摄取和硒代半胱氨酸的生物合成,通过允许产生硒蛋白如GPX4,保护细胞免于铁死亡。然而,硒化物是有毒的,必须通过SEPHS2处理。因此,作者发现在乳腺癌患者的样本中,SEPHS2蛋白水平升高,并且SEPHS2的缺失损害了小鼠原位乳腺肿瘤异种移植物的生长。总之,作者确定了癌细胞的脆弱性,并确定了硒代谢在癌症中的作用。






