不再是焦亡:中性粒细胞中N-GSDMD新功能
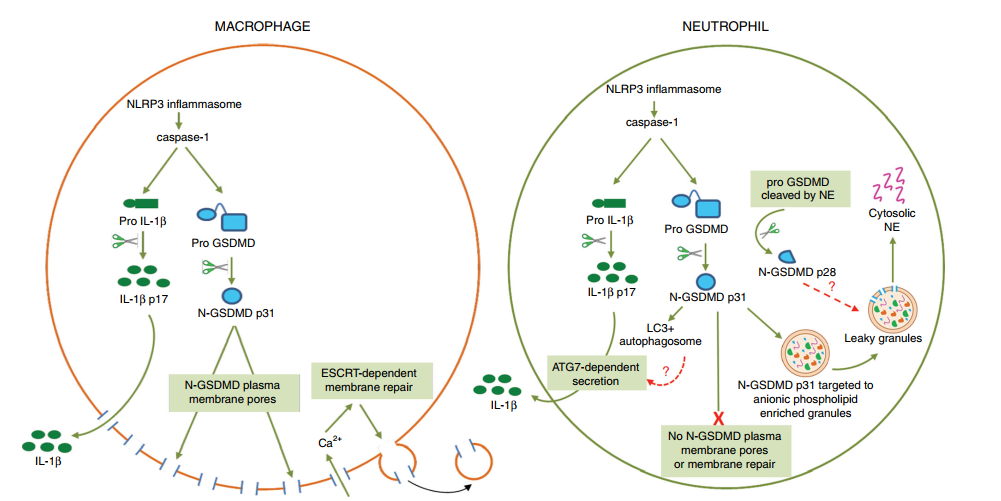
2020年5月,《Nat Commun》杂志发表“N-GSDMD trafficking to neutrophil organelles facilitates IL-1β release independently of plasma membrane pores and pyroptosis.”文章,此报道发现在人和小鼠中性粒细胞中却发现了不一样的结论,虽然在NLRP3炎性小体激活时仍然分泌IL-1β,但N-GSDMD并不会聚集到质膜(PM),也不增加PM的通透性或引起焦亡。通过一系列的生化实验对质膜通透性的功能分析、亚细胞组分的生化分析,以及用一种识别N-GSDMD但不识别pro-GSDMD的新型单克隆抗体对单个中性粒细胞的超分辨成像,作者发现炎症激活的中性粒细胞和巨噬细胞的巨大差异,在中性粒细胞在中存在:1.N-GSDMD不会聚集在质膜中成孔;2.不激活Ca2+调节的质膜修复;3.不将N-GSDMD蛋白转运到质膜,而是将N-GSDMD转运到嗜蓝颗粒(azurophilic granules,易被苯胺蓝染)和自噬体;4.通过自噬机制依赖的途径释放IL-1β。此外,N-GSDMD通透性释放弹性蛋白酶到胞浆中,介导丝氨酸蛋白酶依赖的GSDMD二次断裂。这些结果表明,N-GSDMD的动态分布除了与质膜结合外,还与丰富的细胞内细胞器膜结合,这些发现揭示了中性粒细胞和巨噬细胞之间GSDMD转运的根本差异,这是炎症激活过程中中性粒细胞特异功能的基础。

机制图:
结果:
一、中性粒细胞中没有浆膜GSDMD孔
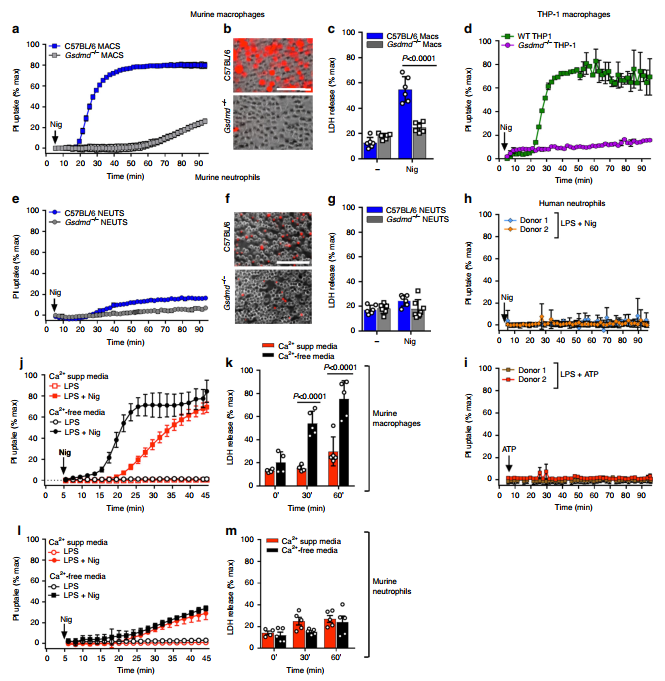
目前还没有研究直接检验N-GSDMD在黑质素或ATP激活NLRP3炎性小体后是否会在中性粒细胞质膜中形成气孔。我们发现,正如报道的那样,nigericin触发了C57BL/6巨噬细胞中强劲的碘化丙啶(PI)内流,而不是Gsdmd−/−巨噬细胞 (Fig. 1a, b). 活化的巨噬细胞进行成像结果显示甘氨酸抑制焦亡。然而,在没有甘氨酸的情况下,nigericin可刺激C57BL/6巨噬细胞释放LDH,而不刺激Gsdmd /巨噬细胞释放(图1c)。ATP触发了类似的PI内流和LDH释放反应,且是Gsdmd依赖的(补充图2a c)。我们还观察到,在nigericin刺激的人THP-1巨噬细胞中,PI被快速摄取,而在CRISPR产生的Gsdmd / THP-1细胞中则没有(图1d)。
与巨噬细胞形成鲜明对比的是,C57BL/6小鼠在被黑质素或ATP刺激后,骨髓中性粒细胞中PI摄取和LDH释放均未增加(图1e g,补充图2d f)。定量流式细胞术证实了巨噬细胞和中性粒细胞在PI摄取上的差异(补充图2g-j)。同样,健康受试者(n = 8)在黑质酸蛋白或ATP刺激下,经lps诱导的血液中性粒细胞中也未检测到PI的摄取(图1h, i)和LDH的释放(补充图3a),尽管这些刺激导致IL-1β分泌旺盛(补充图3b)。因此,在IL-1β释放速率高的时间点,小鼠和人中性粒细胞在质膜上不会积累有功能的GSDMD孔。与Gsdmd - / -中性粒细胞相比,黑质酸处理的C57BL/6中性粒细胞的PI积累略有增加(图1e)可能反映了骨髓中未成熟和成熟的中性粒细胞亚群之间的异质性,而在受刺激的人血中性粒细胞中没有观察到这种异质性(图1h)。
针对巨噬细胞浆膜中GSDMD孔的积累,激活强大的Ca2+影响依赖的膜修复机制,以对抗热腐蚀裂解。我们比较了在无Ca2+或Ca2+补充的培养基中受到黑质酸刺激的小鼠中性粒细胞和巨噬细胞的PI内流和LDH释放反应. 如图1j、k所示,细胞外Ca2+的缺失(以及随之而来的Ca2+内流)显著增加了nlrp3活化的巨噬细胞中PI内流和LDH的释放,这与IL-1释放增强相关(补充图4a)。相比之下,细胞外Ca2+的缺失并不促进或改变nlrp3激活的中性粒细胞的PI通透性、LDH释放或IL-1抑制分泌(图1l, m,补充图4b)。
GSDMD和GSDMA3膜孔的低温电镜结构显示出与孔形成蛋白的MACPF/CDC(膜攻击复合物穿孔蛋白样/胆固醇依赖性溶胞素)家族成员类似的拓扑结构。因此,我们研究了中性粒细胞中GSDMD孔形成的缺失是否是由于其质膜对成孔蛋白作用的内在阻力。C57BL/6和Gsdmd−/−中性粒细胞被亚溶解浓度的肺炎链球菌外毒素溶肺素(Ply)刺激,后者是一种MACPF/CDC蛋白。Ply诱导嗜中性粒细胞和巨噬细胞大量PI内流,尽管与Gsdmd−/−巨噬细胞相比,C57BL/6巨噬细胞在对Ply的反应中表现出更大的PI内流(补充图5a)。我们使用NLRP3抑制剂MCC950表明,这是由于通过Ply孔的一次内流和通过N-GSDMD孔的二次内流的共同作用造成的。
因此,在中性粒细胞NLRP3炎性小体激活过程中,GSDMD不会在细胞膜上形成小孔,这不是Ca2+依赖的膜修复或对MACPF/ cdc样孔形成蛋白的内在抵抗的结果。
二、N-GSDMD不定位于中性粒细胞质膜
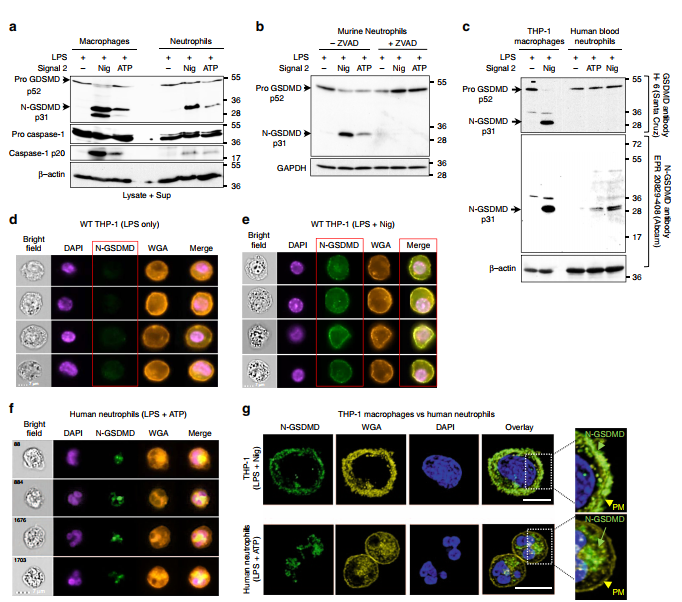
为了确定中性粒细胞中没有质膜GSDMD孔的机制,我们通过western blot和免疫荧光成像检查了GSDMD的处理和N-GSDMD的定位。中性粒细胞提取物常规在补充了Diisopropyl Fluorophosphate (DFP)的RIPA裂解缓冲液中制备,DFP是一种对中性粒细胞颗粒中高水平存在的多种丝氨酸蛋白酶的不可逆抑制剂。通过结合全细胞裂解液和细胞外上清进行western blot分析,我们发现NLRP3激活的小鼠中性粒细胞中p52 pro-GSDMD与p31 N-GSDMD的过程在定性上与小鼠巨噬细胞相似(图2a)。但中性粒细胞中p31 N-GSDMD的积累量低于巨噬细胞。使用针对小鼠GSDMD的两种不同抗体克隆,我们发现在NLRP3炎性小体激活之前,lps介导的中性粒细胞和巨噬细胞中p52前GSDMD水平相似(图2a和补充图6a);然而,与巨噬细胞相比,nlrp3激活的中性粒细胞中p31 N-GSDMD较少,这与cleaved caspase-1的产生减少有关(图2a)。pan-caspase抑制剂zVAD阻断了中性粒细胞p31 NGSDMD的Pro-GSDMD裂解(图2b),表明与巨噬细胞3,20一样,中性粒细胞p31 N-GSDMD的积累依赖于caspase。
受nigericin刺激的小鼠巨噬细胞除了产生p31 N-GSDMD外,还产生28 kDa的N-GSDMD产物(图2a和补充图6b)。较小的GSDMD产物的积累被DEVD-fmk抑制(Supplementary Fig. 6b),表明在GSDMD裂解过程中除了caspase-1, caspase-3/7也起作用。这与caspase-1在炎性体刺激的巨噬细胞中二次激活caspase-7的报道一致21。虽然caspase-3/7可以在asps -8722位点切割人和小鼠的GSDMD,但在小鼠,而不是人,GSDMD也含有IPVD motif中的asps -27。caspase-1和caspase- 7联合裂解ps -276位点的小鼠GSDMD,可以得到27.4 kDa的产物。
我们还使用两种不同的人GSDMD抗体,比较了GSDMD在人血中性粒细胞和人THP-1巨噬细胞中的表达和加工过程(图2c)。H-6兔单克隆抗体(Santa Cruz)可识别proGSDMD和p31 N-GSDMD,而一种新的兔单克隆抗体(Abcam EPR20829-408)最初由Shao和同事产生,目前已上市,可识别人p31 N-GSDMD裂解产物,但不能识别pro-GSDMD。我们发现,H-6 Ab可以检测到THP-1细胞和人中性粒细胞中的pro-GSDMD,而EPR20829-408不能检测到(图2c), EPR20829-408在中性粒细胞和THP-1细胞中均检测到p31-N-GSDMD。尽管H6 Ab检测到黑质粒素刺激THP-1巨噬细胞45分钟后proGSDMD处理接近完成,但ATPor黑质粒素刺激的人中性粒细胞中的p31-N-GSDMD低于H6检测阈值。因此,人和鼠中性粒细胞一样,在NLRP3炎症小体信号传导过程中积累p31 N-GSDMD,但其数量水平低于巨噬细胞。
在LPS/nigericin活化的THP-1巨噬细胞中,n- gsdmd与质膜标记物小麦胚芽凝集素(WGA)共定位,而仅用LPS引物修饰的THP-1细胞缺乏抗n- gsdmd反应性(图2d, e)。
在nlrp3刺激的Gsdmd / THP-1巨噬细胞中也没有NGSDMD染色(补充图7)。
与THP-1巨噬细胞相比,通过Imagestream分析,N-GSDMD不在nlrp3激活的人中性粒细胞的质膜中检测到,而是在细胞内基因座中积累(图2f)。共聚焦显微镜显示,中性粒细胞胞浆中有离散的N-GSDMD点状染色,而巨噬细胞中N-GSDMD定位于细胞表面(图2g)。
因此,尽管p31 N-GSDMD在caspase-1活化的人中性粒细胞中产生,但它并不定位于质膜,因此也不形成有功能的细胞表面孔。相反,N-GSDMD作为指示细胞器的胞内斑点积累。
三、N-GSDMD介导中性粒细胞弹性蛋白酶的胞浆释放
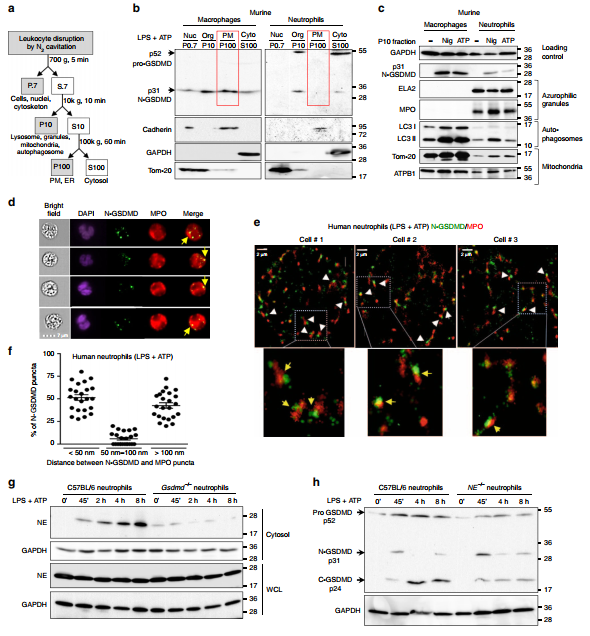
我们使用生化和成像方法识别nlrp3激活的小鼠中性粒细胞和巨噬细胞中N-GSDMD的亚细胞定位。用N2空化产生无洗涤剂细胞匀浆,并连续离心,如图3a所示:
(a)除去细胞核和未分裂的细胞700 g, (b) 10k g产生P10亚细胞器馏分,(c) 100k g分离质膜(P100)和细胞质(S100)。每个部分的蛋白用SDS-PAGE分解,用western blot检测GSDMD的pro和cleaved形式。与之前的分析一致(见3,20),p31-N-GSDMD在LPS/ atp刺激的巨噬细胞的P100组分中积累,并在质膜标记物cadherin中富集(图3b),在P10组分中也富集。与巨噬细胞相比,p31-N-GSDMD在LPS/ atp活化的中性粒细胞P100组分中未检测到,但与巨噬细胞相比,N-GSDMD在S100细胞质和P10颗粒组分中检测到(图3b)。在LPS/nigericin刺激的中性粒细胞和巨噬细胞制备的亚细胞组分中也观察到类似的结果(补充图8a)。被LPS引物而非炎性体激活的中性粒细胞在胞浆中仅显示全长pro-GSDMD(补充图8b)。在这些分离过程中,受刺激的中性粒细胞释放成熟的IL-1和caspase-1 p20进入细胞外培养基,尽管细胞膜上没有p31 N-GSDMD(补充图8c)。此外,p31 N-GSDMD被释放到受刺激巨噬细胞的培养上清中,但没有中性粒细胞(Supplementary Fig. 8d),与巨噬细胞的焦解一致,但没有中性粒细胞。
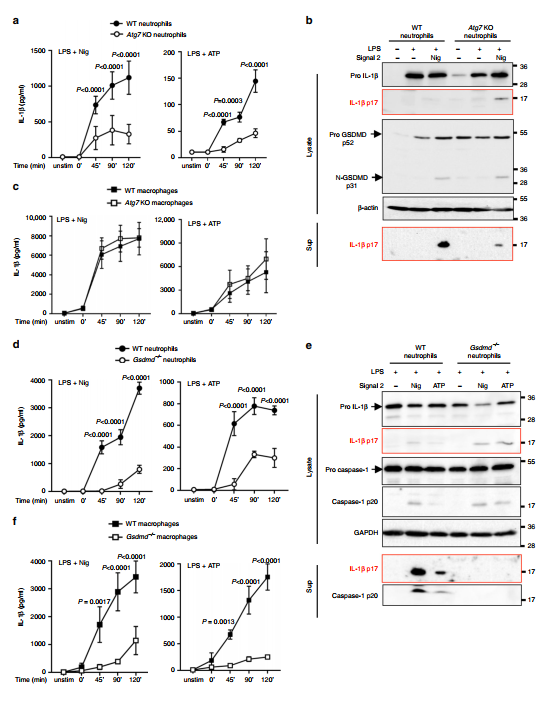
NLRP3激活的中性粒细胞和巨噬细胞的P10组分中存在p31 N-GSDMD,而非未受刺激的细胞,这与两种细胞类型中多个胞内细胞器标记的存在相关;其中包括线粒体(Tom-20和ATBP1)和自噬体(LC3-II)(图3c)。然而,P10部分的中性粒细胞,而不是巨噬细胞,在嗜氮颗粒标志物(髓过氧化物酶/ MPO和中性粒细胞弹性酶/NE)中富集。为了确定N-GSDMD是否为嗜氮颗粒,我们先用ATP刺激lps诱导的人血中性粒细胞45分钟,然后用N-GSDMD选择性EPR208209抗体和抗mpo进行免疫染色。通过成像扫描分析(图3d)和超分辨率成像(图3e, f)检测细胞。通过Imagestream分析检测代表性细胞,发现N-GSDMD和MPO点状染色(图3d);然而,这种关联在超分辨率图像中更为明显,显示在25 75%的N-GSDMD斑点中N-GSDMD与MPO (<50 nm)接近(图3e, f)。我们在LPS/ATP刺激下分离C57BL/6和Gsdmd /小鼠的骨髓中性粒细胞,分离无器官的S100细胞质部分,并通过western blot检测中性粒细胞弹性蛋白酶(NE)。我们发现,NE在C57BL/6中性粒细胞的细胞质中随时间积累,而在Gsdmd /中性粒细胞中不积累(图3g)。
四、N-GSDMD在中性粒细胞中定位为LC3+自噬体
我们比较NLRP3 inflammasome-mediated生产和释放il - 1β分泌在初级中性粒细胞从控制鼠标应变表达ATG7液氧轨迹(Atg7f / f)与中性粒细胞从老鼠myeloid-specific删除ATG7派生与LysMCre穿越后小鼠(Atg7MΔ)27。Nigericin——或者ATPstimulated il - 1β释放显著减少Atg7MΔ中性粒细胞相对于Atg7f / f中性粒细胞(图4),水平的pro-IL-1β,proGSDMD p31-N-GSDMD发现Atg7f / f和Atg7MΔ中性粒细胞溶解产物(图4 b)。
ASC寡聚化和caspase-1处理也相同的刺激Atg7f / f和Atg7MΔ中性粒细胞(补充图12)。因此,ATG7在IL-1释放中的作用是在NLRP3炎症小体组装和caspase-1前IL-1的下调的下游。与中性粒细胞,没有差别在il - 1β分泌Atg7f / f和Atg7MΔNLRP3刺激中巨噬细胞完整的氨基酸培养基后食道(图4 c)。
降低il - 1β的中性粒细胞释放Atg7MΔ小鼠拟表型观察到的响应从Gsdmd /小鼠中性粒细胞。在典型炎性小体激活后IL-1抑制分泌,细胞内保留p17 IL-1抑制物,而IL-1前总细胞积累或活性caspase-1的生成没有差异(图4d, e)。
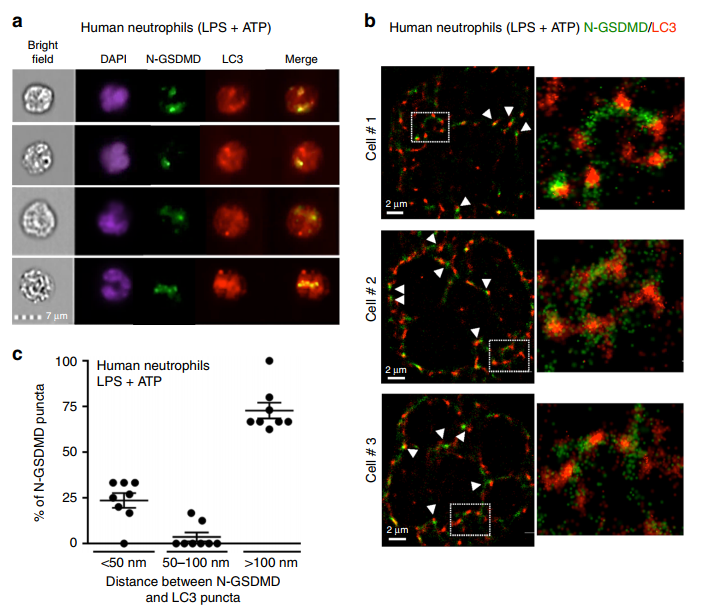
为了确定N-GSDMD是否与中性粒细胞自噬体相关,我们将LPS/ atp刺激的人中性粒细胞与N-GSDMD抗体和LC3共染色,用于单细胞成像和超分辨率显微镜观察。我们通过Imagestream检测N-GSDMD与LC3斑点的重叠(图5a),风暴成像显示约25%的N-GSDMD斑点与LC3非常接近(50 nm)(图5b, c)。
3个代表性细胞LC3+/N-GSDMD+小泡的高亮区域与N-GSDMD整合到自噬体膜一致(图5b,右面板)。
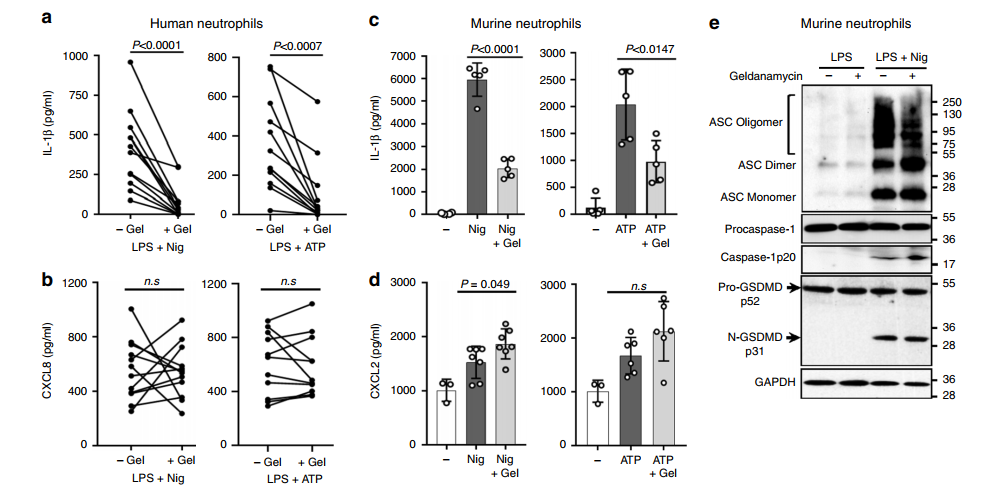
为了进一步研究自噬是否在中性粒细胞分泌IL-1的过程中发挥作用,我们使用Hsp90抑制剂格尔达霉素抑制货物装载进入自噬机制。Schekman和他的同事在自噬辅助IL-1分泌的HEK293细胞工程模型中证明,格尔达那霉素阻断了Hsp90伴侣辅助的成熟IL-1细胞转运到自噬小体囊膜中间产物。
在LPS启动后,在nigericin或ATP激活NLRP3之前,12个供体外周血的人中性粒细胞和小鼠中性粒细胞被格尔达那霉素孵育。每个人供体的格尔达那霉素处理的中性粒细胞IL- 1分泌均受到显著抑制(图6a),其抑制不是由于细胞活力受损,因为传统的ER-Golgi途径对CXCL8/IL-8的分泌没有影响(图6b)。
与对照组相比,格尔达霉素处理的小鼠中性粒细胞释放的IL-1蛋白也明显减少,而CXCL2的分泌没有受到抑制(图6c, d)。
此外,在nlrp3激活的小鼠中性粒细胞中,格尔达霉素处理没有抑制ASC寡聚、caspase-1处理或GSDMD裂解(图6e),表明N-GSDMD作用于炎性小体组装和caspase-1激活的下游,从而抑制IL-1的出口。






