单细胞RNA测序简直不要太强悍!分分钟揭示肿瘤浸润NK细胞的机制
在癌症的免疫治疗中如何提高免疫细胞的功能仍然是临床医学的重要挑战。缺氧是实体肿瘤的共同特征,细胞通过上调转录因子HIF-1α适应缺氧环境。本文通过使用单细胞RNA测序(scRNA-seq)技术揭示了小鼠肿瘤浸润自然杀伤(NK)细胞的转录谱,并于2020年6月16日发表在Immunity(IF:22.553)期刊上。
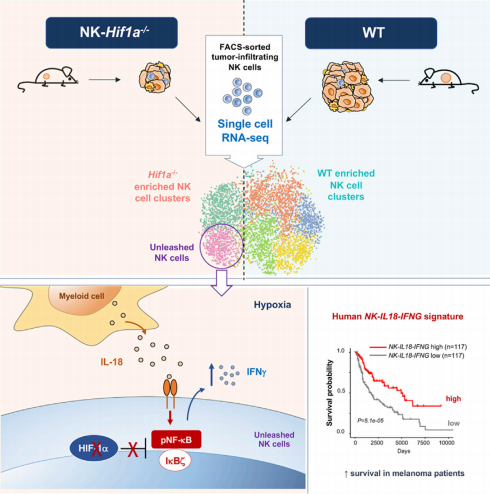
图解摘要如下:
A. NK细胞缺乏HIF-1α会降低肿瘤的生长;
B. 单细胞RNA测序技术揭示肿瘤中HIF-1α-/-NK细胞被激活;
C. IL-18驱动HIF-1α-/-NK细胞中NK-kB、Ikb和Ifng高表达;
D. NK-IL18-IFNGhi特征与癌症患者生存率的增加相关。
结果如下:
1、HIF1a缺失的NK细胞展现出抗肿瘤活性和抑制肿瘤生长的潜力
实体肿瘤具有缺氧特征,这可以重塑免疫细胞的功能,为了探究HIF-1α在长时间暴露于缺氧和实体肿瘤组织中调节NK细胞响应中的作用,作者构建了NKp46+细胞HIF-1α缺失的小鼠,并发现HIF-1α敲除不改变NK细胞在不同器官中的数量或成熟分化标志物CD27和CD11b的表达,如脾脏,血液,肺和肝等。
为了进一步探究HIF1a缺失的NK细胞的抗肿瘤活性,作者构建了不同类型的肿瘤模型,然后检测发现,与野生型小鼠相比,HIF1a缺失的NK细胞小鼠中的肿瘤大小显著下降,而MHC缺失对照组的肿瘤大小则没有明显改变(图1A)。与此一致的是,HIF1a缺失的NK细胞小鼠的脾脏中NK细胞具有更高的IFN-g和granzyme B的表达,并对肿瘤细胞变现出更强的异常调控(图1B)。随后作者注射了肺癌细胞重现了上述研究(图1C)。为了检测HIF1a缺失的NK细胞的细胞内在潜能,作者将HIF1a缺陷的NK细胞转入敲除T、B、NK细胞的Rag2-/-Il2rg-/-小鼠体内,再接种肿瘤细胞。结果发现这导致肿瘤生长显著下降(图1D),表明HIF-1α具有细胞内在调控NK细胞抗肿瘤活性的功能。
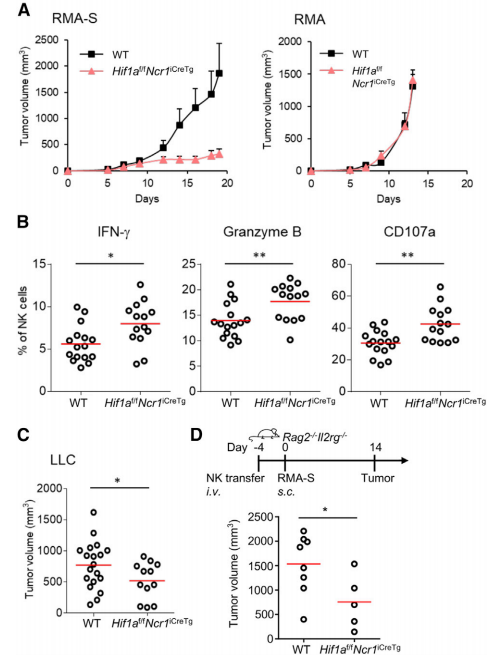
图1 NK细胞HIF1a缺失导致肿瘤生长减少
2、肿瘤浸润NK细胞的高通量scRNA-seq发现在Hif1a - / -小鼠中发现一个独特的NK效应亚群
本文中高通量scRNA-Seq共分析了5721个NK细胞,3075个来自WT小鼠,2646个来自HIF-1α缺失小鼠,并分别从野生型和HIF-1α缺失NK细胞中鉴定到1763和1563个转录本。对所有细胞进行无差别聚类,共聚成6类,而野生型和HIF-1α缺失NK细胞明显具有不同分布(图2B-C)。值得注意的是,HIF-1α缺失NK细胞约有近60%聚为1和4类种群,而在1和4类种群中大约有90%的细胞是来源于HIF-1α缺失NK细胞(图2D-E)。与此相反,野生型NK细胞大多分布在2,3,5,6类群中。此外,来自1,2,3类群中的细胞明显分为Cd11blowCd27high两种趋势分布,而来自4,5,6类群中的细胞明显分为Cd11bhighCd27low两种趋势分布(图2F-G)。其余的几种基因表达也发现了类似的情况,如f Klrg1, Ncr1 (NKp46), Klrb1c (NK1.1), Itga2 (CD49b, DX5), Klra3 (Ly49C), and Klra9 (Ly49I)。另外,1,2,3类群中的细胞部分转录本的表达增加,如PD-1,TIGIT,CTLA4(图2G)。而趋化因子Ifng和CD69在HIF-1α缺失NK细胞上调(图2H)。在4类群中,占总细胞总数10%的WT NK细胞也表现出Hif1a的低表达(图2I)。在WT NK细胞中,Hif1a及其靶基因的低表达与Ifng转录升高相关(图2I),说明Hif1a在调节NK细胞激活和效应功能方面的负作用。

图2 肿瘤浸润NK细胞的高通量scRNA-Seq显示Hif1a - / -簇具有独特的转录特征
随后,作者分析了上述差异表达基因的通路富集情况,发现HIF-1α缺失NK细胞富集于NF-kB通路,或者涉及到NF-kB激活的其它通路(图3A)。其中包括转录本NFkB1(p50 / p105)(Nfkb1),RelA(p65)(Rela)和其他NF-kB家族成员的转录本,例如NF-kB2(p52 / p100)(Nfkb2),c-Rel(Rel) 和RelB(Relb)(图3B)。此外,还报道了编码IkBz的NF-kB靶基因Nfkbiz的表达,IkBz是一种据报道在细胞因子刺激后可驱动NK细胞产生IFN-g的核因子(图3C和2F)。其他NF-kB靶基因,例如Nfkbia,Nr4a1,Ccl3,Ccl4和Icam1,主要在类群4中共表达(图3C和2F)。重要的是,NF-kB激活的这种富集与Ifng基因的高表达(图3D)以及NK细胞活化特征相关(图3E)。为了证实HIF-1α缺失的肿瘤浸润NK细胞中NF-kB途径的激活,使用流式细胞仪确定了磷酸化的p65(p-p65),p50和IkBz的表达。结果证实与WT肿瘤浸润NK细胞相比,HIF1a缺失中NK细胞中p-p65和p50表达增加以及IkBz的诱导增加(图3F)。
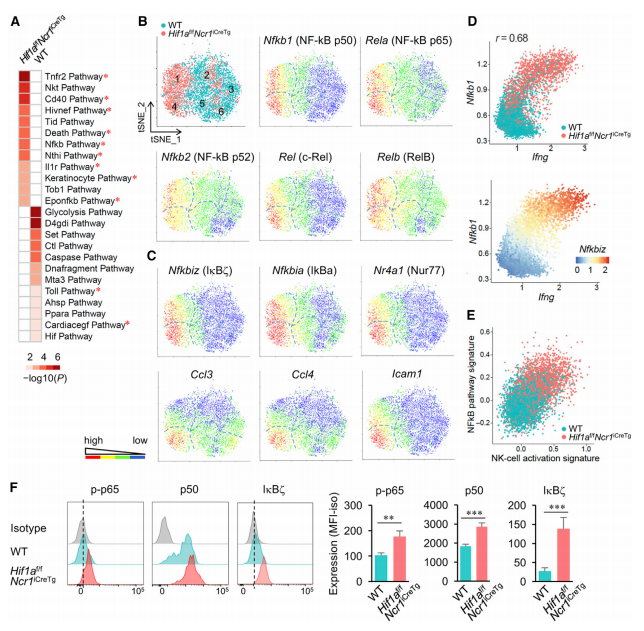
图3 scRNA-seq识别肿瘤中活化的HIF1a - / - NK细胞亚群
3、HIF1a - / - NK细胞的抗肿瘤活性依赖于骨髓细胞来源的IL-18
为了探索驱动肿瘤浸润的Hif1a - / - NK细胞中增强NF-kB活性的因素,分析了全肿瘤组织中的细胞因子和趋化因子转录谱。 与scRNA-seq数据一致,与WT小鼠相比,Ifng是Hif1af / fNcr1iCreTg小鼠肿瘤组织中表达最高的转录物(图4A)。肿瘤细胞分类分析和肿瘤浸润免疫细胞显示II18转录主要存在于肿瘤浸润免疫细胞中,如单核细胞和巨噬细胞,而树突状细胞在较低的范围内表现出II18的高表达(图4B)。观察到肿瘤组织中IL-18蛋白含量与基因型无关(图4C),表明IL-18的可用性在这些肿瘤之间没有差异。
但是,与WT NK细胞相比,包含IL-18受体(IL-18R)下游信号分子(包括IkBz和其他NF-kB家族成员)的IL-18途径在Hif1a缺陷NK细胞中含量很高(图4D)。因此,通过使用mAb注射中和IL-18来研究IL-18在RMA-S肿瘤控制中的作用。在野生型小鼠中,IL-18的中和作用不会改变肿瘤的生长(图4E)。相反,抗IL-18 mAb的应用消除了Ifng是Hif1af/f Ncr1iCreTg小鼠中肿瘤的延迟生长(图4E)。一致地,与对照小鼠相比,IL-18中和作用降低了来自Ifng是Hif1af / fNcr1iCreTg的肿瘤浸润NK细胞中pp65和p50的表达,并消除了IkBz的上调(图4F)。总之,这些发现表明,缺乏HIF-1a可以增强NK细胞对IL-18的反应能力,这是控制Ifng是Hif1af / fNcr1iCreTg小鼠肿瘤生长所必需的。

图4 HIF1a -/- NK细胞介导的抗肿瘤活性依赖于髓细胞来源的IL-18
4、小鼠NK中HIF-1a抑制导致效应功能增强和细胞代谢提高
为了进一步证实HIF1a -/- NK细胞中IL-18诱导的效应功能机制,在1%氧气的缺氧条件下培养脾脏HIF1a -/- NK细胞和WT NK细胞。结果发现,与WT相比,IL-12和IL-18刺激后,缺氧暴露的HIF1a -/- NK细胞中IFN-γ的产量更高(图5B)。使用药理抑制剂TPCA-1抑制NF-kB激活能完全阻断IFN-γ的产生(图5C),而不影响细胞活力和下游IL-18R的产量。这些表明NF-kB通路参与IL-18暴露中NK细胞的多种效应功能调控。
据报道HIF-1α调节免疫细胞分化和效应功能而参与细胞代谢。与代谢激活的WT相比,HIF-1α缺失NK细胞暴露于延迟缺氧7天,氧气消耗速率(OCR)没有显著差异,而暗示糖酵解的细胞外的酸化速率(ECAR)在后者中显著下降(图5D)。经IL-12和IL-18刺激后,ECAR升高至相似值,而OCR值在HIF-1α-/-NK细胞中较高。OCR升高,因此OCR/ECAR比例升高,与HIF-1α-/-NK细胞的IFN-γ产量提高有关(图5E)。因此,缺氧暴露的HIF-1α-/-NK细胞产生IFN-γ的能力增强与NF-kB途径的激活和代谢改变有关。
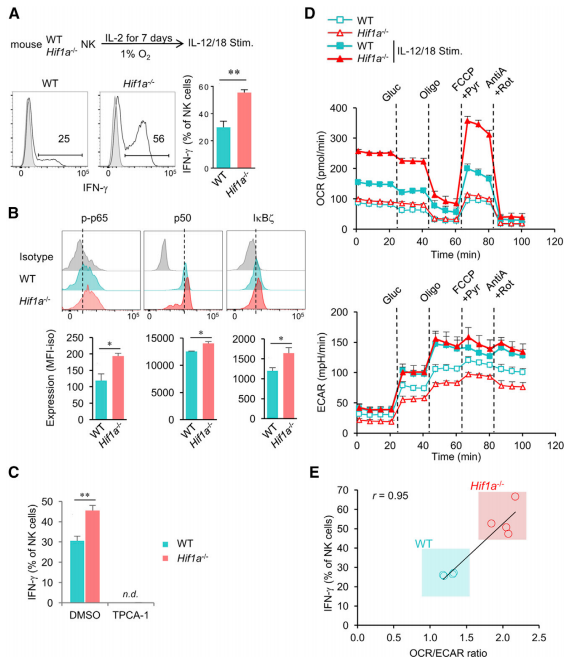
图5 HIF1a缺失的NK细胞经刺激后IFN-γ的产生增强与NF-kB通路激活和耗氧率增加有关
5、HIF-1α抑制导致激活的人NK细胞效应响应增强
为了研究抑制HIF-1α是否能以类似的方式增强人NK细胞的效应功能,用小分子化合物KC7F2,据报道可以抑制HIF-1α蛋白的稳定性和其靶基因转录,处理纯化的人外周血NK细胞。结果显示,人NK细胞使用KC7F2处理后在IL-2存在的情况下,显著增强了细胞脱粒作用以及IFN-γ和TNF-α的产生(图6A)。这些发现强调了HIF-1α抑制剂诱导高功能性人NK细胞的潜力。为了探究HIF-1α是否能够影响人NK细胞抗肿瘤响应,分析了NK细胞浸润非小细胞肺癌的转录表达谱。作者发现肿瘤浸润NK细胞表现出HIF1A高表达。这与其靶基因上调和IFNG下调的相关(图6B)。与肿瘤周围部位相比,NK-IL18-IFNG信号降低,进一步支持了NK细胞效应功能在肿瘤中的负调控,这与单个NK细胞中HIF1A的表达呈负相关(图6C)。这些结果表明人肿瘤浸润NK细胞的癌症病人中HIF1A表达与他们的抗肿瘤潜力呈负相关。
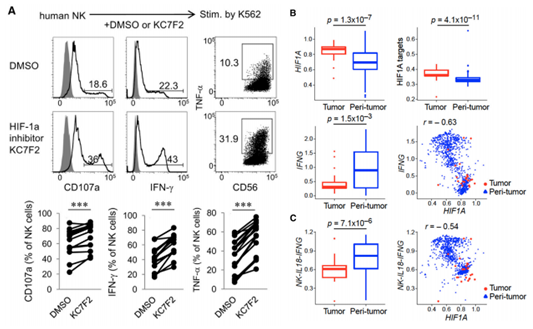
图6 HIF-1a在人NK细胞中的激活与抗肿瘤活性的降低相关
6、一个NK-IL18-IFNG信号预测改善不同癌症病人总体生存率
本文中,肿瘤微环境中IL-18的存在导致NK细胞反应增强,这由NF-kB激活和Ifng表达表明,而没有HIF-1a,则导致肿瘤生长减少。因此,单个人肿瘤浸润NK细胞中的NK-IL18-IFNG信号与HIF1A表达负相关。因此,分析了人类肿瘤样品中的整体NK-IL18-IFNG信号是否可预测癌症患者存活率的提高。对来自TCGA数据集的皮肤黑色素瘤(SKCM)的469位患者样品的分析显示,SKCM肿瘤中IL18和IFNG基因表达呈正相关(图7A)。此外,NK细胞相关基因(NCR1,NCR3,KLRB1,CD160和PRF1)的表达与IL18-IFNG基因表达呈正相关(图7B)。重要的是,与SKCM患者中的NK-IL18-IFNGlow信号相比,NK-IL18-IFNGhigh信号的SKCM患者与更好的总体存活率相关(图7C)。在乳腺癌(BRCA,n = 1,093)和宫颈癌(CESC,n = 304)患者中发现了相似的相关性(图7D-7I)。这些数据表明NK-IL18-IFNG标记在不同癌症实体中可能的预后作用。

图7 在不同的肿瘤中,NK-IL18-IFNG的特征与提高患者的总体生存率相关
总之,本文的结果提高了对HIF-1a介导的控制NK细胞效应功能在其微环境中的机制理解。本文的数据表明,IL-18供应与NK特异性HIF-1a靶向的组合方法有望改善NK细胞敏感性实体瘤的治疗策略。
参考文献:
Ni Jing., Wang Xi., Stojanovic Ana., Zhang Qin., Wincher Marian., Bühler Lea., Arnold Annette., Correia Margareta P., Winkler Manuel., Koch Philipp-Sebastian., Sexl Veronika., Höfer Thomas., Cerwenka Adelheid.(2020). Single-Cell RNA Sequencing of Tumor-Infiltrating NK Cells Reveals that Inhibition of Transcription Factor HIF-1α Unleashes NK Cell Activity. Immunity, 52(6), 1075-1087.e8. doi:10.1016/j.immuni.2020.05.001






