lncRNA INCR1调节IFNγ信号逃避肿瘤免疫
导读:
免疫检查点抑制剂治疗是基于肿瘤上调免疫检查点分子(如PD-L1)来逃避抗肿瘤免疫的能力,然而部分应答者对这些疗法出现获得性耐药。免疫检查点抑制剂的耐药部分是由于肿瘤中IFN刺激基因的持续表达,导致持续的IFNγ信号传导。lncRNA转录过程本身可以促进染色质重塑,增强编码基因启动子的活性。研究显示lncRNA的异常表达与肿瘤的发生发展有关,但它们在免疫逃避中的作用仍不清楚。Mineo等人在下面这篇文章中研究了lncRNA INCR1在肿瘤免疫逃避中的作用。

技术路线图:
结果:
1.lncRNA INCR1在IFNγ刺激的肿瘤细胞中表达
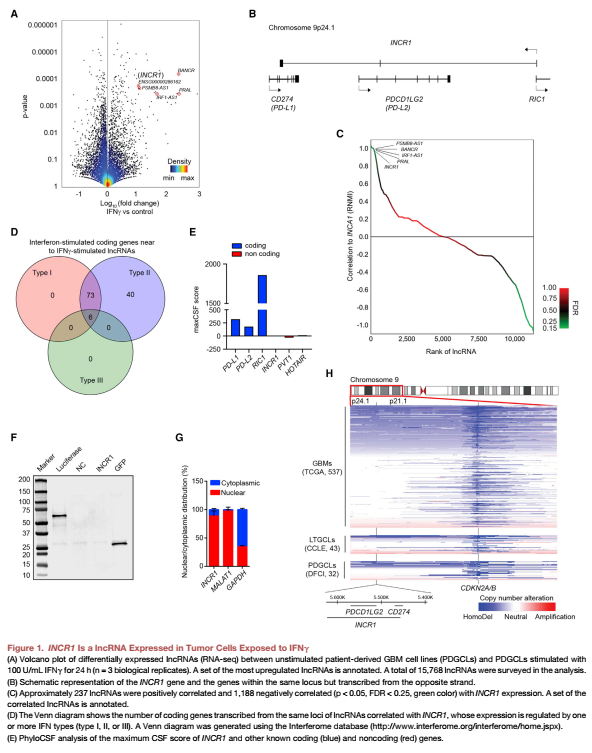
首先对IFNγ刺激的患者源性GBM细胞株(PDGCLs)进行了全转录组分析(RNA测序,Figure 1A),IFNγ刺激了113个lncRNA的转录,包括已经被验证的IFNγ刺激之后上调的lncRNA BANCR。在上调最显著的lncRNA中,有一个表达于PD-L1/PD-L2位点DNA链的lncRNA特征不明显,命名为lncRNA INCR1(Figure 1B)。INCR1表达与237个lncRNAs表达呈正相关( Figure 1C),其中几个转录于受IFN调控的编码蛋白质的基因座(Figure 1D)。PhyloCSF对INCR1序列进行分析,结果显示该转录本具有低编码潜力( (Figure 1E))。通过体外转录/翻译实验,文章也证实了INCR1没有被翻译成蛋白( (Figure 1F)。qPCR分析显示,INCR1主要定位在细胞核内(Figure 1G)。分析INCR1位点和附近的9p21细胞带,包括CDKN2A/B基因,在32个PDGCLs和43个长期GBM细胞系(LTGCLs)中,显示了与来自癌症基因组图谱(TCGA)队列的GBM肿瘤相似的拷贝数改变模式,这表明实验中的细胞系模型反映了人类疾病。
2.在不同的癌细胞和病人的肿瘤中,INCR1表达与PD-L1水平相关
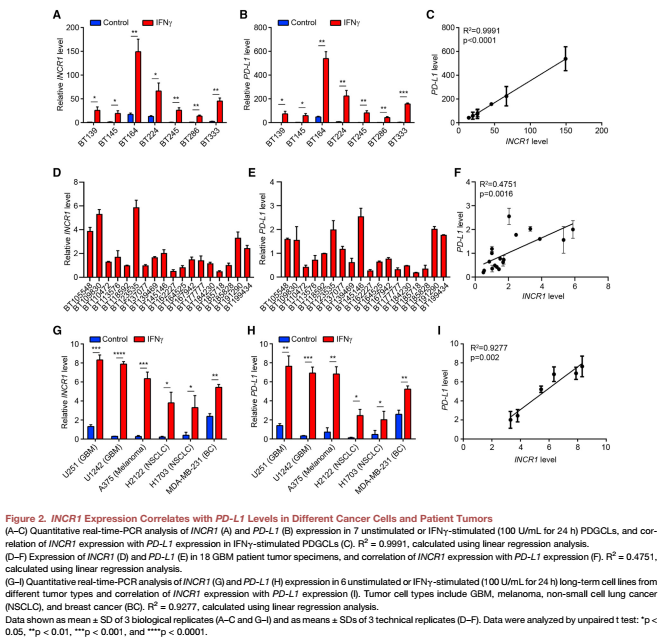
对PDGCLs 进行qPCR分析发现在所有的细胞系中,IFNγ刺激INCR1上调 (Figure 2A)。IFNγ处理的PDGCLs也表达高水平的PD-L1 mRNA和蛋白(Figure 2B)。值得注意的是,我们观察到INCR1和PD-L1 mRNA和蛋白之间高度显著的相关性(Figure 2C)。与这些发现相一致的是,INCR1在患者GBMs中表达与PD-L1 mRNA水平呈正相关,INCR1高的肿瘤也表达较高的PD-L1水平(Figure 2D and 2F)。实验选择6个代表GBM、黑色素瘤、NSCLC和BC的细胞系。IFNγ刺激后,所有细胞系均显示INCR1表达增加(Figure 2G),这也与PD-L1表达相关(Figures 2H and 2I). 因此,说明文章发现了肿瘤和组织培养细胞中一种新的lncRNA,IFN刺激其表达,其表达与PD-L1呈正相关。
3.INCR1调节肿瘤IFNγ信号通路
作者推测INCR1会调节其邻近基因的表达和IFNγ刺激引起的肿瘤应答。沉默INCR1降低了938个基因的表达,其中451个基因在未受刺激和IFNγ刺激的细胞中普遍下调(Figure 3A )。基因本体论(GO)富集分析显示下调的基因参与免疫相关功能,如IFNγ应答、先天免疫应答和对病毒的防御应答(Figure 3B)。此外,INCR1基因敲低导致124个ISGs基因表达减少(Figure 3C)。这些基因中包括IFNγ信号通路的重要组成部分(JAK2,STAT1),以及主要的免疫抑制分子(PD-L1和IDO1)。研究证实,无论是在基础水平上还是在IFNγ作用下,沉默INCR1都会导致其重叠基因PD-L1和PDL2的mRNA水平降低(Figure 3D 3F)。值得注意的是,与INCR1和PD-L1在同一位点的JAK2的mRNA显著下调(Figure 3G),来自不同基因组区域的ISGs如STAT1和IDO1的mRNA也显著下调(Figure 3H和3I)。此外,文章中证明了沉默INCR1导致PD-L1、JAK2、STAT1和IDO1蛋白水平下调(Figure 3J)。总STAT1的下调与IFNγ刺激下其磷酸化和核定位降低相关(Figure 3J)。此外,我们发现沉默INCR1降低了PD-L1总蛋白和细胞表面PD-L1水平。
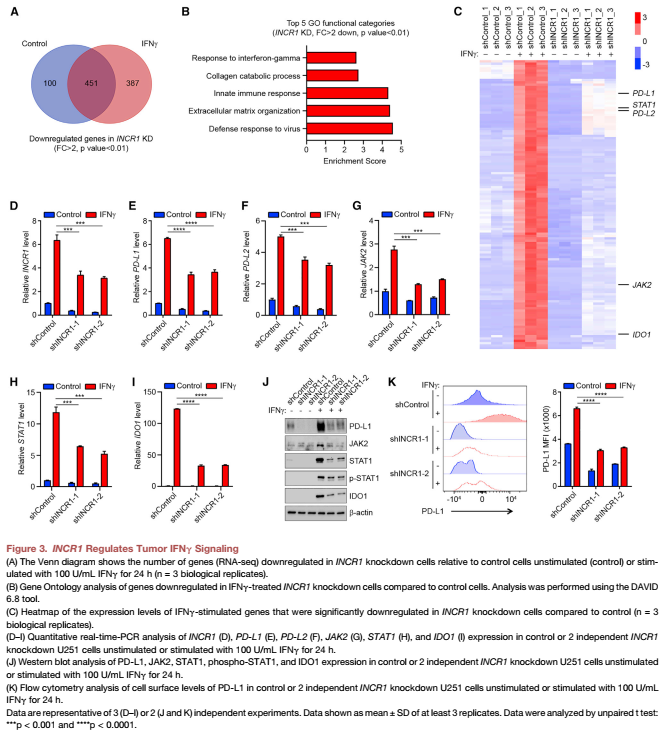
4.体外沉默INCR1导致T细胞介导的细胞毒性增加;体内提高CAR-T细胞疗效
研究表明CD8+ CTLs的激活诱导IFNγ等细胞因子的分泌,促进其增殖和抗肿瘤活性。将肿瘤细胞与CD8 + CTL共培养,用antiCD3和anti-CD28抗体共价偶联的珠子激活,会使INCR1沉默细胞的细胞毒性比对照组增加,但活化T细胞的生存能力没有显著变化(Figure 4A)。使用3D培养系统,我们发现当INCR1敲除肿瘤球与激活的CD8+ ctl共孵养时显著减小,与对照肿瘤球相比(Figure 4B)。这与INCR1沉默细胞共培养的CD8+ CTLs中IFNγ分泌增加有关,与CD8+ CTLs共培养的空白细胞相比。
将U251-EGFRvIII对照和INCR1沉默肿瘤植入皮下。植入后7天,单独表达GFP的人T细胞(对照组)或EGFRvIII-directed CAR被单次静脉注射为标准剂量的1/10。在这些条件下,对照组肿瘤小鼠对CAR-T细胞治疗没有明显反应。相比之下,CAR-T细胞显著降低了INCR1敲低肿瘤小鼠的肿瘤生长。在研究结束时,也就是注射T细胞后的21天,我们对肿瘤进行了CAR - T细胞存在的分析。INCR1敲除肿瘤同时出现CD4+和CD8+ T细胞浸润,以CD8+ T细胞为主。相比之下,对照组肿瘤未见CD4+ T细胞浸润(Figure 4E,4F)。此外,与INCR1沉默的浸润性肿瘤相比,对照组的CD8+ T细胞表达的PD-1水平明显更高(Figure 4G)。这些结果表明INCR1在控制肿瘤IFNγ信号中发挥着功能作用,其敲除导致人类肿瘤细胞对T细胞介导的杀伤的敏感性增加。
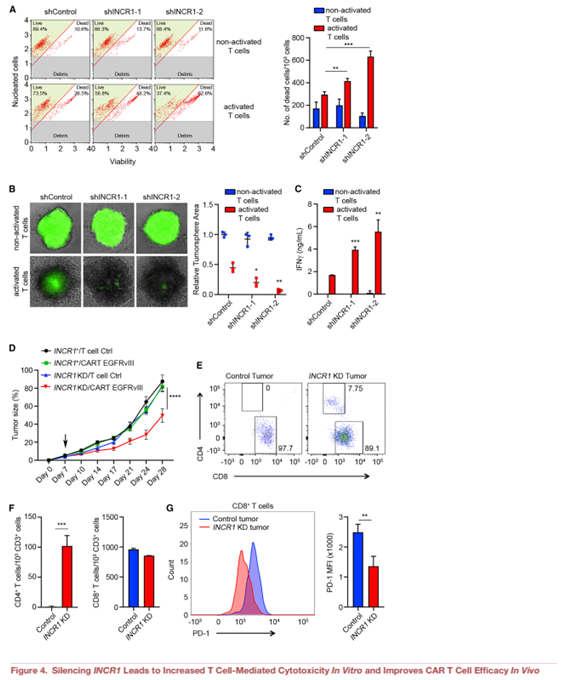
5.HNRNPH1是INCR1的结合搭档
大多数lncrna通过与蛋白质相互作用而发挥作用。为了明确INCR1调控PD-L1表达的机制,我们采用RNA反义纯化(RAP)对IFNγ刺激的PDGCLs中与内源性INCR1直接接触的蛋白进行纯化。我们设计了覆盖整个INCR1序列的探针,通过UV照射交联RNA -蛋白复合物,并在变性条件下进行RAP,以最大限度地恢复特定RNA-蛋白相互作用。与对照纯化相比,我们观察到大于80倍的INCR1 RNA富集((Figure 5A)。质谱分析显示,在INCR1 RAP中,HNRNPH1蛋白结合最高,而在对照RAP中则不是(Figure 5B)。然后,我们通过体内RNA UV交联和免疫沉淀(CLIP)验证了INCR1和HNRNPH1之间的相互作用。此外,与未处理的细胞和同型对照相比,IFNγ刺激的细胞中HNRNPH1与INCR1显著结合(Figure 5C)。为了识别HNRNPH1结合的INCR1区域,我们首先通过增强剪辑测序(eclipseq)绘制了体内HNRNPH1结合位点。我们在INCR1的近端内含子上发现了一簇峰 (Figure 5D)。
为了在体外验证测序数据,我们克隆了一个包含第一个内含子50和30区域的INCR1小基因,并利用它生成了7个不同的体外转录的生物素化RNA。RNA pull-down分析显示,HNRNPH1与包含在eclipseq中发现的主要峰序列的2个RNA片段(F4和F6)相互作用强烈(Figure 5E)。HNRNPH1结合的两个片段在G-stretches中富集,该基序在80%的HNRNPH1 RNA靶标中被发现(Figure5F)。GO富集分析所有被eCLIP-seq确定的基因,显示HNRNPH1,除了结合到INCR1,也结合到参与免疫系统过程的多个基因,包括几个IFNγ刺激的基因如PD-L1 JAK2和STAT1,它们的表达受INCR1调节(Figure 5G)。接下来,我们通过RNA免疫沉淀(RIP)验证HNRNPH1结合PD-L1和JAK2 mRNA(Figure 5H 5I)。这些结果表明INCR1与HNRNPH1的结合不依赖于PD-L1和JAK2 mRNA的结合。
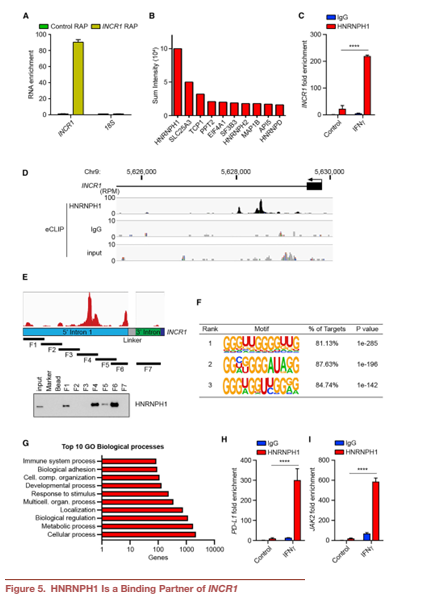
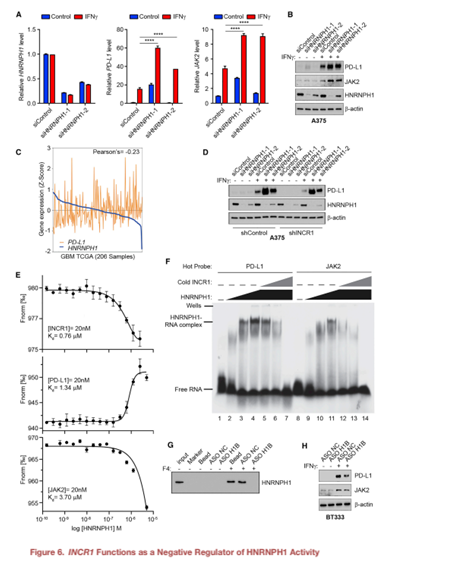
6. INCR1是HNRNPH1活性的负调控因子
沉默HNRNPH1可以提高IFNγ处理的A375细胞((Figure 6A)和患者源性BT139细胞的PD-L1和JAK2 mRNA水平。这与IFNγ刺激下PD-L1和JAK2蛋白显著增加有关(Figure 6B)。这些数据提示HNRNPH1是PD-L1和JAK2表达的负调控因子,需要结合INCR1才能阻止HNRNPH1的功能。在GBM肿瘤(TCGA)中,观察到HNRNPH1水平与PD-L1表达呈负相关,支持了这一假设(Figure 6C)。为了进一步证明我们的假设,我们进行了敲低实验来沉默INCR1敲低细胞中HNRNPH1的表达。正如预期的那样,INCR1敲低导致IFNγ处理的细胞中PD-L1表达减少。然而,沉默敲除细胞中的HNRNPH1挽救了PD-L1的表达(Figure 6D)。与PD-L1和JAK2 RNA片段相比,INCR1 RNA片段对HNRNPH1表现出更高的结合亲和力(Figure 6E)。这些数据表明,HNRNPH1与INCR1结合可能会降低其与PD-L1和JAK2相互作用的能力。利用g-32P放射性标记的PD-L1和JAK2 RNA片段,我们观察到RNA:HNRNPH1复合物的位移,证实了这两个序列结合HNRNPH1的能力(Figure 6F)。INCR1:PD-L1和INCR1:JAK2比值为1:1中非标记INCR1 RNA片段的添加有效降低PD-L1:HNRNPH1和JAK2:HNRNPH1复合物的形成(Figure 6F),表明HNRNPH1与JAK2之间的亲和力弱于HNRNPH1与PD-L1之间的亲和力。将摩尔比增加到1:5和1:10,复合物完全解离(Figure 6F)。这些结果表明INCR1对HNRNPH1的亲和力强于对PD-L1或JAK2,并且INCR1抑制了HNRNPH1与PDL1和JAK2的相互作用。
通过ASO H1B(靶向INCR1 RNA中HNRNPH1结合位点),我们可以在体外以剂量依赖的方式减少INCR1与HNRNPH1的相互作用(Figure 6G)。然而,使用对照ASO检测未观察到对结合能力的影响(Figure 6G)。为了研究ASO H1B在体内的作用,在ASO转染BT333患者源性细胞和A375黑色素瘤细胞中,ASO H1B均显著降低IFNγ刺激的PD-L1和JAK2蛋白的表达(Figure 6H)。这些结果表明INCR1特异性地与HNRNPH1相互作用,阻断这种相互作用会影响PD-L1和JAK2的表达。