SGCE通过EGFR作用于乳腺癌干细胞
乳腺癌(BC)是全世界最常见的癌症,是女性中最主要的癌症。三阴性乳腺癌(TNBC)是恶性程度高、易转移、高复发和预后差的一类乳腺癌,占所有乳腺癌病例的15%。由于缺少雌激素受体(ER)、孕激素受体(PR)和人表皮生长因子受体2(HER2)的表达,TNBC主要治疗方式为手术,放化疗,佐以PDL1抑制剂和PARP抑制剂等治疗方式。化疗药物能够杀死正在分裂的肿瘤细胞,却不能有效作用于乳腺癌干细胞(BCSCs),而BCSCs富集使TNBC对药物具有耐药性。目前,肿瘤干细胞介导的耐药性是TNBC治疗的研究难点之一。最近,中国科学院昆明动物研究所的陈策实教授及其团队研究发现SGCE通过稳定EGFR的表达维持乳腺癌干细胞特性,相关研究结果以“SGCE Promotes Breast Cancer Stem Cells by Stabilizing EGFR”为题发表在Advanced science杂志上,杂志影响因子为15.84。
研究思路:
结果:
1.SGCE基因在乳腺癌中的表达特征
作者通过github网站上的TNBC单细胞测序结果以及TCGA数据库分析发现SGCE与BCSC增殖相关(A-C),且研究发现SGCE mRNA和蛋白在CD24lowCD44high细胞中高表达(D-E)。作者进一步研究了SGCE在BCSCs中的功能,通过流式细胞分析发现TNBC细胞中,SGCE沉默导致CD24lowCD44high细胞和ALDH+细胞比例降低(F-H),同时显著减少了肿瘤微球数量和克隆形成能力(I-L)。体外实验表明SGCE沉默严重降低了肿瘤生成能力(M)。综上所述, SGCE在体内和体外与肿瘤发生密切相关。

2.SGCE与药物抗性的相关性
SGCE可以影响乳腺癌干细胞特性,而肿瘤干细胞与耐药相关,接下来研究了SGCE在化疗敏感性中的作用。从化疗患者的生存图可以看出,SGCE表达水平较低的患者预后较好(A)。细胞活力检测表明SGCE沉默的TNBC细胞对化疗药物产生较低的细胞活性剂量(B)。接下来通过肿瘤微球培养和克隆形成试验研究了在使用阿霉素、顺铂和紫杉醇治疗后的干细胞样活性。药物治疗显著增加了肿瘤微球和克隆形成数量,暗示化疗显著富集了乳腺癌干细胞,在SGCE沉默后富集显著减少,且SGCE沉默减弱药物治疗抗性(C-J)。体外实验发现SGCE沉默不能诱导肿瘤体积的显著性下降,而在阿霉素治疗后能显著抑制肿瘤生长,肿瘤中CD24lowCD44high细胞比例显著下降(K-L),表明SGCE低表达促进化疗疗效提高。

3.SGCE与CAF、ECM相关性
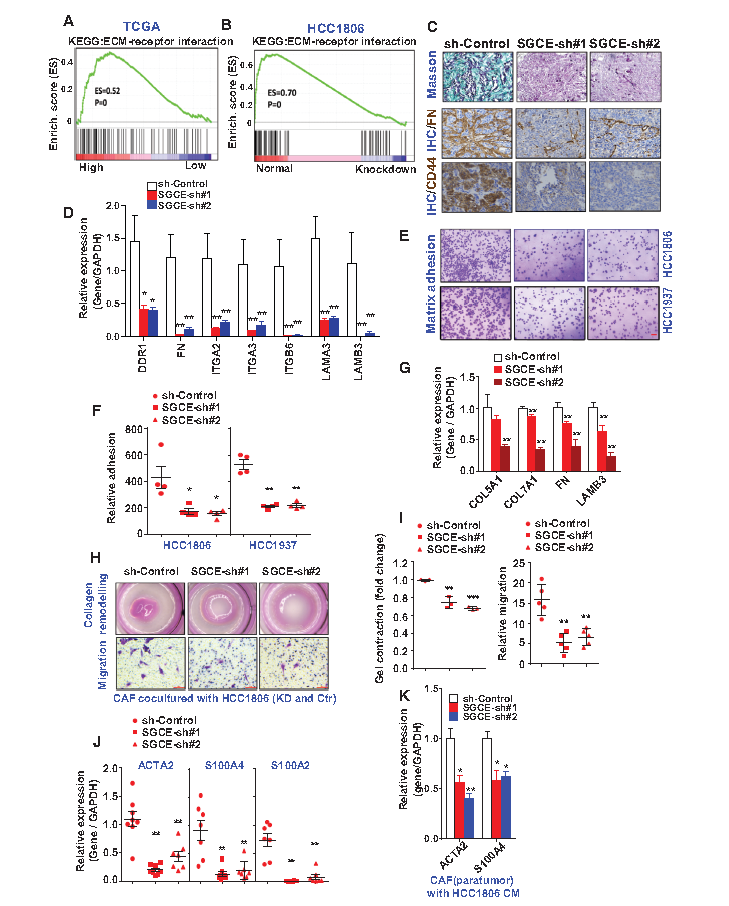
TCGA数据显示ECM受体相互作用途径与SGCE表达显著相关,而SGCE沉默乳腺癌细胞系的测序结果显示ECM受体相互作用途径富集被减弱(A-B)。通过马尾松三色染色检测胶原蛋白,发现SGCE沉默异种移植瘤组织中胶原蛋白表达水平显著减少,而其他ECM成分,包括纤连蛋白、 CD44也显著减少(C)。RT-PCR显示了ECM受体基因表达量显著降低(D)。进一步研究发现SGCE沉默后细胞中基质与胶原的黏附明显减少,暗示ECM与其受体之间的相互作用消失(E-F)。作者从患者乳腺肿瘤中提取的成纤维细胞(CAF)与SGCE沉默的TNBC细胞共培养时,CAF表现出较低的ECM表达和较低的硬度,且CAF表现出较弱的迁移能力(G-I)。为了观察癌细胞在体内招募CAFs的能力,检测了SGCE沉默的肿瘤中的CAF标记物,发现CAF细胞标志分子(ACTA2、S100A4、S100A2)在癌组织中表达量显著性下降(J-K)。
4.SGCE通过EGFR调控BCSCs和ECM
为了探讨SGCE如何维持BCSCs干细胞特性,作者分析了 SGCE与其他参与干细胞特性维持的蛋白之间的表达相关性,发现EGFR表达水平与SGCE水平呈正相关(A)。接下来进一步检测了SGCE是否影响了EGFR的表达水平,发现TNBC中EGFR蛋白表达水平因SGCE缺失下调(B),RNA测序结果显示PI3K-AKT信号通路经KEGG分析显示显著下调(C),p-AKT失活,其下游分子Bim表达上调(B),暗示PI3K-AKT信号通路参与SGCE调控。接下来进一步确认SGCE的作用是否由EGFR信号介导,发现SGCE沉默后,EGFR过表达诱导乳腺癌干细胞、肿瘤微球以及克隆形成部分恢复(D-G)。作者探究了EGFR对ECM的影响,发现EGFR沉默后ECM相关基因表达量显著下调,而EGFR在SGCE沉默的细胞中过表达可以使ECM基因表达量部分恢复(H-J)。以上结果表明SGCE通过EGFR调控BCSCs和ECM。

5.SGCE沉默诱导EGFR降解
为了研究EGFR的动态变化,用EGF处理细胞发现EGFR在30min内高表达(A)。相比之下,在EGF暴露于SGCE沉默细胞后,EGFR在同一时间点迅速下降(A,B),这表明SGCE沉默会导致EGFR的降解。利用流式分析SGCE沉默时内化的EGFR水平,发现EGFR内化显著促进(C)。接下来研究了SGCE是如何影响EGFR内化信号,通过阻断内吞作用(CME)和大胞饮作用的特异性抑制剂Pitstop和EIPA处理TNBC细胞,发现部分恢复了因SGCE沉默引起的EGFR蛋白下降(D)。这些数据表明,SGCE沉默后通过CME和大胞饮作用途径促进EGFR的内化和降解。利用NH4Cl处理细胞以抑制溶酶体活性,发现NH4Cl处理的SGCE沉默的细胞中EGFR蛋白表达水平被恢复(E,F)。作者对EGFR和溶酶体标记物(LAMP1)共定位,发现EGFR在SGCE沉默细胞的溶酶体室优先富集,且循环到细胞膜的数量显著减少(G,H)。以上数据表明SGCE沉默增加了EGFR溶酶体降解,减少了EGFR循环到细胞膜。

6.SGCE沉默促进EGFR与c-Cb1的相互作用
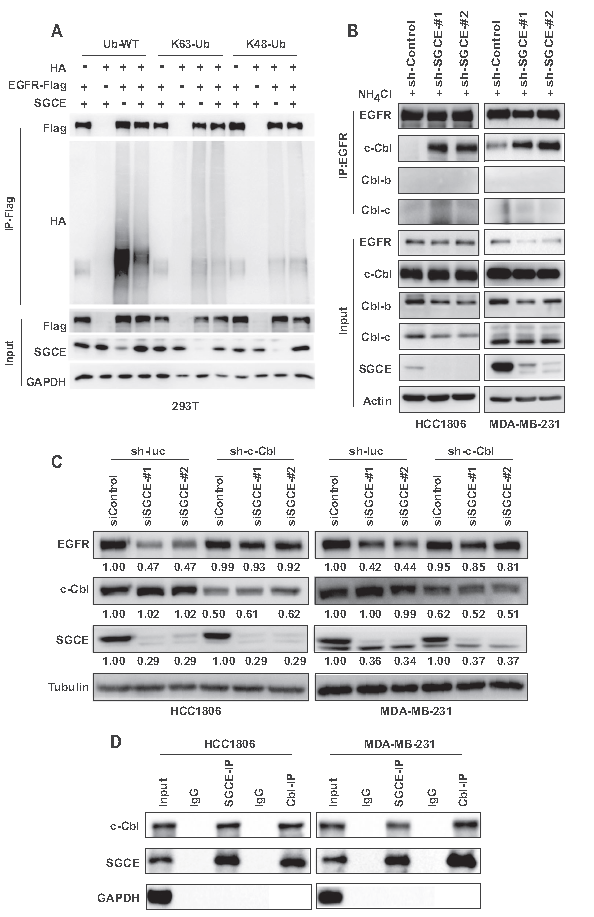
作者建立SGCE与EGFR泛素化之间的调控关系,发现SGCE过表达抑制EGFR泛素化和k63连接泛素化,导致溶酶体降解(A)。这进一步证实了SGCE沉默引起的EGFR降解是通过溶酶体降解介导的。进一步研究了SGCE如何影响EGFR泛素化,发现SGCE沉默后EGFR与c-Cbl的结合明显增强,但与Cbl-b或Cbl-c的结合没有增强,而在正常的SGCE表达水平下,EGFR与c-Cbl的结合未被检测到或很弱(B),同时沉默SGCE和c-Cb1,EGFR降解消失(C),IP实验表明SGCE可以与c-Cb1结合(D)。以上结果表明SGCE沉默促进EGFR与c-Cb1结合。
7.SGCE沉默对耐药、侵袭和转移的影响
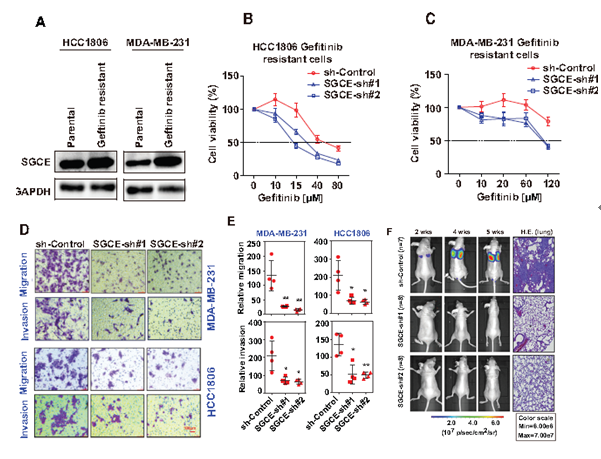
作者进一步探讨了SGCE对EGFR TKI耐药的作用,与亲代细胞系相比,吉非替尼耐药细胞系中SGCE的表达显著上调,而SGCE沉默的癌细胞对吉非替尼治疗敏感性增加,癌细胞耐药最大IC50被大大降低(A-C)。此外,SGCE沉默显著降低了TNBC细胞的迁移和侵袭能力(D-E),而将SGCE沉默的TNBC细胞与荧光素酶基因一起注入小鼠尾静脉,与对照组相比,发现接受尾静脉注射SGCE沉默细胞小鼠发生的肺转移较少(F)。
8.机制
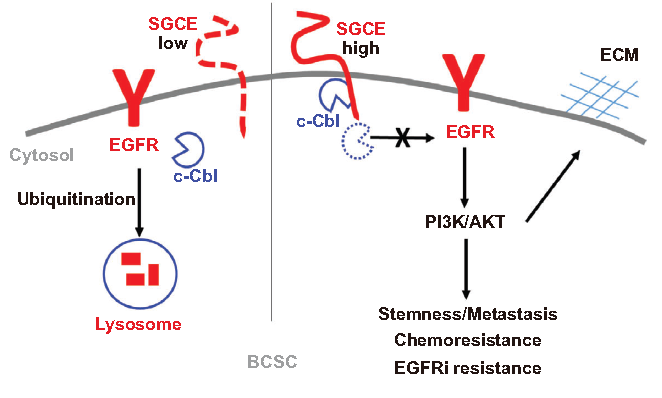
结论:
1. SGCE与肿瘤初发密切相关,通过EGFR调控BCSCs和ECM。
2. SGCE基因沉默增加了EGFR溶酶体降解,减少了EGFR循环到细胞膜,并促进EGFR与c-Cb1结合。
3. SGCE沉默降低三阴性乳腺癌对EGFR抑制剂耐药性,抑制其癌细胞的侵袭和转移。
参考文献:
Lina Zhao, Ting Qiu, Dewei Jiang, et al. SGCE Promotes Breast Cancer Stem Cells by Stabilizing EGFR. Advanced Science. 2020.






