Trib1/Hoxa9/Erg轴在急性髓系白血病进展中的作用
急性髓系白血病(AML)是成年人最常见的急性白血病,目前治疗仍以化疗为主,但有70%左右获得缓解的患者最终复发并演变为难治性白血病,导致治疗失败而死亡。转录调控异常是AML常见的分子特征。在AML中,造血转录因子常被认定为癌基因或抑癌基因。Hox蛋白是关键的转录因子,Hoxa9调控的转录程序参与AML的MLL融合、MOZ-TIF2、NUP98-NSD1、NPM1c或ASXL1融合/突变。这些突变上调了HOXA9的mRNA表达,并揭示了HOXA9过表达对小鼠造血细胞永生化的意义。然而,仅过表达Hoxa9并不足以发展成全面的AML,需要激活额外的辅助因子和/或合作通路。研究表明,多种信号通路与Hoxa9调控的转录程序相互作用,额外的分子机制可能影响Hoxa9驱动的增强子修饰。最近,日本癌症研究基金会的Takuro Nakamura教授及其团队发现Trib1在髓系白血病发生中调控染色质和Hoxa9驱动转录的新机制,相关研究以“Trib1 promotes acute myeloid leukemia progression by modulating the transcriptional programs of Hoxa9”为题发表在Blood杂志上,杂志影响因子为17.543。
研究思路:

结果:
1.Trib1过表达对Hoxa9诱导髓系白血病生成的影响
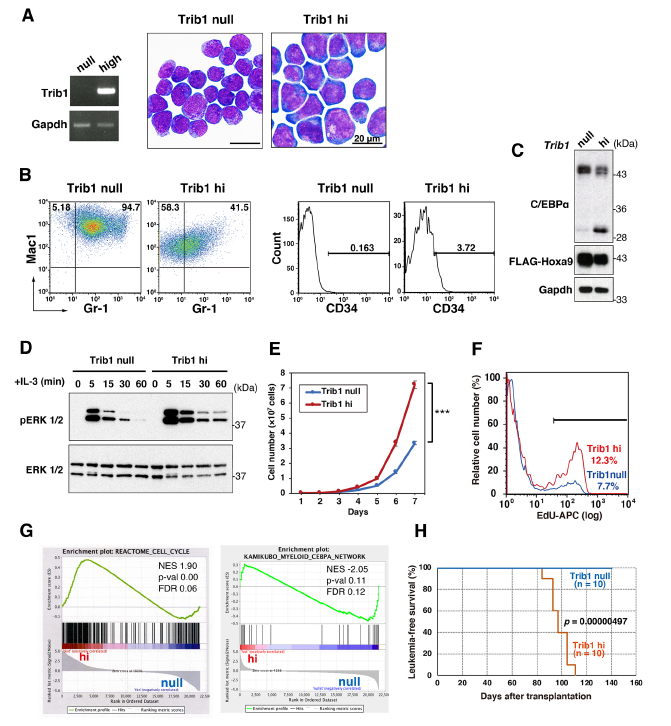
作者使用逆转录病毒载体pMYs-IRES-GFP将Hoxa9和/或Trib1导入Trib1敲除小鼠的骨髓细胞,建立了不朽的骨髓细胞系,表达(Trib1 hi)或不表达(Trib1 null)Trib1的Hoxa9细胞表现出未成熟的髓系形态(A)。两种细胞类型Mac1和Gr1均呈阳性,而Trib1 hi细胞中Mac1和Gr1表达水平下降,CD34表达升高,提示Trib1 hi细胞较Trib1 null细胞具有更多未成熟特征(B)。Trib1 hi细胞中,C/EBPα p42而不是p30被发现显著降低,ERK磷酸化增强,IL-3刺激后延长(C,D),且与Trib1 null相比,Trib1 hi细胞也显示出更高的增殖率和EdU掺入率,暗示Trib1诱导细胞周期的增加(E,F)。基因微阵列分析Trib1 hi/null细胞发现Trib1 hi特异性富集细胞周期以及C/EBP通路(G)。骨髓移植实验发现只有Trib1 hi细胞才能在体内诱导白血病发生(H)。这些结果表明Trib1过表达促进了Hoxa9诱导的白血病发生。
2.AML中Hoxa9和C/EBPα的DNA结合特性
Trib1 null和hi细胞中,Hoxa9的DNA结合峰的总体分布没有显著差异,其中39%和27%的DNA结合峰分别位于距离转录起始位点(TSS) 2 kb以内(A)。MEME分析发现Hoxa9 (FLAG)和C/EBP结合峰显示了Hoxa9,C/EBPα和Meis1显著的浓度,暗示Hoxa9和C/EBP在染色质水平上是接近的(B)。在Trib1缺失细胞中,Hoxa9和C/EBP的DNA结合出现了频繁的关联,且Hoxa9和C/EBP的结合峰有60.5%的重叠(C)。通过比较组蛋白H3K27ac和Hoxa9结合的分布。作者发现,在Trib1 null和hi细胞中,Hoxa9和H3K27ac峰经常同时出现(D),而在Trib1 null和hi细胞中,H3K27ac的整体沉积并没有太大差异。在Trib1 hi和null细胞的启动子区、基因内区和基因间区检测到Hoxa9、C/EBP和H3K27ac的共沉积,此外,通过ChIP-seq检测了C/EBP在Trib1 hi细胞中的DNA结合,发现由于p42的降解而富集了p30亚型,且41.1%的C/EBP结合位点在hi和null细胞之间重叠,暗示p30可能在hi细胞中发挥不同的作用(E)。

3.Trib1能够调节Hoxa9诱导AML中的超级增强子
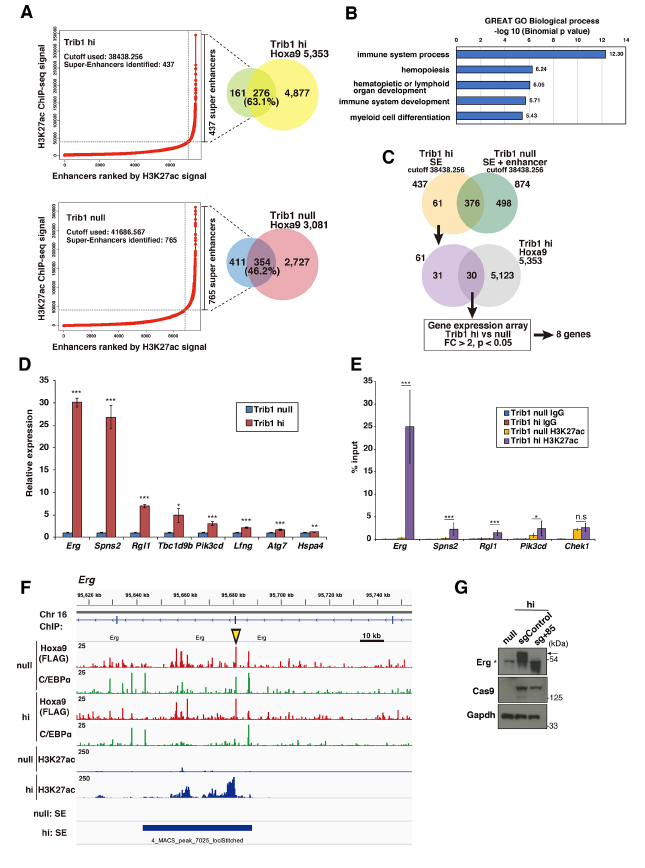
作者比较了Trib1 null和hi细胞间的超级增强子谱,发现437个和765个超级增强子分别与Trib1 null和hi细胞中63.1%和46.2%的Hoxa9结合位点相关(A)。通过对Trib1 hi或null特异性超级增强子的生物学过程通路的系统分析,我们确定了Trib1 hi细胞中的免疫系统、造血和骨髓细胞分化通路,提示Trib1 hi特异性超级增强子在造血系统中发挥重要作用(B)。作者识别由Trib1和Hoxa9调控修饰超级增强子活性的重要靶点,选择了61个Trib1 hi特异性超级增强子,其中8个基因在Trib1 hi细胞中表达上调,并通过Trib1过表达鉴定为显著修饰基因(C)。定量RT-PCR验证这8个基因的mRNA表达水平显著升高(D)。ChIP-qPCR显示,Trib1 hi细胞中Erg、Spns2、Rgl1和Pik3cd基因座的H3K27Ac沉积显著增加(E),且在这些基因中,包括+85干细胞增强子在内的Erg位点,可以观察到Trib1 hi和null细胞之间H3K27Ac的显著差异(F)。采用CRISPR/ cas9介导靶向Erg +85增强子,50 bp的纯合缺失(包括增强子中一个假定的Hoxa9结合位点)消除了Erg的上调(G),表明Hoxa9在+85增强子上结合上调了Erg。
4.Trib1降解C/EBP对增强子和Hoxa9靶基因的作用
在MEK1抑制剂U0126处理的Trib1 hi细胞中,发现超级增强子在Erg、Spns2和Pik3cd位点的H3K27Ac积累受到抑制(A),然而,mRNA表达的下调是边际性的(B)。Trib1 null细胞的Cebpa沉默后, Erg、Spns2、Rgl1和Pik3cd超级增强子的H3K27Ac信号显著增加(C),且这四个基因的表达显著上调(D)。通过将编码全长(p42和p30)或N端截断(仅p30)蛋白的人CEBPA cDNAs引入CEBPA沉默的Trib1 null细胞中,发现p42部分恢复了Erg mRNA和蛋白的表达以及组蛋白H3K27Ac的积累,而p30的表达没有恢复(E)。综上所述,Trib1对C/EBP p42的降解是某些Hoxa9结合位点上增强子修饰的主要驱动力,而MEK/ERK的增强对这一事件略有贡献。

5.Erg是Trib1作用于Hoxa9的重要靶点
ChIP-seq分析显示Trib1过表达上调了Erg水平,且Erg靶基因调控所需的Erg蛋白p55亚型的表达在Trib1 hi细胞中上调(A)。研究发现,与Trib1 hi细胞相比,表达Erg的Trib1 null细胞的增殖能力增强。相反,shRNA介导Erg沉默的Trib1 hi细胞显示生长抑制(C),而CRISPR/ cas9介导Erg沉默进一步显示Trib1 hi细胞的生长抑制等同于Trib1 null细胞(D)。此外,Erg缺失完全消除了体内Trib1 hi细胞的白血病发展(E),尽管在Trib1 null细胞中Erg过表达不会发展为白血病,这表明在与Hoxa9表达相关的Trib1增强AML中,Erg上调是必需的,但不足以促进体内白血病的发生。

6.BRD4抑制剂抑制Hoxa9诱导的白血病生长
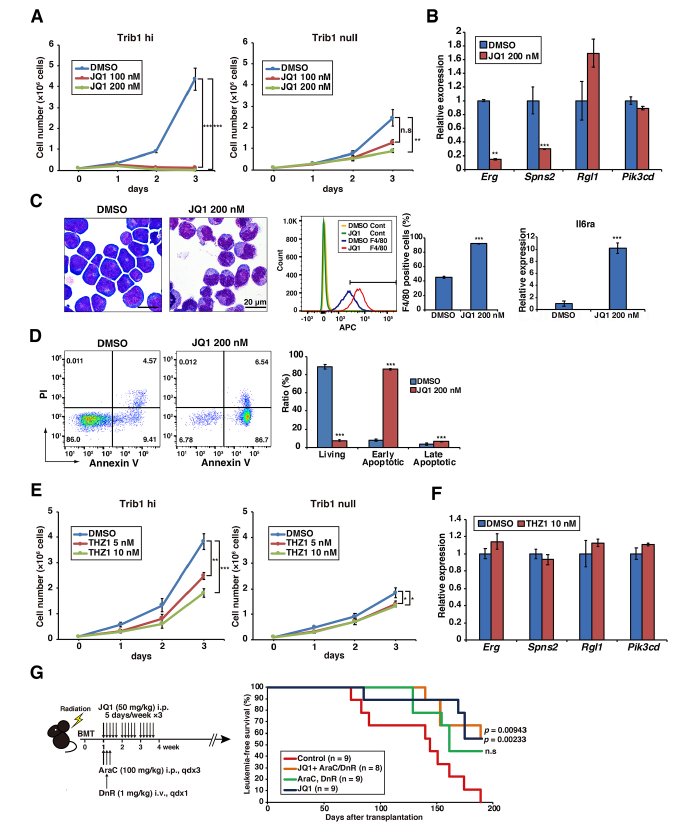
使用BRD4抑制剂JQ1处理Trib1 hi细胞, JQ1有效地以Trib1依赖的方式抑制白血病细胞的生长(A), 并抑制Trib1/Hoxa9靶向Erg和Spns2的表达,而不是Trib1 hi细胞中Rgl1和Pik3cd的表达(B),且JQ1能诱导Trib1 hi细胞的单核细胞分化和早期凋亡(C,D)。作者又检测了CDK7/8抑制剂THZ1作为超级增强子靶向药物的作用,与JQ1相比,THZ1只表现出温和的抗增殖作用,而没有观察到Erg和Spns2的下调(E,F)。骨髓移植Trib1 hi细胞后,一周后给小鼠注射JQ1,无论是否使用柔红霉素和阿糖胞苷治疗,JQ1治疗都能显著提高白血病小鼠的存活率(G)。总的来说,这些结果突出了靶向Trib1修饰的Erg超级增强子的重要性。
7.TRIB1-ERG轴在AML细胞中的参与
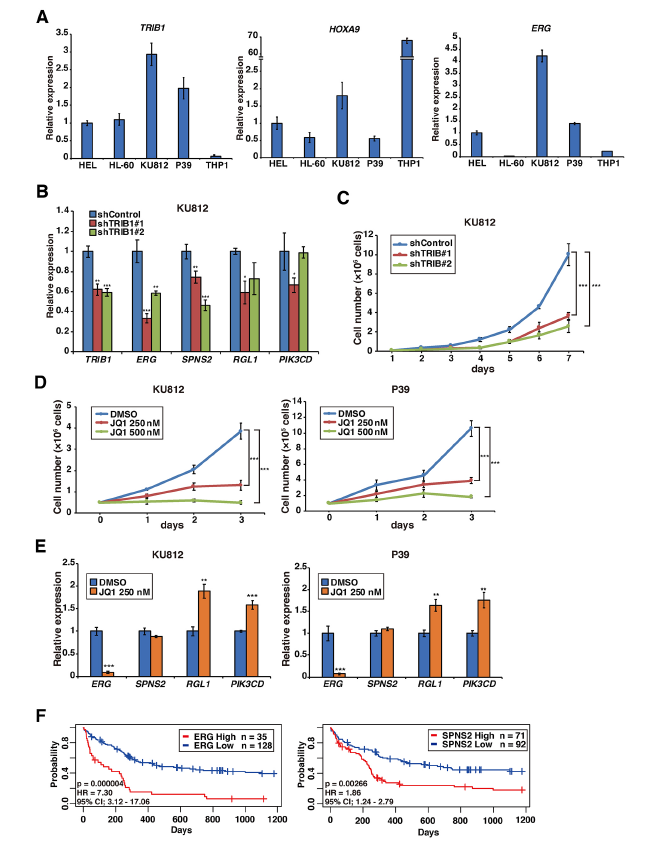
通过分析TRIB1和HOXA9在人AML细胞系中的表达,发现在KU812和P39细胞株中,TRIB1和HOXA9表达水平较高,HL-60细胞ERG低表达提示HOXA9对ERG表达的调控机制可能不同(A)。shRNA介导的TRIB1缺失发现KU812细胞中ERG和SPNS2的下调(B),KU812细胞的生长受到抑制(C)。利用250 nM的JQ1处理KU812和P39细胞,发现其对KU812和P39细胞均有生长抑制作用,并抑制了两株细胞的ERG表达(D,E)。这些结果表明,Trib1介导的ERG上调在人类AML白血病细胞生长中发挥重要作用。通过预后扫描在线平台重新评估了ERG和SPNS2上调在人类AML中的可能作用,发现ERG或SPNS2的表达水平与正常核型AML的不良预后显著相关(F)。总的来说,我们的结果表明ERG是Hoxa9和C/EBP的一个重要靶点,并且可以被Trib1调控。
小结:
1.Trib1通过降解C/EBP和修饰与Hoxa9相关的超级增强子来影响Hoxa9在髓系白血病发生中的作用。
2. Erg是Trib1和Hoxa9的关键靶点,对BRD4抑制反应迅速,在白血病发生中起关键作用。
参考文献:
Seiko Yoshino, Takashi Yokoyama, Yoshitaka Sunami, et al. Trib1 promotes acute myeloid leukemia progression by modulating the transcriptional programs of Hoxa9. Blood. 2020.






