单细胞测序和TCGA数据库联合分析助力乳腺癌高分文章发表
乳腺癌(BC)是全世界最常见的癌症,是女性中最主要的癌症。三阴性乳腺癌(TNBC)是恶性程度高、易转移、高复发和预后差的一类乳腺癌,占所有乳腺癌病例的15%。由于缺少雌激素受体(ER)、孕激素受体(PR)和人表皮生长因子受体2(HER2)的表达,TNBC主要治疗方式为手术,放化疗,佐以PDL1抑制剂和PARP抑制剂等治疗方式。化疗药物能够杀死正在分裂的肿瘤细胞,却不能有效作用于乳腺癌干细胞(BCSCs),而BCSCs富集使TNBC对药物具有耐药性。目前,肿瘤干细胞介导的耐药性是TNBC治疗的研究难点之一。最近,中国科学院昆明动物研究所的陈策实教授及其团队通过单细胞测序数据库和TCGA数据库联合分析发现SGCE在乳腺癌干细胞中具有重要作用,并对SGCE在乳腺癌干细胞特性维持的调控机制进行研究,相关研究结果以“SGCE Promotes Breast Cancer Stem Cells by Stabilizing EGFR”为题发表在Advanced science杂志上,杂志影响因子为15.84。
研究思路:
结果:
1.SGCE基因在乳腺癌中的表达特征
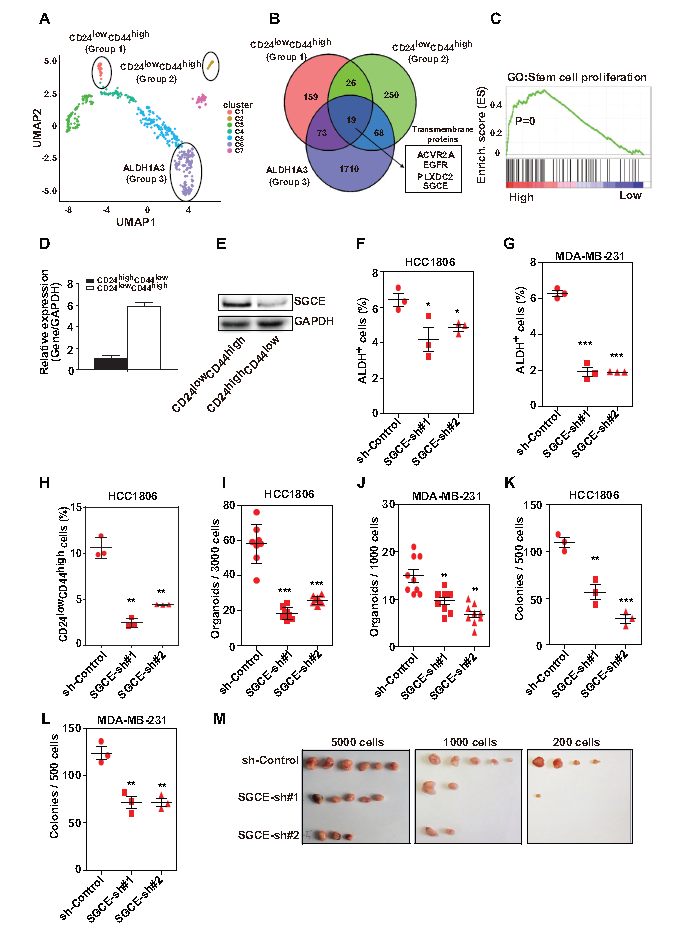
作者通过github网站上的TNBC单细胞测序结果以及TCGA数据库分析发现SGCE与BCSC增殖相关(A-C),且研究发现SGCE mRNA和蛋白在CD24lowCD44high细胞中高表达(D-E)。作者进一步研究了SGCE在BCSCs中的功能,通过流式细胞分析发现TNBC细胞中,SGCE沉默导致CD24lowCD44high细胞和ALDH+细胞比例降低(F-H),同时显著减少了肿瘤微球数量和克隆形成能力(I-L)。体外实验表明SGCE沉默严重降低了肿瘤生成能力(M)。综上所述, SGCE在体内和体外与肿瘤发生密切相关。
2.SGCE与药物抗性的相关性
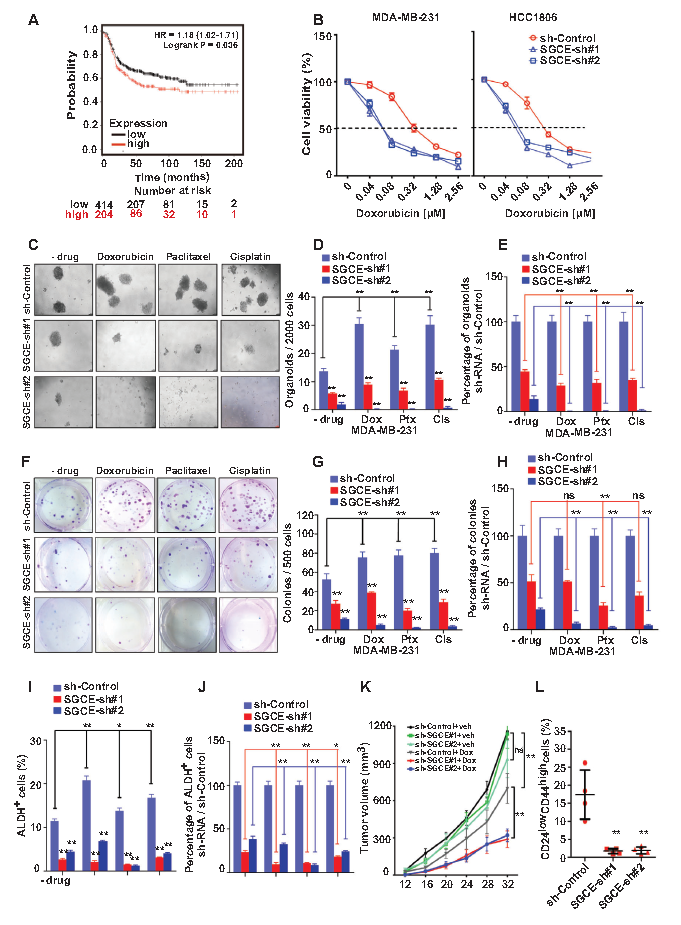
SGCE可以影响乳腺癌干细胞特性,而肿瘤干细胞与耐药相关,接下来研究了SGCE在化疗敏感性中的作用。从化疗患者的生存图可以看出,SGCE表达水平较低的患者预后较好(A)。细胞活力检测表明SGCE沉默的TNBC细胞对化疗药物产生较低的细胞活性剂量(B)。接下来通过肿瘤微球培养和克隆形成试验研究了在使用阿霉素、顺铂和紫杉醇治疗后的干细胞样活性。药物治疗显著增加了肿瘤微球和克隆形成数量,暗示化疗显著富集了乳腺癌干细胞,在SGCE沉默后富集显著减少,且SGCE沉默减弱药物治疗抗性(C-J)。体外实验发现SGCE沉默不能诱导肿瘤体积的显著性下降,而在阿霉素治疗后能显著抑制肿瘤生长,肿瘤中CD24lowCD44high细胞比例显著下降(K-L),表明SGCE低表达促进化疗疗效提高。
3.SGCE与CAF、ECM相关性
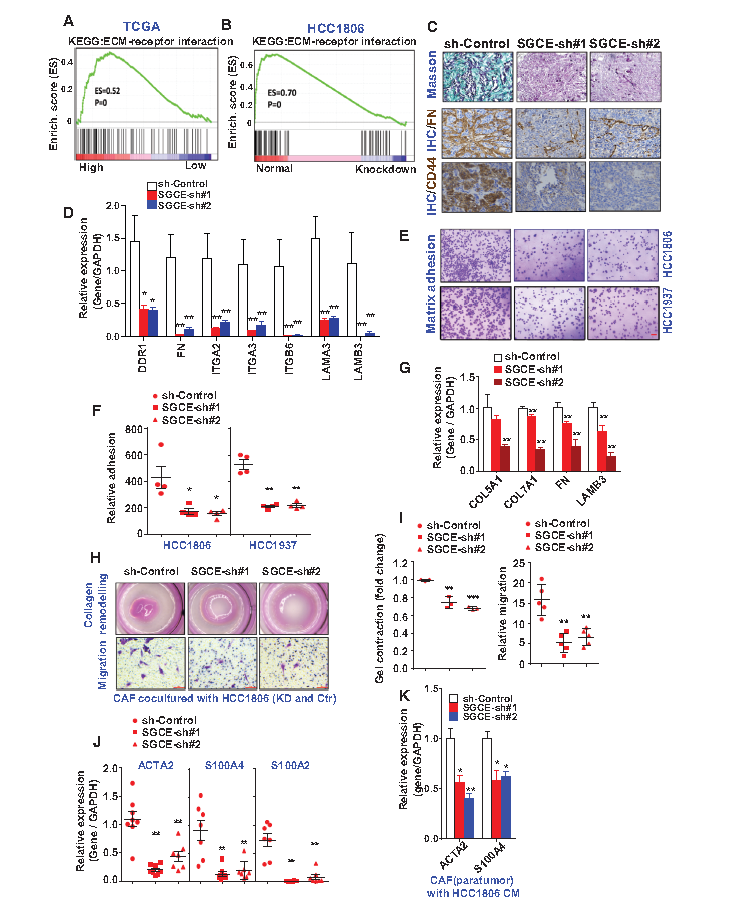
TCGA数据显示ECM受体相互作用途径与SGCE表达显著相关,而SGCE沉默乳腺癌细胞系的测序结果显示ECM受体相互作用途径富集被减弱(A-B)。通过马尾松三色染色检测胶原蛋白,发现SGCE沉默异种移植瘤组织中胶原蛋白表达水平显著减少,而其他ECM成分,包括纤连蛋白、 CD44也显著减少(C)。RT-PCR显示了ECM受体基因表达量显著降低(D)。进一步研究发现SGCE沉默后细胞中基质与胶原的黏附明显减少,暗示ECM与其受体之间的相互作用消失(E-F)。作者从患者乳腺肿瘤中提取的成纤维细胞(CAF)与SGCE沉默的TNBC细胞共培养时,CAF表现出较低的ECM表达和较低的硬度,且CAF表现出较弱的迁移能力(G-I)。为了观察癌细胞在体内招募CAFs的能力,检测了SGCE沉默的肿瘤中的CAF标记物,发现CAF细胞标志分子(ACTA2、S100A4、S100A2)在癌组织中表达量显著性下降(J-K)。
4.SGCE通过EGFR调控BCSCs和ECM
为了探讨SGCE如何维持BCSCs干细胞特性,作者分析了 SGCE与其他参与干细胞特性维持的蛋白之间的表达相关性,发现EGFR表达水平与SGCE水平呈正相关(A)。接下来进一步检测了SGCE是否影响了EGFR的表达水平,发现TNBC中EGFR蛋白表达水平因SGCE缺失下调(B),RNA测序结果显示PI3K-AKT信号通路经KEGG分析显示显著下调(C),p-AKT失活,其下游分子Bim表达上调(B),暗示PI3K-AKT信号通路参与SGCE调控。接下来进一步确认SGCE的作用是否由EGFR信号介导,发现SGCE沉默后,EGFR过表达诱导乳腺癌干细胞、肿瘤微球以及克隆形成部分恢复(D-G)。作者探究了EGFR对ECM的影响,发现EGFR沉默后ECM相关基因表达量显著下调,而EGFR在SGCE沉默的细胞中过表达可以使ECM基因表达量部分恢复(H-J)。以上结果表明SGCE通过EGFR调控BCSCs和ECM。
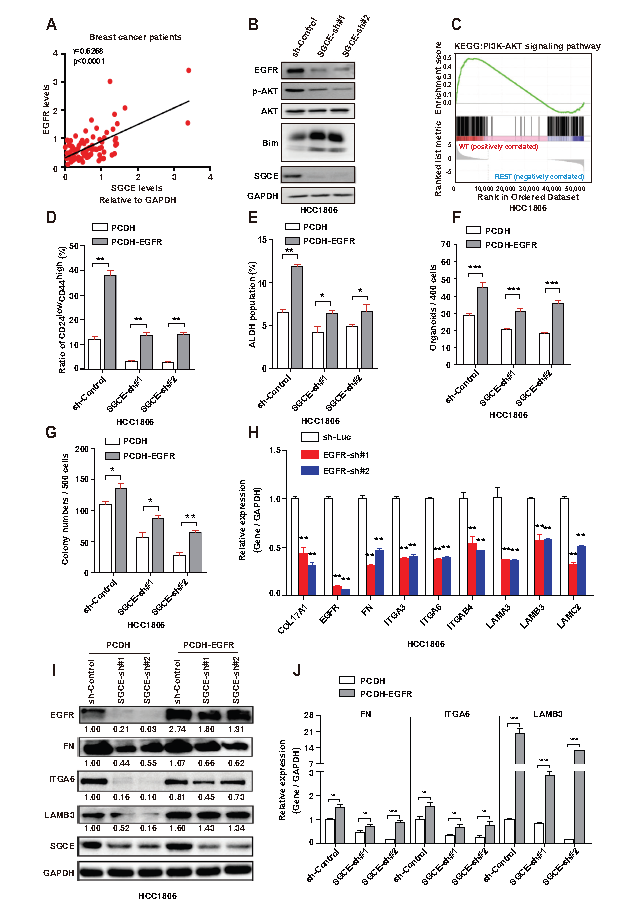
5.SGCE沉默诱导EGFR降解
为了研究EGFR的动态变化,用EGF处理细胞发现EGFR在30min内高表达(A)。相比之下,在EGF暴露于SGCE沉默细胞后,EGFR在同一时间点迅速下降(A,B),这表明SGCE沉默会导致EGFR的降解。利用流式分析SGCE沉默时内化的EGFR水平,发现EGFR内化显著促进(C)。接下来研究了SGCE是如何影响EGFR内化信号,通过阻断内吞作用(CME)和大胞饮作用的特异性抑制剂Pitstop和EIPA处理TNBC细胞,发现部分恢复了因SGCE沉默引起的EGFR蛋白下降(D)。这些数据表明,SGCE沉默后通过CME和大胞饮作用途径促进EGFR的内化和降解。利用NH4Cl处理细胞以抑制溶酶体活性,发现NH4Cl处理的SGCE沉默的细胞中EGFR蛋白表达水平被恢复(E,F)。作者对EGFR和溶酶体标记物(LAMP1)共定位,发现EGFR在SGCE沉默细胞的溶酶体室优先富集,且循环到细胞膜的数量显著减少(G,H)。以上数据表明SGCE沉默增加了EGFR溶酶体降解,减少了EGFR循环到细胞膜。
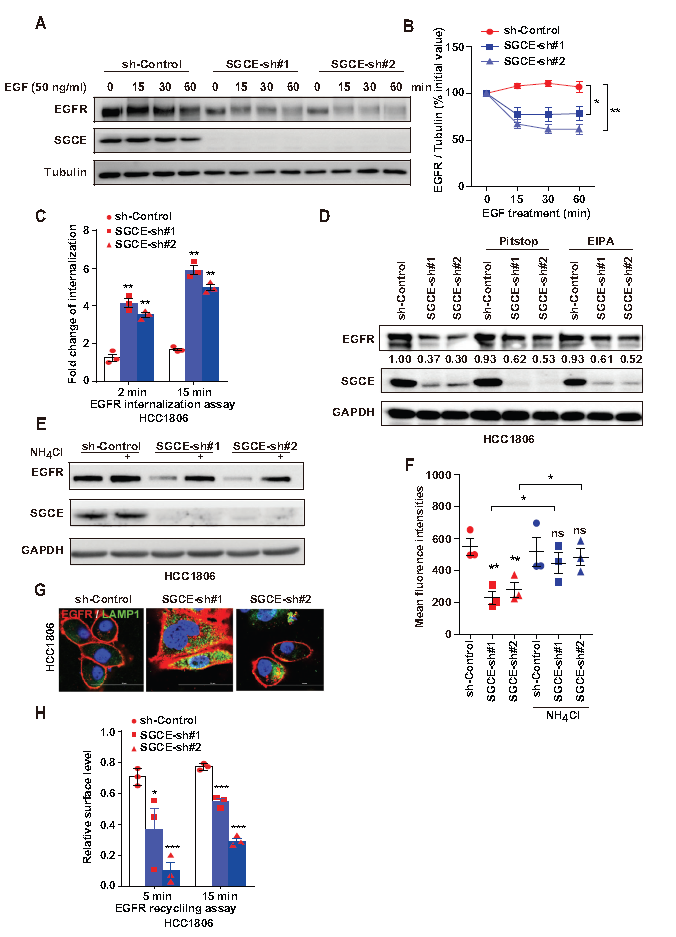
6.SGCE沉默促进EGFR与c-Cb1的相互作用
作者建立SGCE与EGFR泛素化之间的调控关系,发现SGCE过表达抑制EGFR泛素化和k63连接泛素化,导致溶酶体降解(A)。这进一步证实了SGCE沉默引起的EGFR降解是通过溶酶体降解介导的。进一步研究了SGCE如何影响EGFR泛素化,发现SGCE沉默后EGFR与c-Cbl的结合明显增强,但与Cbl-b或Cbl-c的结合没有增强,而在正常的SGCE表达水平下,EGFR与c-Cbl的结合未被检测到或很弱(B),同时沉默SGCE和c-Cb1,EGFR降解消失(C),IP实验表明SGCE可以与c-Cb1结合(D)。以上结果表明SGCE沉默促进EGFR与c-Cb1结合。
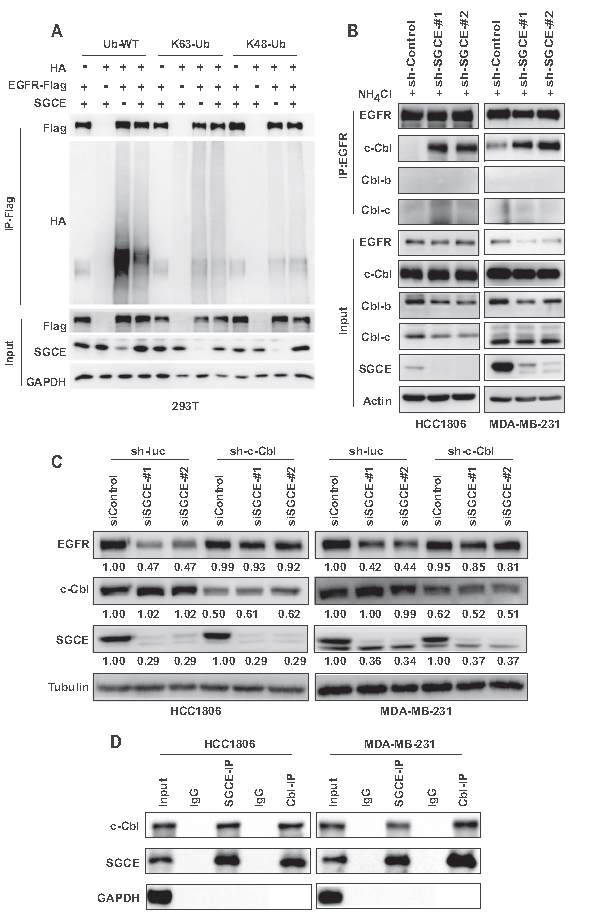
7.SGCE沉默对耐药、侵袭和转移的影响
作者进一步探讨了SGCE对EGFR TKI耐药的作用,与亲代细胞系相比,吉非替尼耐药细胞系中SGCE的表达显著上调,而SGCE沉默的癌细胞对吉非替尼治疗敏感性增加,癌细胞耐药最大IC50被大大降低(A-C)。此外,SGCE沉默显著降低了TNBC细胞的迁移和侵袭能力(D-E),而将SGCE沉默的TNBC细胞与荧光素酶基因一起注入小鼠尾静脉,与对照组相比,发现接受尾静脉注射SGCE沉默细胞小鼠发生的肺转移较少(F)。
8.机制
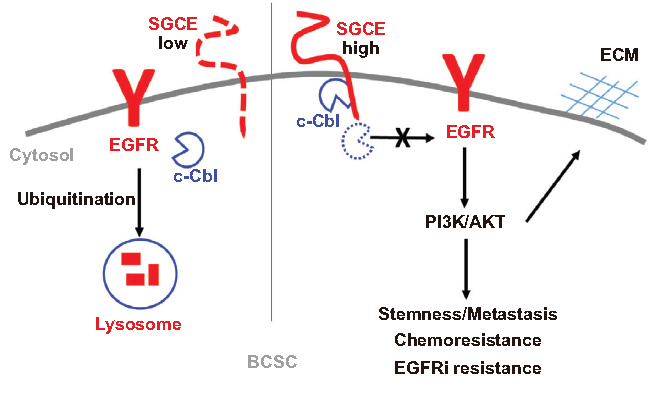
结论:
1. SGCE与肿瘤初发密切相关,通过EGFR调控BCSCs和ECM。
2. SGCE基因沉默增加了EGFR溶酶体降解,减少了EGFR循环到细胞膜,并促进EGFR与c-Cb1结合。
3. SGCE沉默降低三阴性乳腺癌对EGFR抑制剂耐药性,抑制其癌细胞的侵袭和转移。
参考文献:
Lina Zhao, Ting Qiu, Dewei Jiang, et al. SGCE Promotes Breast Cancer Stem Cells by Stabilizing EGFR. Advanced Science. 2020.






