头颈癌细胞铁死亡的奥秘
铁硫簇合功能的丧失通过上调铁饥饿反应使癌细胞易发生铁死亡,但谷氧还蛋白5(GLRX5)沉默在铁死亡中的作用尚不清楚。今天小编为大家介绍一篇发表于影响因子为8.579的“Theranostics”的文章“Inhibition of Glutaredoxin 5 predisposes Cisplatin-resistant Head and Neck Cancer Cells to Ferroptosis”,带大家了解GLRX5功能丧失在促进顺铂耐药头颈癌(HNC)细胞铁死亡中的作用。
在本文中,我们研究了磺胺嘧啶治疗和GLRX5基因沉默对HNC细胞系和小鼠肿瘤异种移植模型的影响。我们通过细胞活力和死亡、脂质活性氧(ROS)和线粒体铁产生、不稳定铁池、mRNA/蛋白表达和丙二醛测定对此进行分析。
技术路线:

结果:
1.抑制GLRX5促进HNC细胞铁性细胞死亡
Cyst(e)ine deprivation、erastin或SAS会诱导HNC细胞系铁死亡。HN3和HN4细胞的存活率以Cyst(e)ine deprivation的时间依赖性方式和erastin或SAS的剂量依赖性方式降低(图1A-C)。与HN3和HN4细胞相比,耐顺铂的HN3R和HN4R细胞对Cyst(e)ine deprivation、erastin或SAS治疗的敏感性相对较低。接下来我们验证了顺铂耐药的HNC细胞铁死亡诱导剂的低敏感性是否通过抑制GLRX5来克服的。GLRX5的基因沉默显著增加了SAS诱导的铁死亡引起的HN3R和HN4R的PI阳性细胞分数(图1D-F)。去铁胺预处理或与铁抑制素-1或α-生育酚联合处理可抑制细胞死亡。当siGLRX5转染到两个HNC细胞系中时,GLRX5的mRNA和蛋白质表达显著降低(图1G,1H)。此外,与载体对照组相比,GLRX5基因沉默也显著增加了SAS处理的癌细胞的脂质ROS生成(图1G–I)。
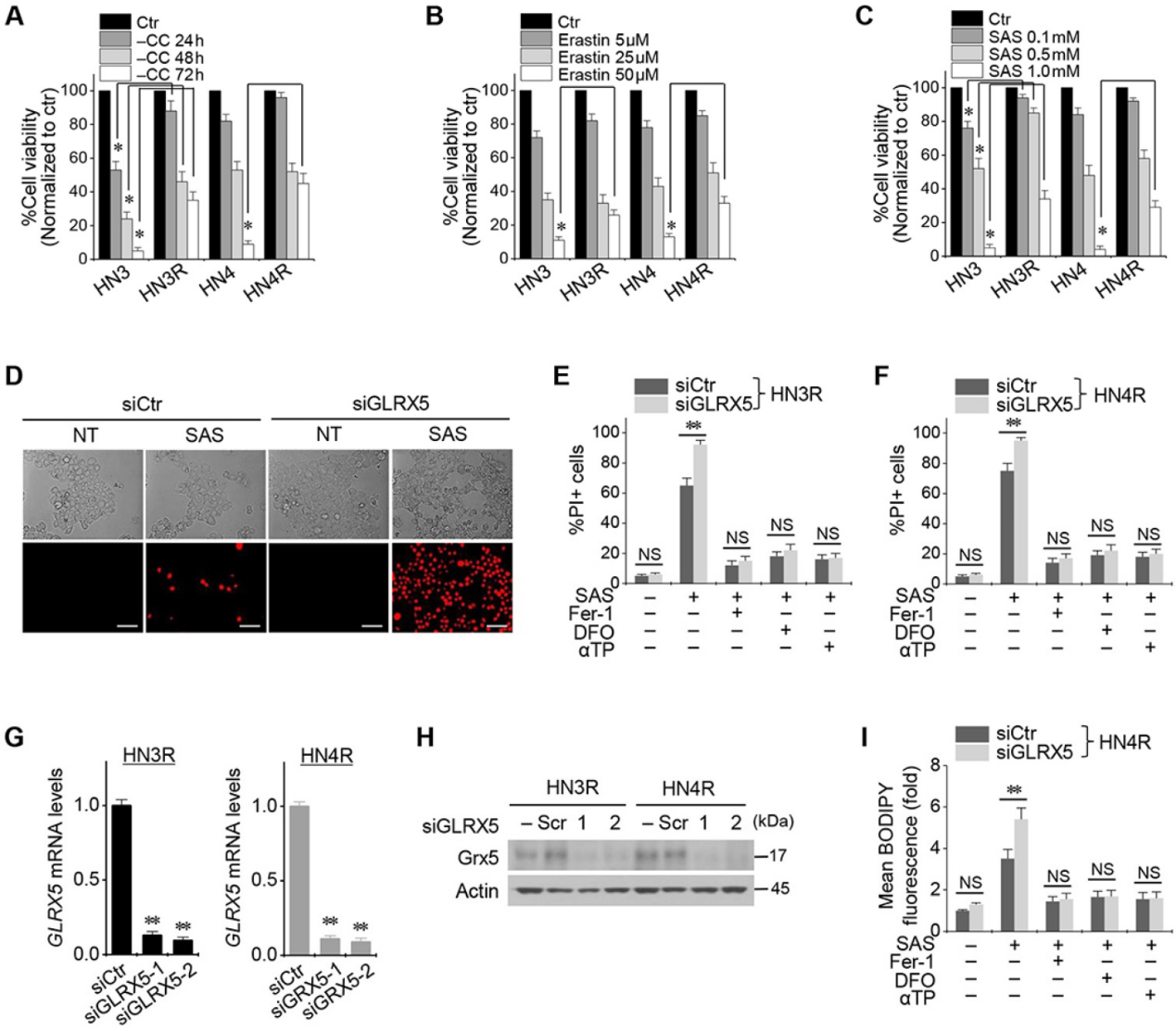
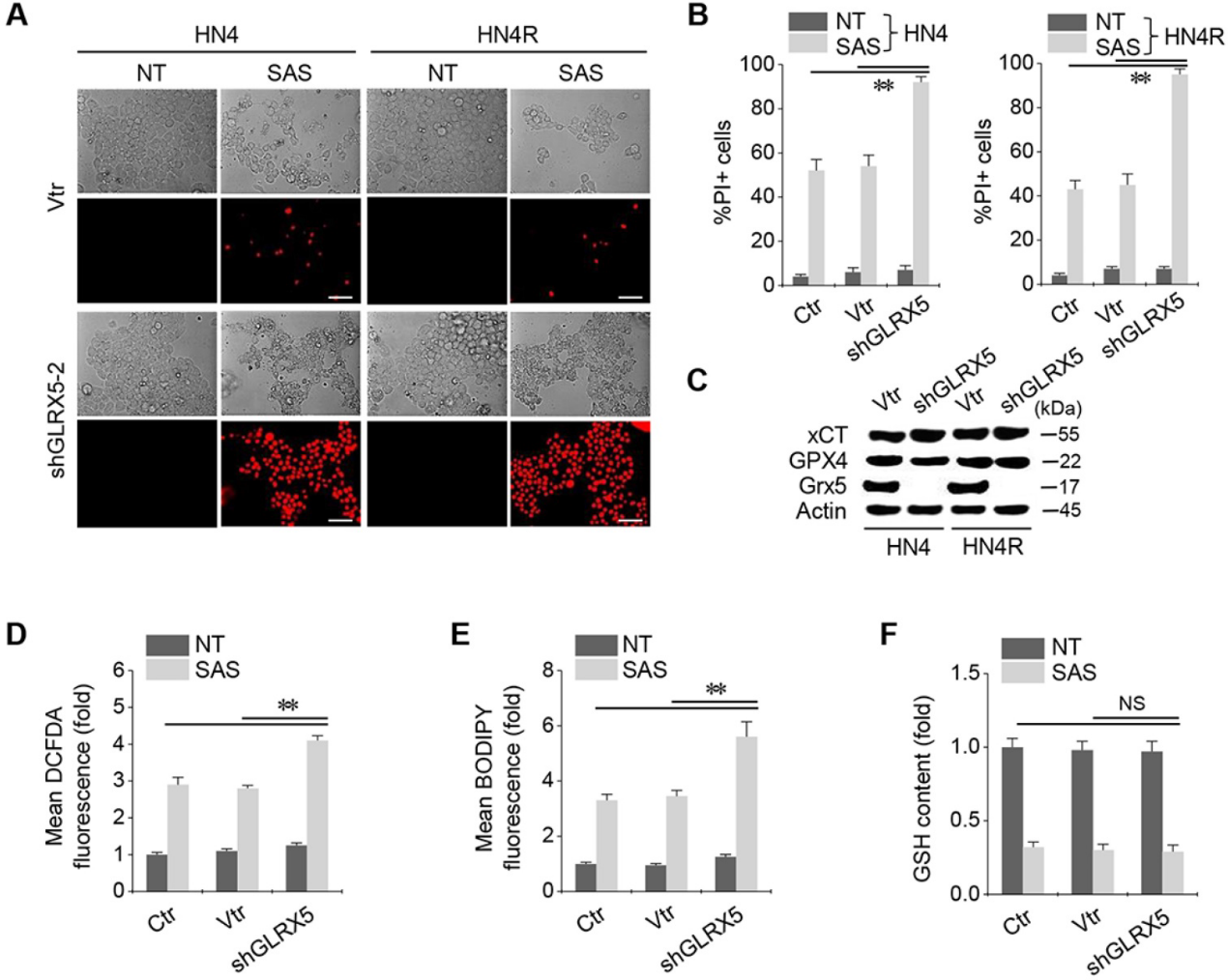
2.GLRX5基因沉默增加铁死亡和脂质过氧化
当shGLRX5或载体在HN4和HN4R细胞中稳定转化时,经SAS处理的两种细胞系中PI阳性细胞分数显著增加(图2A-B)。稳定的shGLRX5转导可显著降低GLRX5的蛋白表达,但不影响xCT和GPX4这两个与铁死亡相关的关键分子(图2C)。SAS诱导HNC细胞总ROS和脂质ROS水平显著升高,GSH含量降低。与非载体或载体对照组相比,随着GLRX5基因沉默,细胞和脂质ROS显著增加(图2D-E)。SAS处理降低了GSH水平,但对照组和shGLRX5基因沉默的HN4R细胞之间的GSH含量变化没有显著差异(图2F)。
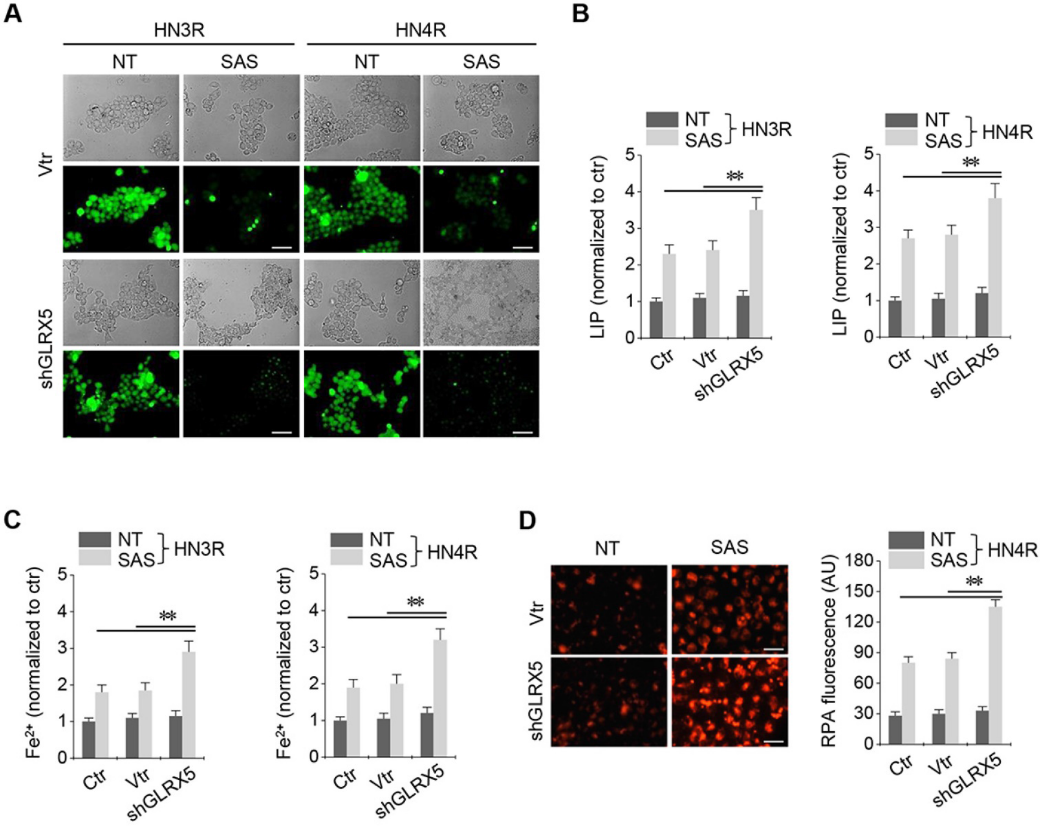
3.抑制GLRX5可提高细胞内游离铁水平
在顺铂耐药的HN3R和HN4R细胞中建立了稳定的GRX-shRNA和载体转导。SAS处理可显著提高HNC细胞的不稳定铁和亚铁(Fe2+)水平。SAS治疗后LIP增加,shGLRX5转化的癌细胞的LIP显著高于非载体和载体对照组(图3A-B)。SAS治疗后,shGLRX5转化的癌细胞的细胞和线粒体Fe2+水平显著高于对照组(图3C-D)。
4.抗GLRX5 cDNA可挽救铁死亡和游离铁增加
用靶向于GLRX5和耐GLRX5 cDNA(GLRX5res)或无催化活性的突变GLRX5 cDNA(GLRX5res K101Q)共或不共转导的shRNA转染顺铂耐药的HN4R细胞。GLRX5res转导恢复了HN4R细胞中由shGLRX5稳定转导抑制的GLRX5蛋白表达(图4A)。经SAS处理的shGLRX5转导细胞的PI阳性细胞分数比载体对照增加更多,而在shGLRX5和GLRX5res转染的HN4R细胞中,PI阳性细胞百分率恢复到载体对照水平(图4B)。shGLRX5基因沉默可显著增加SAS治疗后脂质ROS、LIP、游离铁和线粒体铁的积累,GLRX5res转导可使其恢复(图4C-F)。

5.抑制GLRX5可上调缺铁反应
在HN4R细胞中建立了稳定的shGLRX5和一个抗性GLRX5res cDNA或一个无催化活性突变的GLRX5res K101Q cDNA的稳定转导。GLRX5基因沉默增强了SAS治疗后的铁饥饿反应。在稳定转染shGLRX5的HN4R细胞中进行SAS处理后,TfR1和IRP2的蛋白质和mRNA表达增加,但FTH1和Fpn的蛋白质和mRNA表达减少,通过共转导耐药的GLRX5res而恢复(图5A-D)。此外,GLRX5基因沉默可显著降低乌头酸酶和α-KGDH活性,GLRX5res转导可恢复它们的活性(图5E-F)。GLRX5的蛋白质表达受到shGLRX5转导的抑制,而GLRX5res或GLRX5res K101Q则恢复了这种表达(图5G)。除了SAS治疗外,GLRX5基因沉默导致增加的PI阳性细胞分数也被GLRX5res挽救(图5H)。

6.GLRX5抑制可使抗治疗HNC细胞对SAS治疗敏感
所有小鼠在肿瘤细胞植入及SAS或载体治疗期间及之后均存活良好。他们在治疗28天后被死。转染载体和shGLRX5的癌细胞之间的肿瘤体积和重量没有差异(图6A-B)。与载体对照组相比,SAS治疗能显著抑制体内肿瘤生长,这一点在shGLRX5转化癌细胞移植的小鼠体内更为显著。对照组和SAS治疗组的体重和每日食物摄入量没有显著变化(图6C)。SAS治疗的肿瘤组织中脂质ROS、RPA和亚铁的水平显著高于载体对照组(图6D-F)。此外,SAS治疗后shGLRX5转导的肿瘤中的脂质ROS、RPA和亚铁水平的增加明显高于载体转导的肿瘤。GLRX5沉默导致TfR1增加和Fpn降低(图6G)。当肿瘤经历GLRX5沉默时,SAS治疗的肿瘤组织中脂质ROS、MDA浓度的最终产物增加更多(图6H)。

结论:
GLRX5的抑制通过增加细胞内游离铁和脂质过氧化,促进铁死亡。增强的铁死亡被GLRX5res挽救。总之,GLRX5的抑制使耐治疗的HNC细胞易发生铁死亡。






