乳腺癌内分泌治疗耐药?靶向PLK1试一试
雌激素受体(ER)阳性的乳腺癌(BC)患者占原发性乳腺肿瘤患者的80%以上,对ER阳性的BC患者利用内分泌治疗来阻断ER信号传导是经典的治疗方法。尽管内分泌治疗提高了生存率,但依然存在耐药的问题。目前,成功治疗ER阳性的BC患者的主要挑战是寻找内分泌治疗耐药后的新治疗靶点。近日,居里学院的Elisabetta Marangoni教授团队根据内分泌治疗进展和椎体成形术后骨转移患者建立病人来源异种移植(PDX)模型,并与早期原发性肿瘤进行比较,确定了转移灶中与内分泌耐药相关的新治疗靶点PLK1,证明了PLK1抑制剂在高度增殖的CCND1驱动的PDX中导致肿瘤显著收缩(包括不同的获得性哌柏西利耐药的RB阳性PDX)。相关研究结果以“PLK1 inhibition exhibits strong anti-tumoral activity in CCND1-driven breast cancer metastases with acquired palbociclib resistance”为题发表在Nature communications杂志上,杂志影响因子为12.121。
研究思路:
1.探究乳腺癌骨转移PDX与原发性乳腺肿瘤间的基因表达差异集,筛选PLK1作为新治疗靶点,并研究了PLK1抑制剂volasertib对肿瘤的作用。
2.探究volasertib在哌柏西利获得性耐药模型中的作用。
3.探究volasertib的适用性以及与疗效有关的分子标志物。
4.探究PLK1表达水平与内分泌治疗效果的关系。
结果:
1、PLK1是乳腺癌患者的新治疗靶点
作者对PDX骨转移模型和原发性乳腺肿瘤进行转录组比较分析,得到G2/M检查点特征和有丝分裂纺锤体G2/M检查点的差异表达基因集(a,b), 发现PDX骨转移模型中与有丝分裂相关的不同靶标激酶上调,包括PLK1、AURKA、AURKB、CDK1和MPS1,而PLK1是PDX模型中上调最高的基因之一(c)。作者评估了基于侵袭性ER阳性的HBCx-137 PDX模型中PLK1抑制剂volasertib的疗效,免疫组化结果显示PLK1和Ki67在PDX、骨转移病人以及原发乳腺癌肿瘤中强烈表达(d),发现原发乳腺肿瘤、骨转移和PDX的CAN表达谱与FGFR1、FGFR2和CCND1的局部放大和CCNE2的CN增益高度相似(e),进一步研究发现,volasertib使肿瘤迅速缩小,并在4周内达到完全缓解,且哌柏西利单药治疗或与氟维司群联合治疗均表现稳定,在治疗结束后6周,两组volasertib治疗的异种移植肿瘤复发,但再次经volasertib治疗后肿瘤迅速减小(f)。作者进一步研究了在肿瘤治疗中ER调控基因及其他相关基因的表达,发现在volasertib治疗的异种移植肿瘤中ERG的表达变化不明显,但CENPE的表达明显增加(g)。这些结果表明,在该肿瘤中,volasertib的抗肿瘤活性是ER独立,与增殖减少无关,与细胞周期阻滞在G2期有关,这与其已知的作用模式一致。
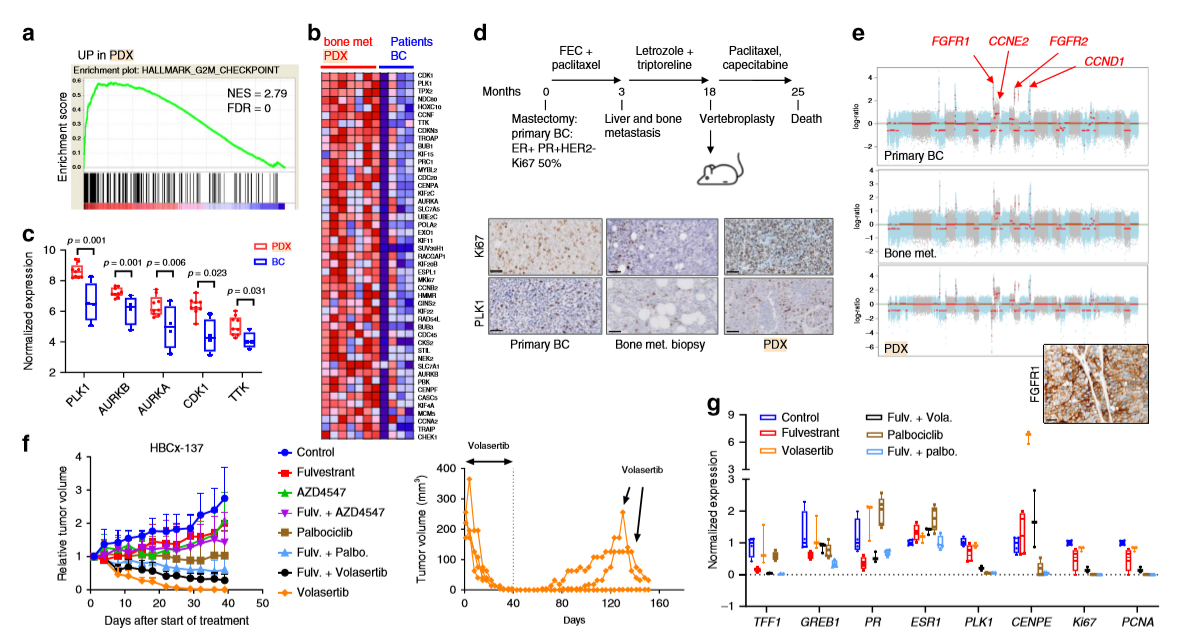
2、PLK1抑制剂对肿瘤的影响
作者基于诊断为转移性BC的26岁患者构建PDX HBCx-124模型,发现FGFR1、MYC、CCNE2、CCND1和AURKA扩增,且该肿瘤模型对氟维司群耐药,对volasertib反应完全,对哌柏西利±氟维司群稳定(a)。PDX HBCx-131模型来自一名乳房切除术后10年复发的41岁患者,而患者的乳腺肿瘤、骨转移和PDX显示FGFR1和CCND1扩增,骨转移和PDX携带CDKN2A纯合缺失,且PLK1和CDK4/6抑制剂并没有阻止肿瘤的生长(b)。基于乳房切除术和辅助激素治疗后9年复发的33岁BC患者构建PDX HBCx-139模型,发现该模型对volasertib和alpelisib (PI3K抑制剂)+氟维司群反应完全,对哌柏西利+氟维司群反应稳定(c)。总之,在fpur CCND1驱动的PDX模型中,靶向PLK1显示显著的肿瘤消退。
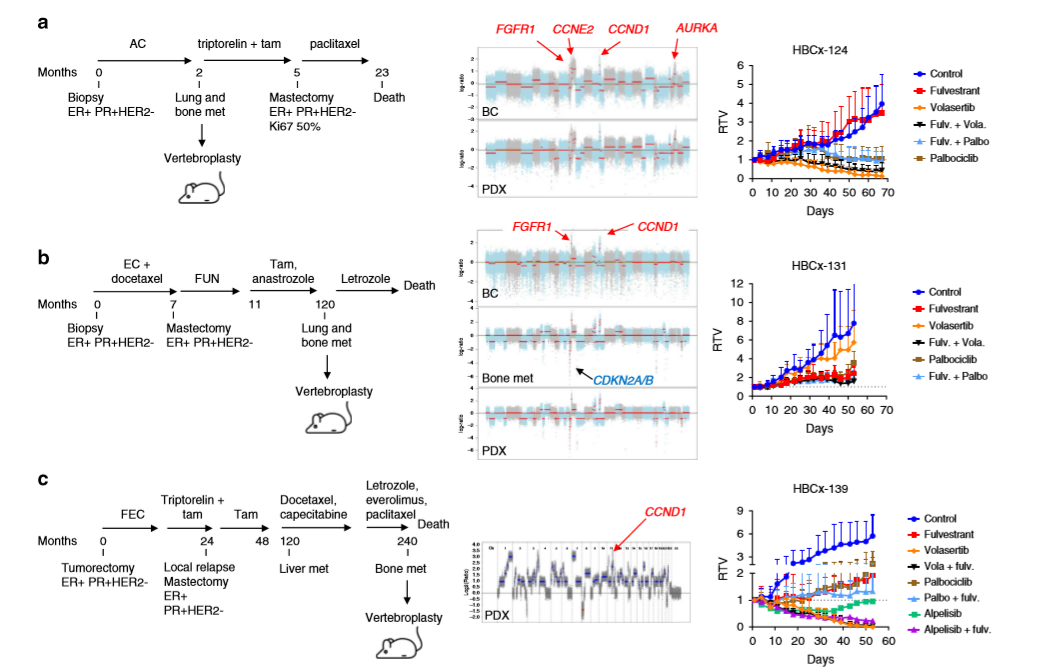
3、哌柏西利获得性耐药模型的构建和表达特征的探究
作者建立两个哌柏西利获得性耐药PDX模型,第一个HBCx-134异种移植模型是基于携带PIK3CA突变的71岁乳腺癌骨转移患者,该患者在新辅助治疗中使用PI3K抑制剂联合来曲唑治疗,病理检查发现患者对新辅助治疗无响应,患者和PDX肿瘤均有CCND1扩增,且在PDX中发现CDKN2A纯合缺失,进一步研究发现HBCx-134异种移植模型最初对哌柏西利有反应,通过长期暴露于CDK4/6抑制剂下建立了抗哌柏西利的PDX(a-b);异种移植的HBCx-134 Palbo R31模型对alpelisib和氟维司群具有交叉抗性,但对volasertib反应灵敏(d),而亲本肿瘤和抗哌柏西利的异种移植物中磷酸化-RB的丰度也相似,说明在这个模型中,哌柏西利的抗性并非由于RB的缺失(e)。第二种哌柏西利获得性耐药模型来自于HBCx-124异种移植肿瘤,接受哌柏西利治疗5个月后,肿瘤生长在肿瘤逃脱前2个月稳定(f),将HBCx-124 Palbo-R25重新植入另一组小鼠,发现对volasertib有显著反应(g),且在palbo-R25 PDX中保存了磷酸化-RB的表达(h)。
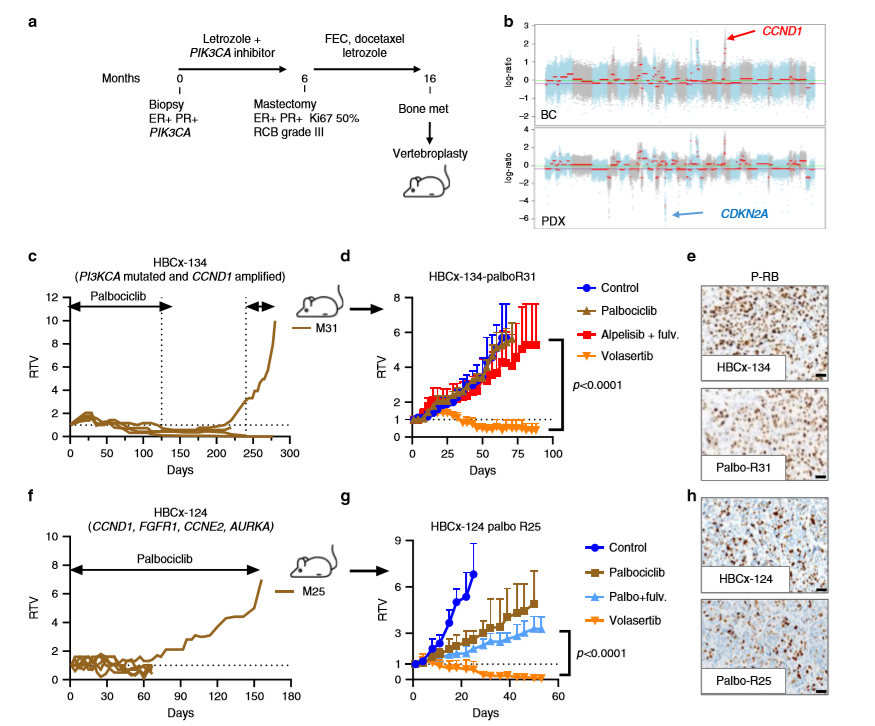
4、PLK1抑制剂适用性探究
PDX HBCx-180相对应的患者在乳房手术后14年和辅助内分泌治疗结束后4年再次出现骨转移,且在椎体成形术和建立PDX前接受了三个周期的哌柏西利+来曲唑和紫杉醇治疗(a)。免疫组化结果表明PDX中Ki67和PLK1高表达、磷酸化-RB阳性(b)。研究发现PDX重现了对哌柏西利±氟维司群的耐药性,并对volasertib有反应(c)。另一个模型PDX HBCx-176,来自于一位在乳房手术后14年因转移性疾病复发的患者(具有NF1基因移码插入),并在3个月的时间内接受了哌柏西利+来曲唑的治疗(d)。免疫组化结果显示PDX中P-RB呈阳性且P-ERK强表达(e),进一步研究发现HBCx-176经曲美替尼(MEK抑制剂)治疗后肿瘤消退,但对哌柏西利和volasertib均耐药(f)。这些结果表明,靶向PLK1是一种有效的治疗方法,适用于ccnd1驱动的对哌柏西利获得性耐药的PDX模型。此外,NF1突变的肿瘤对哌柏西利和volasertib都有抗性,但对曲美替尼有反应。
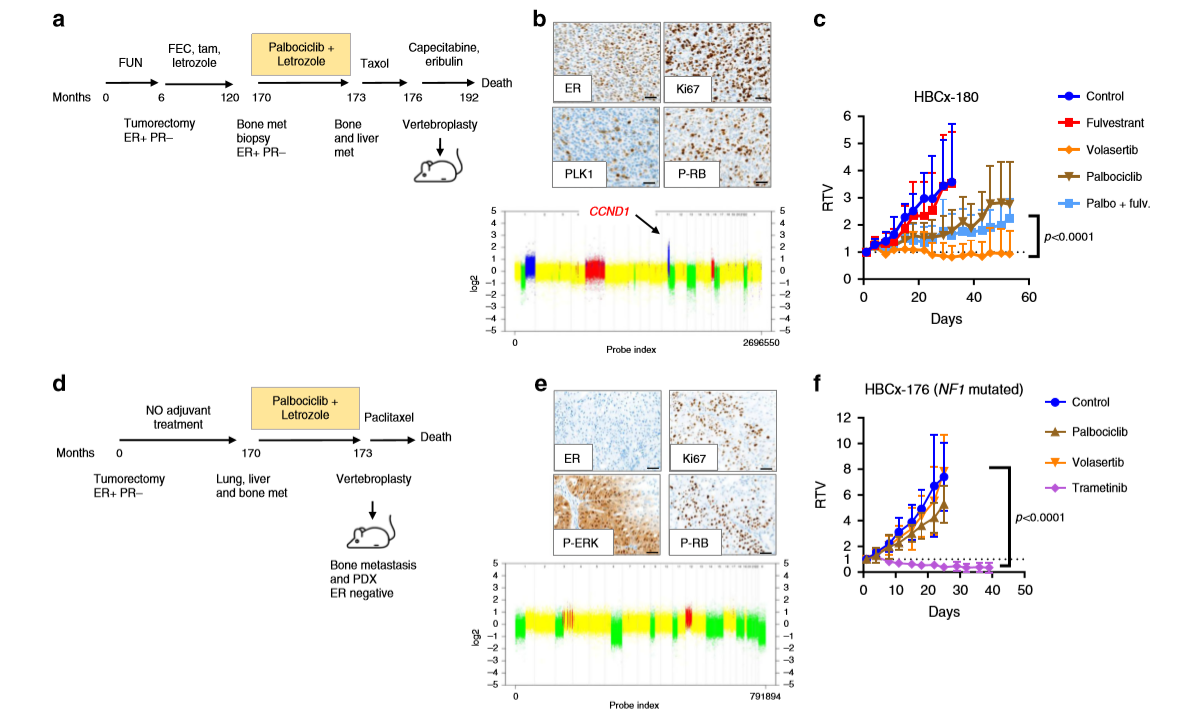
5、volasertib的疗效与PLK1和Ki67表达相关
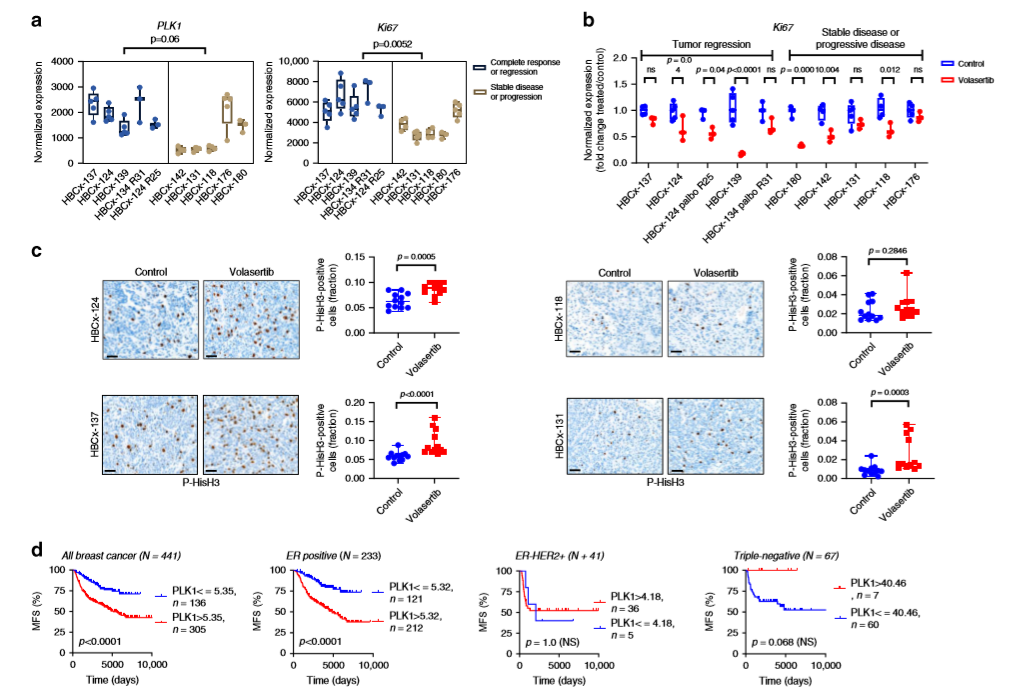
作者分析了7个PDX模型中PLK1和Ki67基因的表达水平,发现PLK1和Ki67基因在对volasertib完全应答或肿瘤消退的PDX中表达均较高(a),进一步分析了volasertib治疗肿瘤模型中Ki67的表达情况,发现在六种PDX模型中,Ki67表达下降:肿瘤有反应的组中有三种,在病情稳定或进展的PDX组中有三种(b)。免疫组化表明在单次给药(volasertib)24小时后P-HisH3染色增加在PDX HBCx-124和HBCx-137肿瘤细胞中达到10%,在HBCx-131模型中达到3%(c)。这些结果表明高增殖肿瘤对volasertib反应更强,并且与治疗后有丝分裂停止有关。作者进一步分析了PLK1的预后意义,发现PLK1表达水平高的肿瘤患者的无转移生存率 (5年MFS =68.4%,10年MFS =58.5%,15年MFS=49.8%)小于PLK1低表达肿瘤患者,且PLK1表达状态在全球人群中的预后意义仅限于HR阳性(HR+HER2+和HR+HER2−)亚组,而在三阴性亚组和HR-HER2+亚组中未观察到(d)。
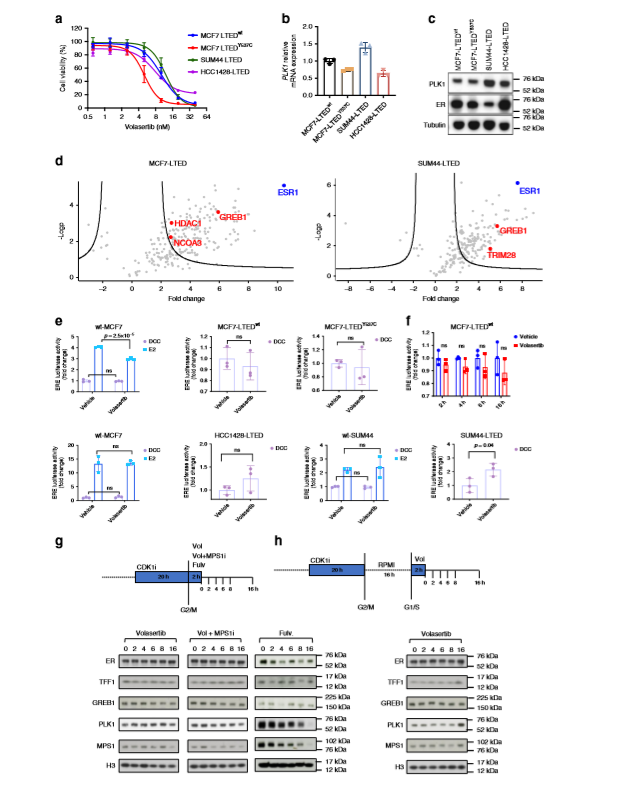
6、体外PLK1与ER不相互作用
为了在体外分析PLK1和ER的相互作用,一组长期雌激素剥夺(LTED)耐药的细胞系(含有自然发生的ESR1Y537S,ESR1Y537C或ESR1野生型)被置于不断升高的volasertib浓度下,发现所有被测细胞系的增殖呈剂量依赖性下降(a),且PLK1的表达在mRNA或蛋白水平上都不是敏感性的决定因素(b,c),分析了在有雌激素的wt-MCF7和wt-SUM44细胞中RIME和二甲基标记以及没有雌激素情况下比较了MCF7-LTED和SUM44-LTED,发现所有模型中最丰富的是与ER的交互,而主要的ER-交互作用是NCOA3、GREB1、TRIM28和HDAC1(d)。通过siRNA靶向PLK1和volasertib治疗评估ER介导的反激活以及PLK1扰乱对特异性雌激素调控基因(ERGs)表达的影响,发现在雌激素存在或不存在的情况下,volasertib对PLK1的抑制对ER/ERE介导在wt-MCF7、wt-HCC1428和wt-SUM44中的反式激活影响很小或没有影响,而在LTED模型中除了SUM44-LTED外其他没有明显的显著影响,在SUM44-LTED中,volasertib导致ER/ERE报告基因活性显著上升(e)。作者进一步评估了volasertib处理MCF7-LTED细胞16小时后ER/ERE-荧光素酶活性,发现对激素独立的转录活性无明显影响(f)。通过RO3306(CDK1抑制剂)和volasertib±BOS172722(MPS1抑制剂)同步处理MCF7-LTED细胞,发现抑制PLK1对TFF1、GREB1或ER的丰度没有影响,但在存在volasertib和BOS172722的情况下,MPS1表达量呈时间依赖性下降,表明细胞周期停止,同时发现其对照组氟维司群处理的细胞中ER、TFF1和GREB1的降低呈周期性,且氟维司群导致MPS1和PLK1在处理后4h减少,这与细胞周期阻滞相一致(g,h)。
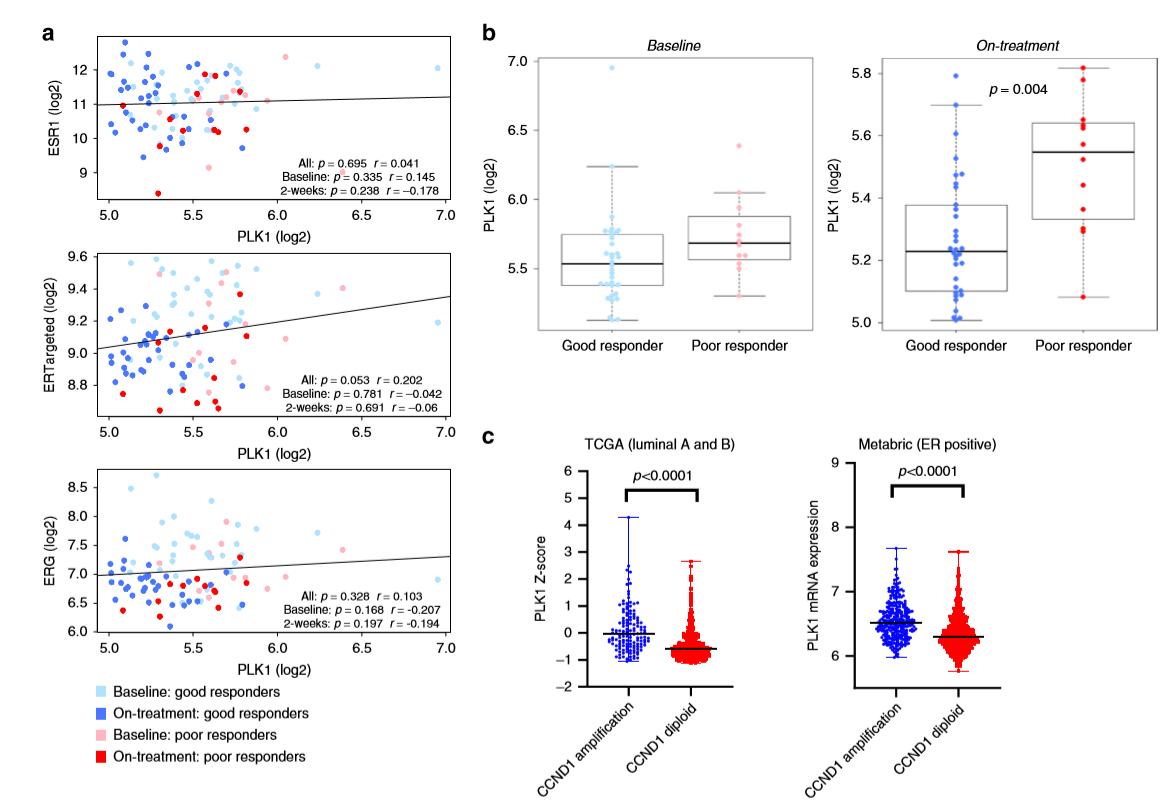
7、PLK1与内分泌治疗效果的关系
作者评估了69例接受单药新辅助阿那曲唑治疗两周后的I期至IIIB ER阳性早期BC绝经患者中PLK1与ERG表达的关系,发现PLK1表达与ERGs无关(a), 且在同一组患者中发现PLK1表达水平高与阿那曲唑的不良反应有关(b)。通过TCGA和Metabric乳腺癌数据分析发现CCND1扩增的乳腺肿瘤中PLK1表达较高(c)。这些数据表明,PLK1在治疗时表达水平高与内分泌治疗的不良反应相关。
结论:
1.PLK1抑制导致高增殖的CCND1驱动PDX肿瘤收缩,包括不同的获得性哌柏西利耐药的RB阳性PDX。
2.PLK1表达水平高与较短的无转移生存期和阿那曲唑的不良反应之间有很强的相关性。
参考文献:
Elodie Montaudon, Joanna Nikitorowicz-Buniak, Laura Sourd et al. PLK1 inhibition exhibits strong anti-tumoral activity in CCND1-driven breast cancer metastases with acquired palbociclib resistance. Nature communications. 2020.






