Biomaterials|MSC源性外泌体通过NRF2防御系统的适应性调节保护氧化应激诱导的皮肤损伤
最近在Biomaterials上线了一篇标题为 “MSC-derived exosomes protect against oxidative stress-induced skin injury via adaptive regulation of the NRF2 defense system” 的文章。该文的通讯作者是来自西安交通大学安市中心医院微创神经外科与转化医学中心的龙乾发。
氧化应激是紫外线照射和其他损伤性刺激引起皮肤损伤的主要原因。这些刺激可通过促进活性氧(ROS)的产生和降低抗氧化酶活性,损害细胞脂质、蛋白质和皮肤细胞的dna,从而导致晒伤、过早衰老和致癌。间充质干细胞(Mesenchymal stem cells, MSCs)是具有多向分化潜能和免疫抑制特性的多能基质细胞。它们可以从多种来源获得,包括脐带、骨髓或脂肪组织,这使它们成为一种很有前途的适合免疫调节和再生的候选细胞类型。越来越多的证据表明,骨髓间充质干细胞分泌的细胞外囊泡(EVs)通过携带大量的蛋白质、脂质和核酸,在细胞间通信中发挥着关键作用,此外,它还是生物标志物的潜在来源和多种疾病中细胞间生物分子转移的有效载体。外泌体是一类EV,直径30-150nm,最初根据其内吞起源定义。此外,它们还显示出多种生物功能,可作为游离细胞疗法。我们之前的研究表明,MSCs-来源的外泌体(MSC-Exo)在抗炎和损伤修复方面表现出可观的前景;作为一种纳米治疗药物正在被广泛测试,用于治疗糖尿病、中风和伤口愈合。然而,就我们所知,MSC-Exo对氧化应激诱导的皮肤损伤的治疗作用和机制尚不清楚。
角质形成细胞占皮肤表皮细胞的90%,通过调节氧化应激、葡萄糖代谢和炎症介质形成屏障,抵御环境损伤。治疗皮肤损伤的一个重要策略可能涉及调节角质形成细胞的核因子红样来源2 (NRF2)信号通路,以应对外部氧化刺激。已发表的研究表明NRF2在皮肤损伤或炎症后调节抗氧化酶的表达中起着重要作用。NRF2是一种具有帽n领结构的碱性亮氨酸拉链转录因子,被Kelch like- ech相关蛋白1 (Keap1)隔离在细胞质中,并通过泛素化快速降解。以往的研究表明,NRF2通路在皮肤损伤中的内部或系统激活会产生级联效应,从而产生多种强抗氧化剂,包括超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-PX)和过氧化氢酶(CAT)。此外,在氧化应激下,NRF2转位到细胞核,并与DNA启动子结合,启动许多抗氧化基因和细胞保护蛋白的转录,如NAD(P)H醌氧化还原酶1 (NQO1)和血红素加氧酶1 (HO-1)。目前,NRF2已被证明是一种很有前途的分子靶点,用于药理学预防氧化应激引起的皮肤损伤。
技术路线:
结果:
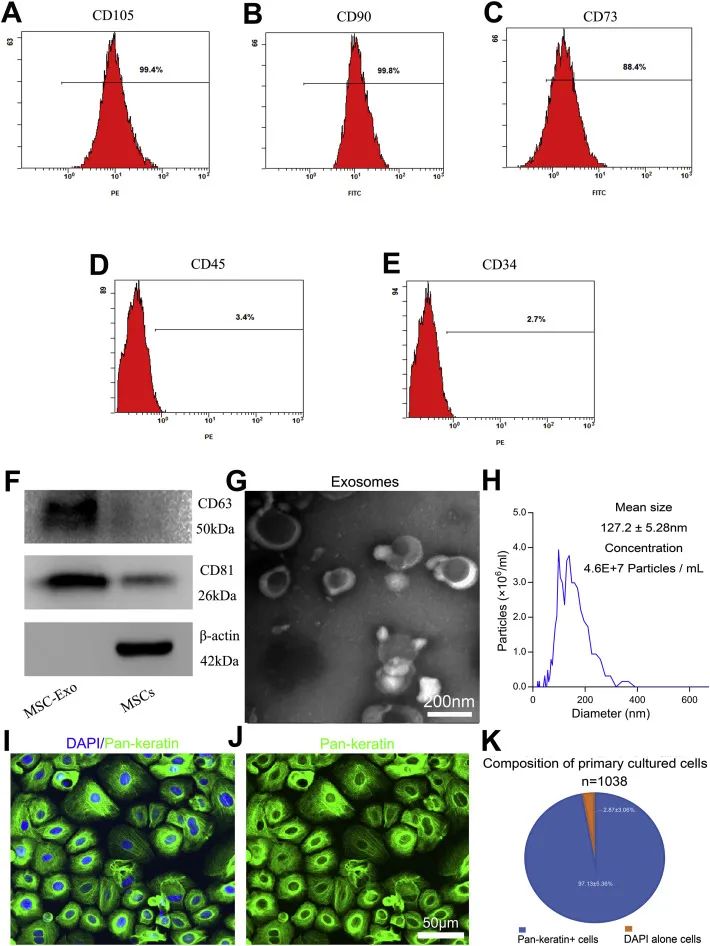
一、MSC,外泌体和角质形成细胞的鉴定
二、MSC-Exo抑制氧化损伤,促进H2O2刺激的角质形成细胞的抗氧化活性和减轻氧化反应
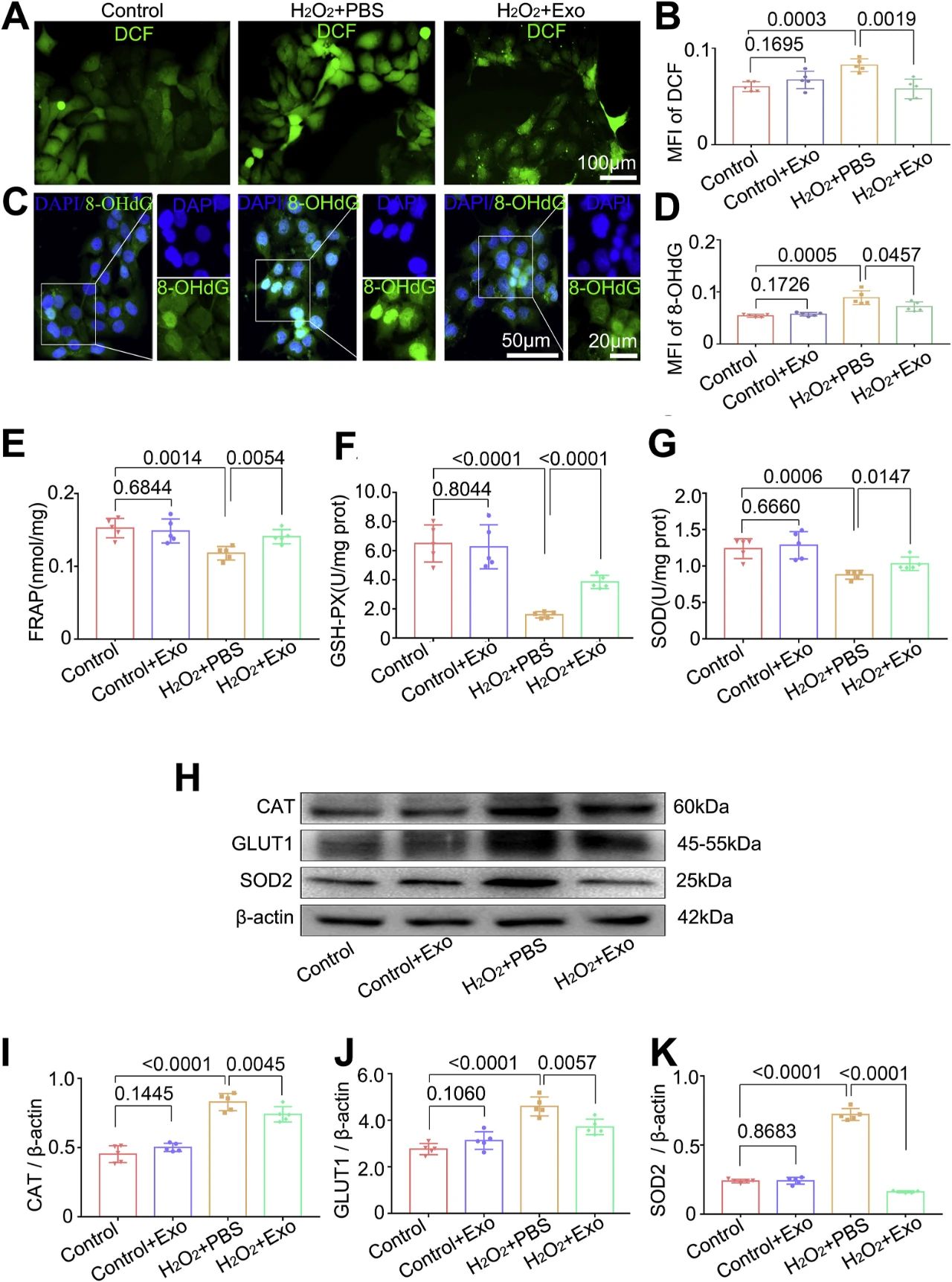
探讨MSC-Exo对原代培养角质形成细胞氧化应激的治疗作用。首先,评估原代培养角质形成细胞的ROS生成(图2A)和DNA损伤(图2C)。我们的结果显示,MSC-Exo处理显著降低了H2O2 + Exo组DCF (ROS生成指标)(图2B)和8-OHdG (DNA损伤标记)(图2D)的平均荧光强度(MFI)。其次,采用铁离子还原抗氧化能力(FRAP)、GSH-PX和SOD试剂盒检测MSC-Exo的抗氧化活性。
与H2O2 + PBS组相比,MSC-Exo给药增加了FRAP(图2E)、GSH-PX(图2F)和SOD(图2G)的浓度。此外,猫SOD2的表达,以应对氧化挑战了使用定量聚合酶链反应(qPCR)(图S5)和免疫印迹(图2 h)和结果表明,过氧化氢+ PBS组相比,MSC-Exo治疗恢复mRNA和蛋白表达的猫(图S5A;图2I)、SOD2(图S5B;图2 k)。
同时,用Western blotting检测各组中GLUT1的表达情况(图2H)。我们观察到,MSC-Exo显著降低了H2O2 + Exo组中GLUT1的表达(图2J)。另外,对照组与对照组+ Exo组在这些试验中均无显著差异。总之,这些研究结果表明,MSC-Exo处理可抑制氧化损伤,促进H2O2刺激的角质形成细胞的抗氧化活性并减轻氧化反应。
在氧化应激诱导的细胞和皮肤损伤中,外泌体疗法还通过增加铁离子降低抗氧化能力和谷胱甘肽过氧化物酶或超氧化物歧化酶活性来提高抗氧化能力。此外,在细胞或动物模型中,它还减轻了细胞和组织对炎症和氧化的反应。
三、在体外和体内,MSC-Exo均下调氧化应激后的NRF2
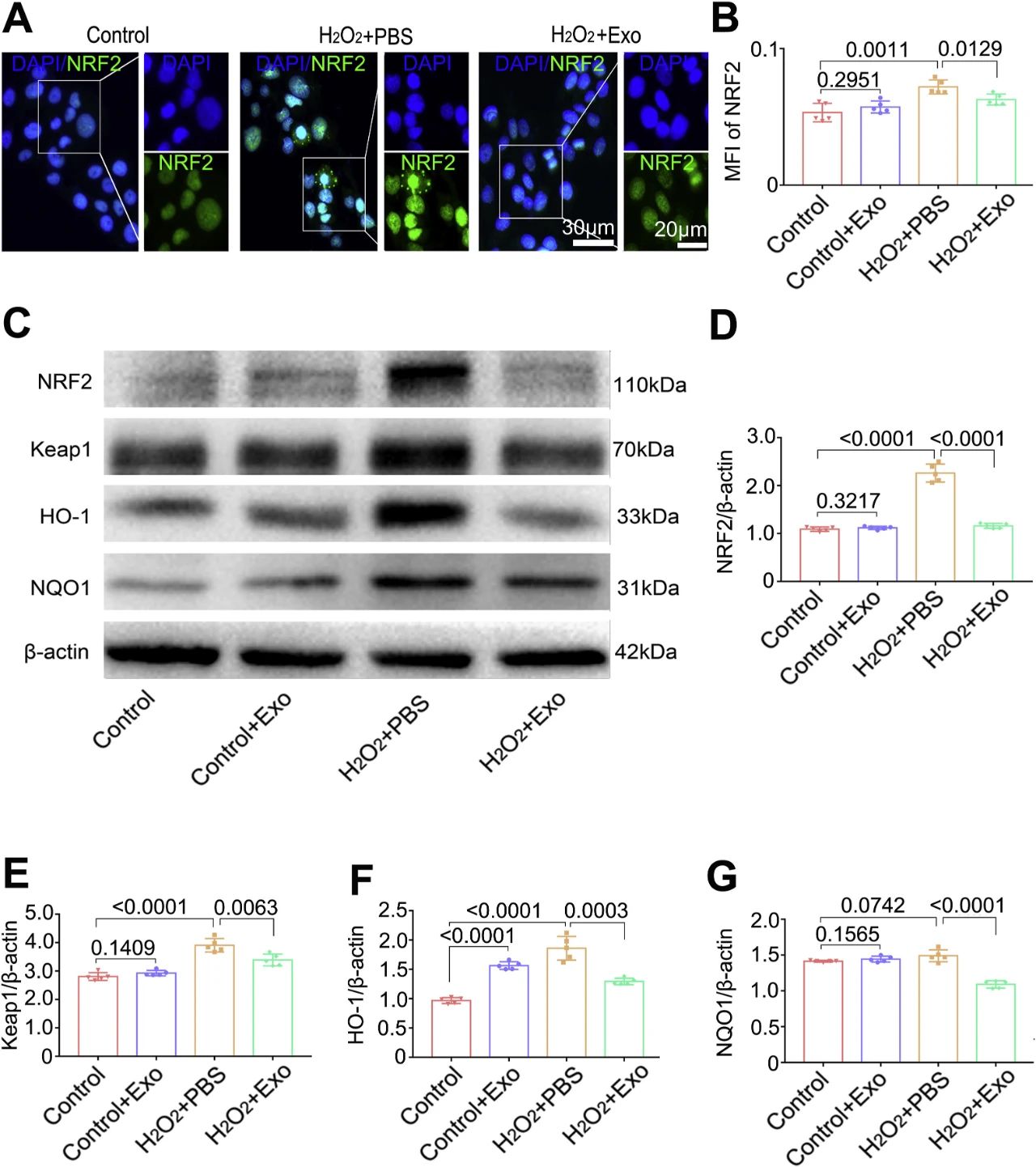
为了研究NRF2信号通路是否参与氧化损伤后的sc - exo活性,我们通过免疫染色或Western blotting检测该通路参与者NRF2、HO-1、NQO1、Keap1的表达水平。
当NRF2表达式模式的细胞(图7)或动物模型(图S10A)是使用免疫染色检查,我们发现MSC-Exo治疗抑制NRF2核易位的主要培养角质细胞(图7)和小鼠皮肤(图S10A),并且积极的小额信贷机构或利率NRF2相比显著降低过氧化氢+ PBS组(图7 b)或紫外线+ PBS组(图S10B)。与之前的研究结果一致,
我们的蛋白分析(图7C;图S10C)显示氧化应激诱导NRF2显著升高(图7D;图S10D)、Keap1(图7E;图S10E)、HO-1(图7F;图S10F)和NQO1(图S10G, 24h和4d)在角质形成细胞或背侧皮肤中表达,而在h2o2刺激的角质形成细胞(图7G)和uv照射小鼠皮肤(图S10G)第14天(图S10G)和uv照射小鼠皮肤中NQO1表达变化未见。
相反,与UV + PBS组相比,MSC-Exo处理降低了NRF2的相对表达(图7D;图S10D)、Keap1(图7E;图S10E, 24h, 4d;), HO-1(图7F;图S10F, 24h, 4d)和NQO1(图7G;图:S10G, 24小时和4天)在h2o2刺激的角质形成细胞和uv照射小鼠皮肤。有趣的是,UV + PBS组和UV + Exo组在UV照射后第14天观察到HO-1的表达增加(图S10F),而Keap1(图S10E)和NQO1(图S10G)的表达没有变化。这些结果表明,在体外和体内,MSC-Exo在氧化应激后下调了NRF2。
总之,NRF2信号通路参与了MSC-Exo的抗氧化活性,而Nrf2基因敲除则减弱了MSC-Exo在体内外的抗氧化能力,表明这些作用部分是通过NRF2信号通路介导的。






