m6a+肿瘤生信挖掘, 鉴定了METTL3为肝细胞癌的不良预后生物标志物
m6A(N6-methyladenosine,6-甲基腺嘌呤)是真核生物mRNA最常见的一种转录后修饰,占到RNA甲基化修饰的80%。绝大部分真核生物中, mRNA 5’UTR区域发生的甲基化修饰,在mRNA剪接、编辑、稳定性、降解、多腺苷酸化等方面发挥重要功能;而3’UTR区域发生的甲基化修饰有助于mRNA的出核转运、翻译起始以及与polyA结合蛋白一起维持mRNA的结构稳定。m6A甲基化酶广泛参与哺乳动物的发育,免疫,肿瘤生成和转移,干细胞更新,脂肪分化等生命过程。

2020年4月至8月,梅州人民医院和广东省精准医疗与客家人群临床转化研究重点实验室Gao-Min Liu团队在Digestive Diseases and Sciences 杂志上发表了题为“Identifcation of METTL3 as an Adverse Prognostic Biomarker in Hepatocellular Carcinoma”的文章,阐述了m6A相关基因在肝细胞癌(HCC)中的作用。作者主要探讨了16个m6A相关基因在HCC中的基因特征,以及这些特征对HCC患者的临床表现和预后的预测价值。
技术路线:
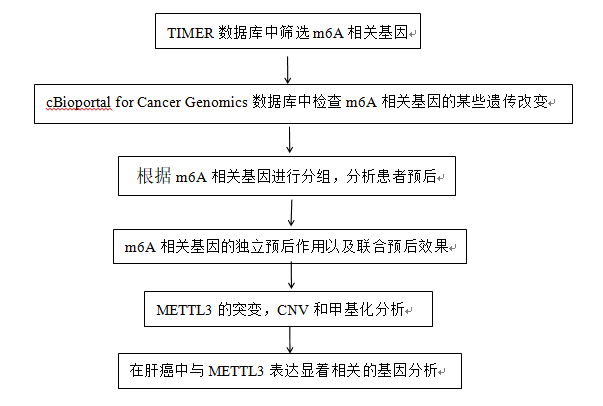
结果:
1.m6A相关的基因表达和遗传改变
在TIMER(https://cistrome.shinyapps.io/timer/)数据库中,m6A相关基因在具有特定癌症模式的癌症中表达谱。这里作者分析了16个m6A相关基因 METTL3,METTL14,RBM15,VIRMA,WTAP,ZC3H13,FTO,ALKBH5,YTHDF1,YTHDF2,YTHDF3,YTHDC1 / 2和IGF2BP1 / 2/3在各种癌症中的表达情况(图1a)。
其中,除ZC3H13外,在配对的HCC和TCGA-LIHC数据集中发现所有m6A相关基因在其50个HCC肿瘤样品中均显着上调(图1b)。
在cBioportal for Cancer Genomics(http://www.cbioportal.org/)数据库中,有127/366(35%)患者显示了m6A相关基因的某些遗传改变。扩增和深度缺失突变是最常见的遗传变异。 VIRMA是变化最频繁的与m6A相关的基因(变化率为16%)(图1c)。

2.m6A相关基因的预后作用
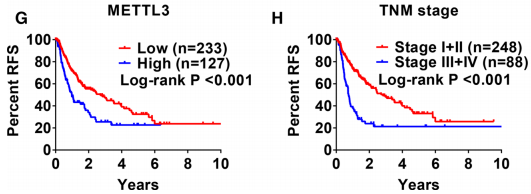
作者根据每个基因的最佳切除将患者分为高表达组和低表达组。Kaplan–Meier曲线分析显示了,晚期TNM分期,较高的METTL3表达,较高的YTHDF2表达,较高的YTHDF3表达,较低的ZC3H13表达以及无危险因素的患者OS明显较其同行者差(图2a– F)。

晚期TNM分期和METTL3表达较高的患者RFS明显较其他患者差(图2g,h)。
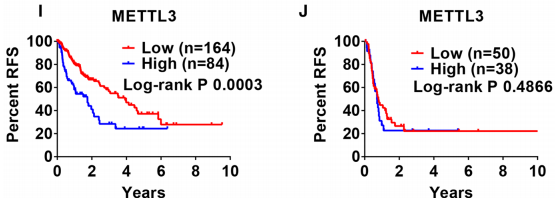
此外,在TNM I + II和III + IV患者中,较高的METTL3和YTHDF2表达水平与较差的OS相关(图3a,b,e,f)


在TNM I + II患者中,较低的ZC3H13表达和较高的METTL3表达水平与较差的OS和RFS相关,而在TNM III + IV患者中则不相关(图3c,d,i,j)。

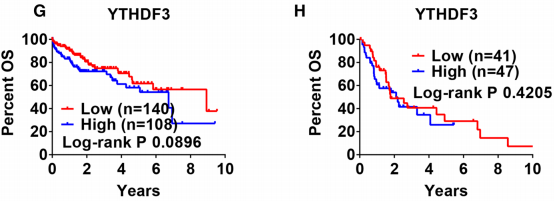
根据TNM分期对患者进行分层时,YTHDF3的表达与OS无关(图3g,h)。
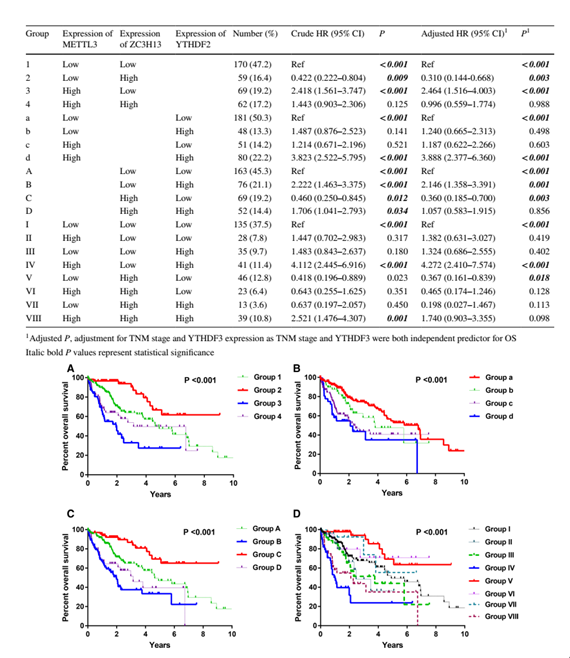
3.METTL3,ZC3H13和YTHDF2在OS预后中的联合效果分析
METTL3和ZC3H13组合的联合效果分析显示OS在第3组中最差,在第2组中最好。 YTHDF2显示OS在d组中最差,在a组中最好。 ZC3H13和YTHDF2组合的联合效果分析表明,OS在B组中最差,在C组中最佳。METTL3,ZC3H13和YTHDF2组合的联合效果分析表明,OS往往是最差的。 IV组和V组中最好。联合效果的详细分析结果如表3和图4所示。总之,METTL3,ZC3H13和YTHDF2的独立预后作用以及联合使用的意义这些预后因素。
4.METTL3的突变,CNV和甲基化分析
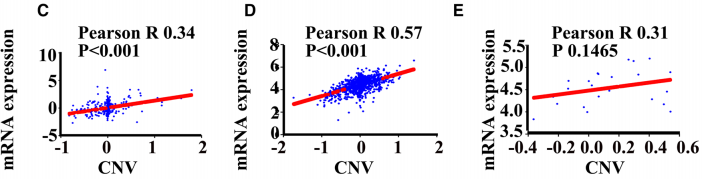
我们进一步分析了METTL3失调的潜在机制,因为它是OS和RFS的独立预后因素。UCSC Xena (https://xenabrowser.net/heatmap/)数据库显示METTL3 mRNA的表达与CNV和某些DNA甲基化位点相关,但与体细胞突变无关。来自cBioportal的癌症基因组学突变图进一步证实了366名患者/样品中METTL3失调的体细胞突变的缺乏(图5b)。

在cBioportal for Cancer Genomics (http://www.cbioportal.org/)数据库中,366名TCGA-LIHC患者中,以及在CCLE (https://portals.broadinstitute.org/ccle)数据库中的973个癌细胞系和24个肝癌细胞系中,METTL3的mRNA表达与CNV呈正相关(图5c– e)。
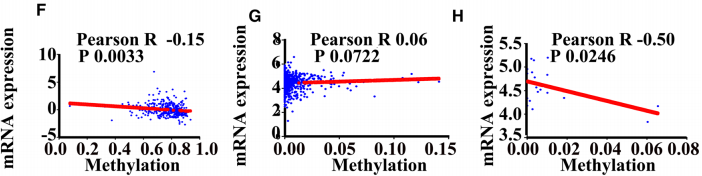
METTL3的mRNA表达在cBioportal for Cancer Genomics (http://www.cbioportal.org/)数据库中的366 TCGA-LIHC患者和21个肝癌细胞系中与DNA甲基化呈负相关,但在CCLE数据库 (https://portals.broadinstitute.org/ccle)中的整个832个癌细胞系中却没有(图5f–h)。
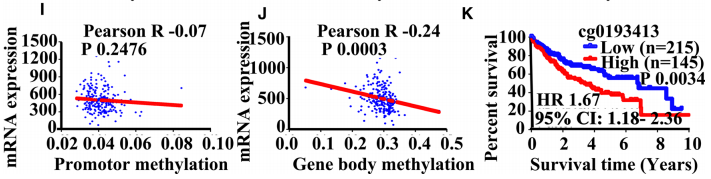
DNA基因的身体甲基化,而不是启动子或CpG岛,与MethHC数据库 (http://methhc.mbc.nctu.edu.tw/php/index.php)中METTL3的mRNA表达呈显着负相关(图5i,j)。此外,在MethSurve (https://biit.cs.ut.ee/methsurv/)数据库中,发现METTL3的DNA基因体区域中的cg01993413是HCC中OS的独立预后因素(图5k)。总之,CNV和DNA基因体甲基化可能是METTL3在肝癌中异常上调的原因。
5.METTL3的潜在调控机制
总共确定了393个上调基因和59个下调基因与METTL3表达显着相关(图6a)。其中有75个上调基因和27个下调基因(22.6%)与肝癌相关。
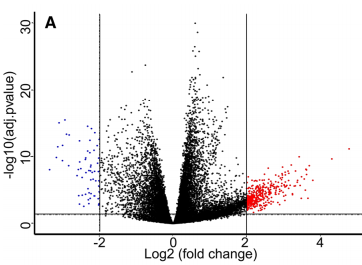
进一步的功能富集分析显示,在胚胎肢体形态发生,附件形态发生,跨膜转运蛋白复合物和配体门控通道活性(特别是离子通道活性)方面,GO术语显着丰富(图6b)。在高METTL3组中,没有KEGG途径显着丰富。
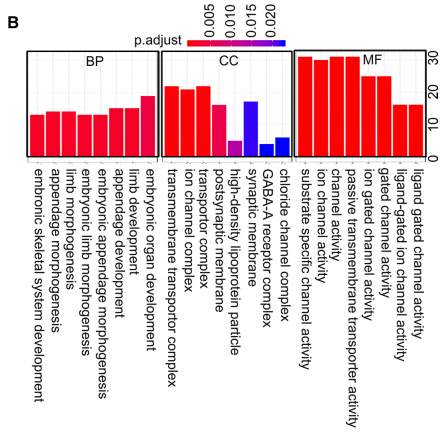
总共鉴定出12个上调的microRNA和32个下调的microRNA与METTL3表达显着相关(图6c)。其中25例(56.8%)与HCC相关。
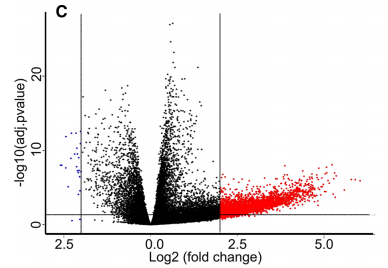
总共鉴定出119个上调的lncRNA和6个下调的lncRNA与METTL3表达显着相关(图6d)。其中,只有四个lncRNA与肝癌相关

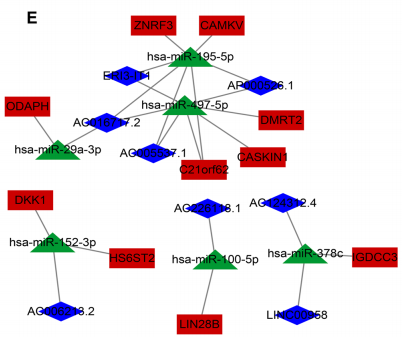
最后,构建了一个包括8个lncRNA,6个microRNA和10个mRNA的ceRNA调控网络(图6e)。
结论:
我们的研究鉴定了16个与m6A相关的基因,尤其是METTL3,这些基因可能是肝癌的潜在预后生物标志物。 此外,鉴定出显着改变的基因,miRNA,lncRNA,并构建了一个ceRNA调控网络来解释肝癌中METTL3的上调。 但是,还需要进一步的研究验证。






