缺氧对细胞内铁的影响(铁自噬,铁死亡,线粒体铁蛋白)
在生理水平上,铁是维持几个代谢途径所必需的,而在缺血/再灌注、肾损伤或癌症等各种病理条件下,过量的游离铁可能导致氧化损伤或引起细胞死亡。但是人类巨噬细胞在缺氧状态下的调控机制尚不清楚。德国法兰克福歌德大学医学院生物化学研究所的Dominik C. Fuhrmann等人在Redox Biology(IF=9.986)上发表文章探究人类巨噬细胞中,缺氧与铁自噬,线粒体铁蛋白,铁死亡的关系。
技术路线图:

研究结果:
1.缺氧状态下巨噬细胞的铁状态
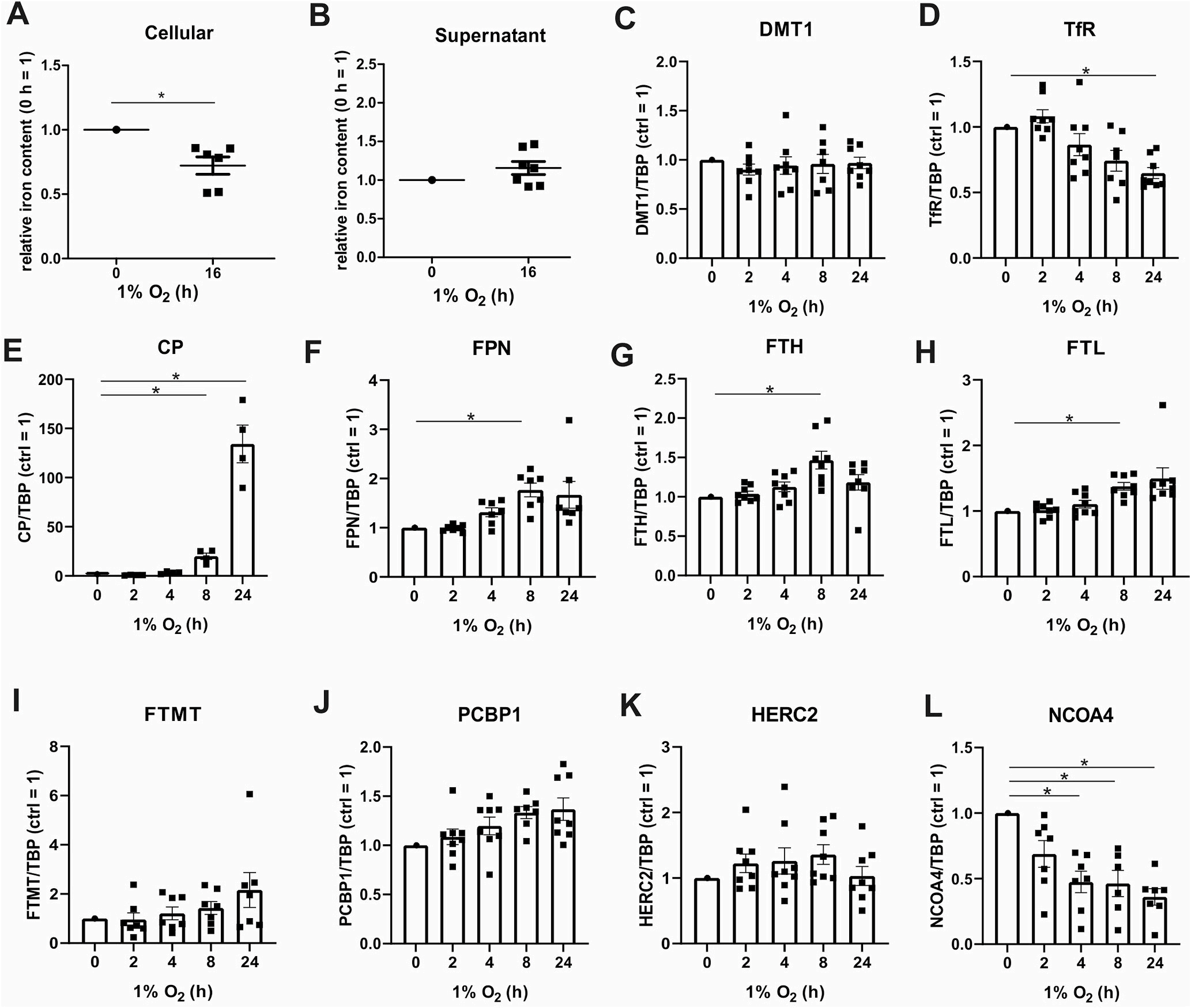
测定人巨噬细胞和细胞上清液中的铁含量(图1A和B)。在缺氧16h后,细胞内铁下降,而上清液中的铁略有上升。结果显示巨噬细胞在缺氧条件下获得铁输出表型。这与膜铁转运蛋白(FPN)是HIF-2的靶基因的研究一致。二价金属转运体1 (DMT1)和转铁蛋白受体(TfR)参与铁的输入。虽然DMT1 mRNA表达保持不变, TfR mRNA从缺氧4 h时开始减少 (图1 C和D)。基因结果显示铁转出,从低氧处理8 h开始,血浆铜蓝蛋白(CP)和FPN显著增加(图1 E和F)。研究显示低氧条件下细胞内的铁减少。检测与铁储存相关的基因,发现从低氧8 h开始,铁蛋白重链(FTH)和轻链(FTL) mRNA的表达增加(图1G和H)。线粒体铁蛋白(FTMT)的mRNA并不受缺氧影响,说明HIF不可能直接调控人巨噬细胞中的FTMT (图1I)。NCOA4和PCBP1对于从储存蛋白中释放铁是至关重要的。PCBP1,HERC2的mRNA 的表达量在缺氧下没有改变。NCOA4的mRNA表达在缺氧4小时后达到显著水平(图1L)。NCOA4可引导铁蛋白进入自噬溶酶体。NCOA4 mRNA的减少可能提示了铁自噬与缺氧之间的联系。
2.缺氧条件下,铁自噬减少
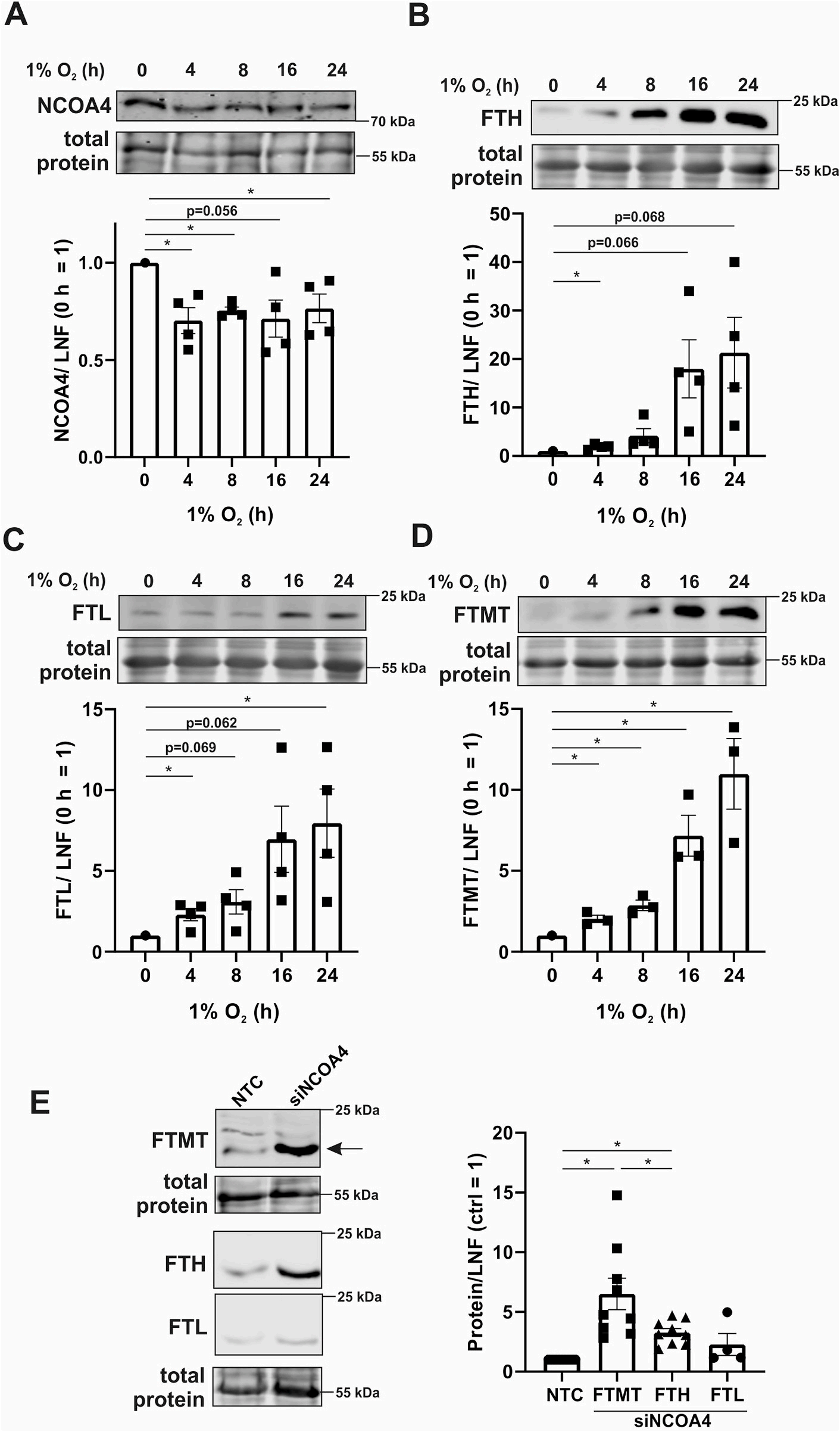
Western分析NCOA4的表达,探究缺氧状态下铁自噬是否受限(图2A)。与mRNA结果一致,NCOA4蛋白在缺氧4小时时显著下降。以往研究表明NCOA4被自噬相关蛋白(ATG)激活,引导FTH和FTL到自噬小体。低表达NCOA4应能增强低氧下的铁蛋白丰度。因此,我们分析了FTH、FTL和FTMT在蛋白质水平(图2B-D)。缺氧4 h后, 所有铁蛋白亚型显著增加, 16-24 h后,增加更明显。抑制NCOA4可以显著提高FTH和FTMT蛋白的表达(图2E),而FTL并不显著。铁输出增加与铁蛋白稳定输入减少可能表明在低氧条件下,巨噬细胞利用这一机制减少细胞内不稳定的铁储存,以减少氧化还原应激。
3. NCOA4的调节依赖JNK
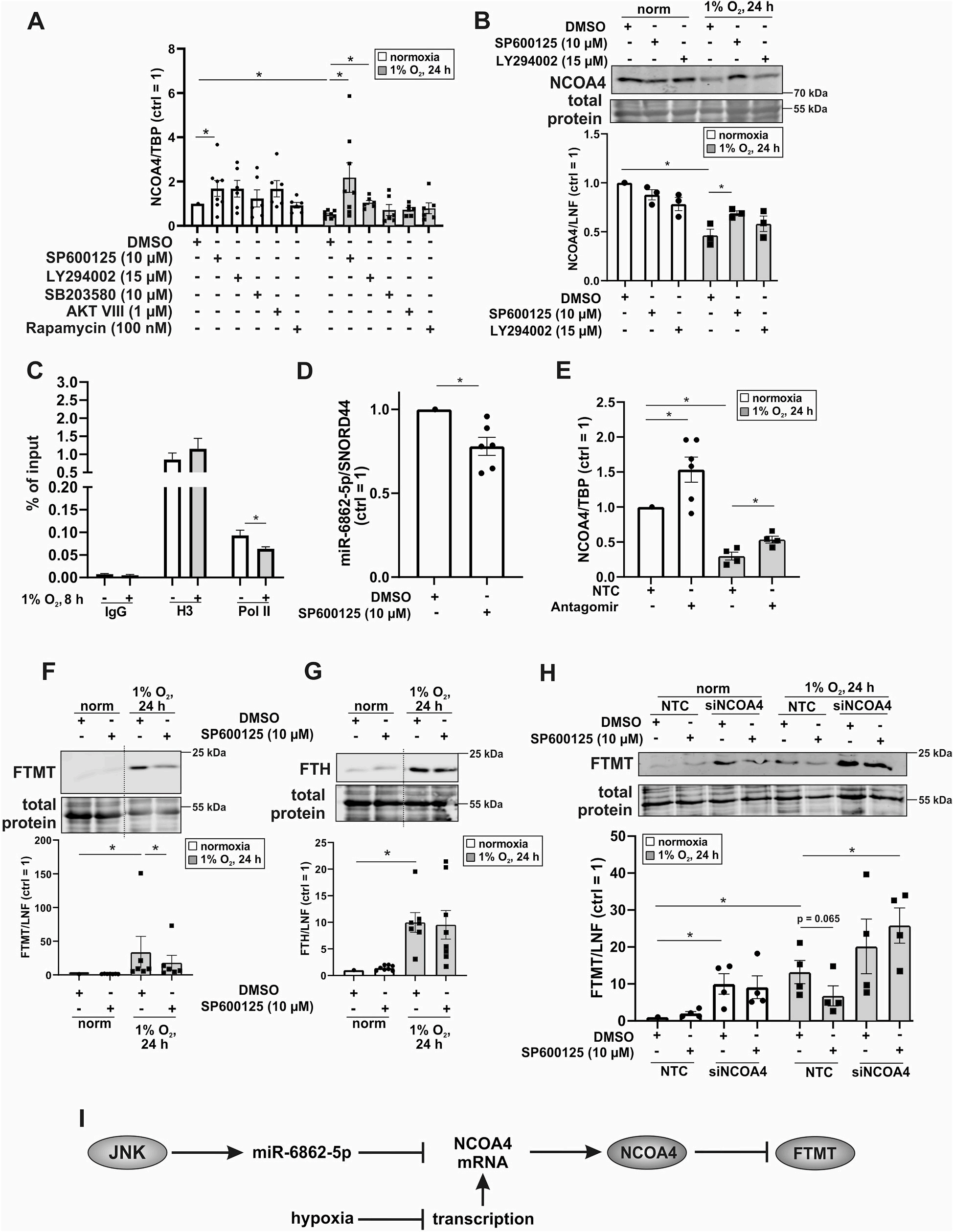
SP600125抑制JNK,LY294002抑制PI3K,SB203580抑制p38MAPK, AKT VIII抑制AKT,使用雷帕霉素抑制mTOR,并在常氧和缺氧条件下测定NCOA4 mRNA的表达(图3A)。NCOA4 mRNA在缺氧状态下降低,只有SP600125和LY294002挽救了这种降低。常氧条件下,SP600125对JNK的抑制也增加了NCOA4 mRNA,说明JNK对NCOA4的负调控作用。然后在蛋白水平上验证了这些发现(图3B)。
4. NCOA4 mRNA是miR-6862-5p的一个靶点
JNK已知可以增加靶基因的转录,JNK也可能增强了miR的表达。NCOA4是miR-6862-5p的候选靶标。阻断JNK显著减少了miR-682-5p的数量(图3D)。在常氧和缺氧条件下,拮抗miR-6862-5p可显著增加NCOA4 mRNA的表达(图3E)。为了评估miRNA拮抗剂的有效性,我们测量了miR-6862-5p及其预测靶点THBD的表达。在常氧状态下,miRNA拮抗剂显著降低miR-6862-5p的表达,同时THBD mRNA的含量增加。由于THBD对缺氧有反应,miRNA拮抗剂在低氧条件下是无效的。研究证实JNK是miR-6862-5p的调控因子,并验证了NCOA4和THBD是miR-6862-5p在人巨噬细胞中的新靶点。
5. 低氧状态下,NCOA4的稳定降低了FTMT的表达,而不降低FTH的表达
文章分析低氧条件下SP600125处理巨噬细胞FTMT和FTH的表达(图3F和G)。这些抑制剂对常氧条件下FTMT和FTH的表达没有影响。阻断JNK后,低氧下FTMT的增加被逆转。缺氧时FTH也增加,但SP600125无法干预。即在缺氧条件下,只有FTMT受NCOA4的调控。
siRNA在抑制JNK活性的同时抑制NCOA4。然而,在常氧条件下,SP600125对FTMT的表达没有影响,而NCOA4的敲低则使FTMT蛋白表达增加到缺氧条件下的水平(图3H)。
NCOA4 mRNA在缺氧状态下的快速下降表现为miR-6862-5p对mRNA的持续降解和低氧转录减弱的共同作用。由于低氧条件下NCOA4的减少,铁自噬减少,FTMT随之增加(图3I)。
6. RSL-3增加FTMT和FTH
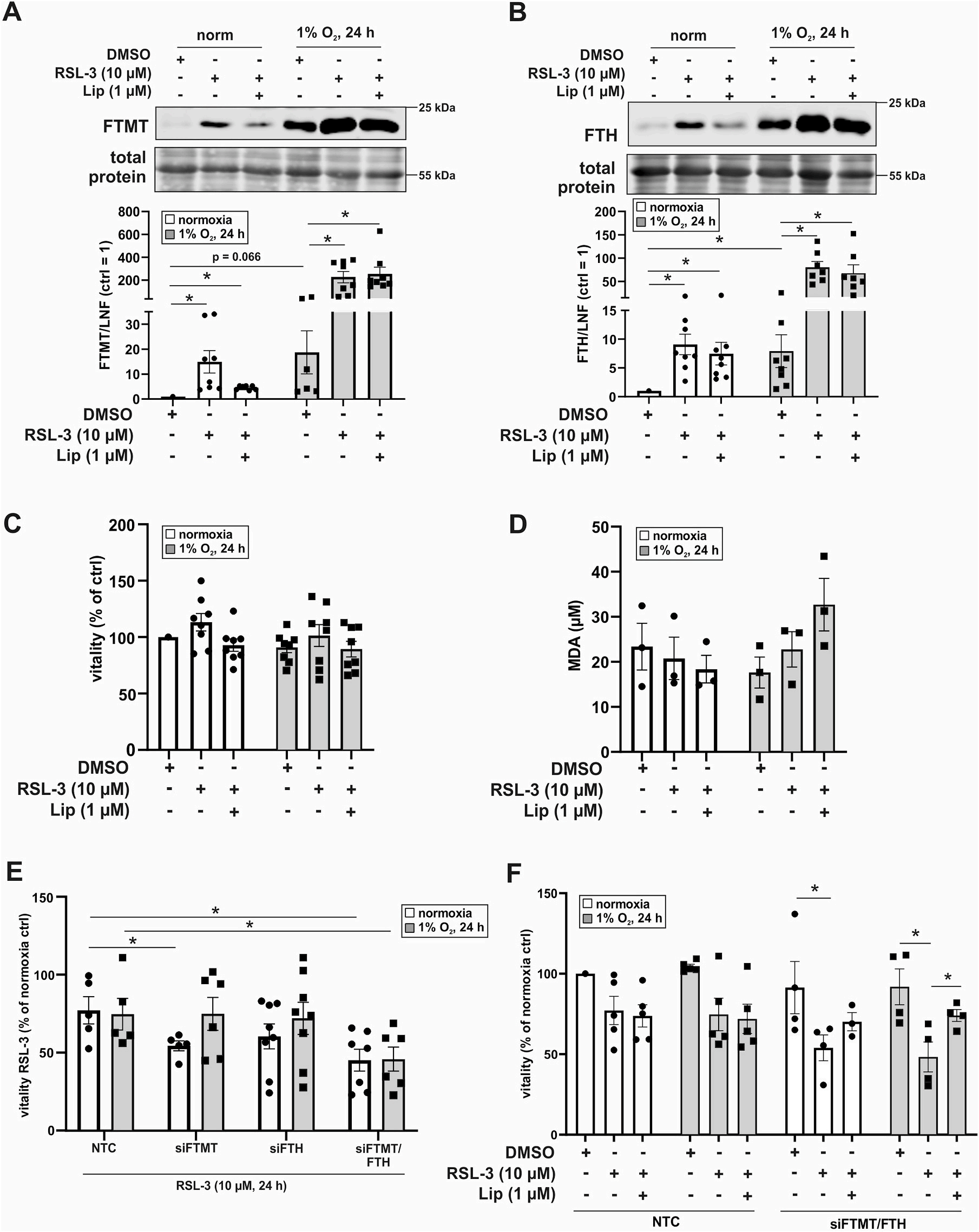
文章中用GPX4抑制剂和铁死亡诱导剂RSL-3处理巨噬细胞后,测定FTMT和FTH的表达(图4A和B)。RSL-3结合Lip,以防止脂质过氧化,从而抑制铁死亡。在没有或存在Lip的情况下,用RSL-3处理细胞(图4C)。在常氧和缺氧条件下,存活率均无明显变化。丙二醛(MDA)没有改变(图4D)。RSL-3在常氧条件下诱导巨噬细胞的FTH和FTMT,在缺氧条件下甚至更强,但在这些细胞中没有启动铁死亡。这说明了FTMT和FTH可能保护巨噬细胞免受铁死亡。
7. FTMT和FTH对缺氧状态下的铁死亡有干扰作用
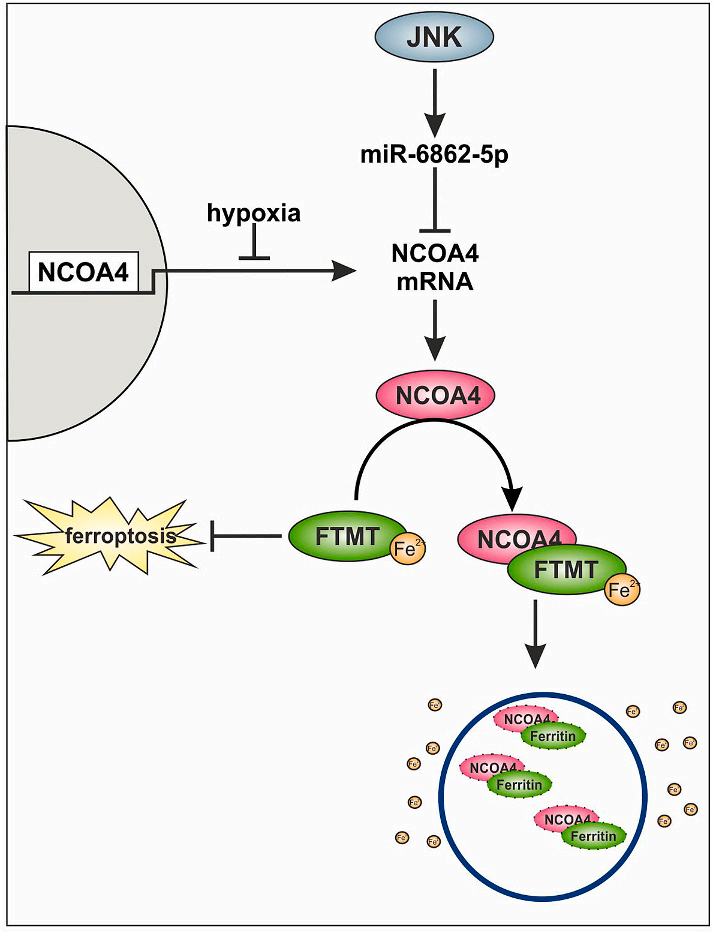
RSL-3只有在siFTMT或siFTMT/FTH时降低常氧状态下的细胞存活率 (图4E)。在缺氧条件下,抑制FTMT使RSL-3不能降低细胞存活率。为了研究siFTH/FTMT细胞的存活率是通过铁死亡发生的,Lip用于挽救巨噬细胞的死亡(图4F)。在低氧条件下,RSL-3处理的siFTMT/FTH细胞存活率的降低可被Lip逆转。数据表明,在缺氧条件下,两种铁蛋白都具有保护作用,这与RSL-3处理后FTMT和FTH的显著诱导一致(图4A和B)。在巨噬细胞中,JNK作用于miR-6862-5p来降解NCOA4 mRNA。同时考虑到缺氧会降低NCOA4 mRNA的转录,这些联合作用会降低NCOA4的蛋白量(图5)。
8. 肿瘤细胞NCOA4高表达而FTMT低表达
如图6A,HT1080细胞缺氧可诱导FTMT。HT1080细胞中FTH的基础表达高于巨噬细胞,但对缺氧的反应较弱。HT1080细胞常氧状态下NCOA4水平较高,但在缺氧状态下NCOA4没有下调。在HT1080细胞中siRNA NCOA4,使FTMT和FTH增加,表明这两种蛋白受到NCOA4的调控(图6B和C)。
9. 缺氧保护肿瘤细胞免受RSL-3诱导铁死亡
在形态上,RSL-3处理的细胞从成纤维变成圆形,Lip抑制这种作用。在低氧HT1080细胞中,FTH的表达显著增加,而FTMT的表达不受RSL-3或Liproxstatin-1的影响(图6D和E)。常氧和低氧HT1080细胞存活率没有显著差异(图6F)。RSL-3降低了HT1080大约50%的生存能力,这可以由Lip完全补偿。在缺氧条件下,RSL-3效率较低,仅降低了约25%的细胞存活率,这是由于铁死亡。siRNA FTH并在缺氧条件下孵育24小时(图6G)。FTH对HT1080细胞存活至关重要。暗示FTH的降低可能会增加游离铁,引发铁化学相关的脂质死亡 (图6H)。
在巨噬细胞中,缺氧降低了NCOA4,从而增加了FTMT和FTH的水平(图6I)。

总结:
缺氧条件下铁自噬减少;JNK对NCOA4负调控,且NCOA4是miR-6862-5p的其中一个靶点;缺氧保护肿瘤细胞免受铁死亡诱导剂的影响;研究为阐明缺氧和铁死亡的关系提供借鉴意义。






