母乳中S100A8-A9促进肠道微生态平衡和免疫系统的出生后发育
母乳会影响婴幼儿肠道菌群的组成,也有助于增强婴幼儿的免疫系统。但是具体的机制尚不清楚。德国汉诺威医学院(Hannover Medical School)临床小儿呼吸科、过敏科和新生儿科 Dorothee Viemann博士发表在美国胃肠病学会(AGA)期刊Gastroenterology(IF=17.373)上的文章,发现母乳中存在大量的S100A8和S100A9形成异源二聚体复合物(S100A8-A9)并揭示母乳中的S100A8-A9在婴幼儿肠道微生态和免疫调节中的作用。

技术路线图:

研究结果:
1.健康婴儿肠道中S100A8-A9含量丰富
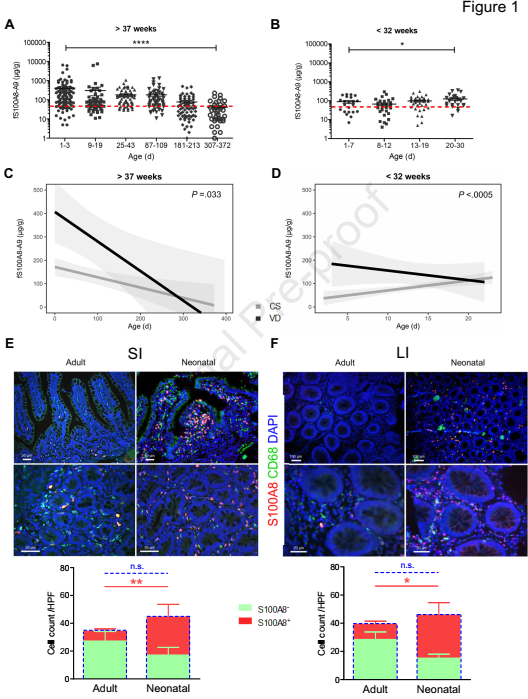
从72名健康足月儿和49名早产儿出生队列中收集了517份粪便样本,分析S100A8-A9水平。在足月婴儿中,S100A8-A9水平在出生后的头三个月明显高于正常成人值,并在断奶后恢复正常,直到一岁结束(图1A)。早产儿中S100A8-A9水平明显低,但在出生后的第一个月增加(图1B)。阴道分娩(VD)后的S100A8-A9水平高于剖宫产(CS)(图1C和D),母乳是新生儿S100A8-A9的一个重要来源。为了研究S100A8-A9是否也内源性产生于新生儿肠道,研究选择新生儿和无潜在炎症性肠炎(IBD)成人的小肠(SI)和大肠(LI)组织样本。LPMPs(固有层巨噬细胞)中可以检测到S100蛋白的表达,但在肠上皮细胞中则没有,新生婴儿SI(图1E)和LI(图1F)中表达S100A8的LPMPs比例明显高于成人。
2.在婴儿期,高S100A8-A9有利于肠道生态平衡
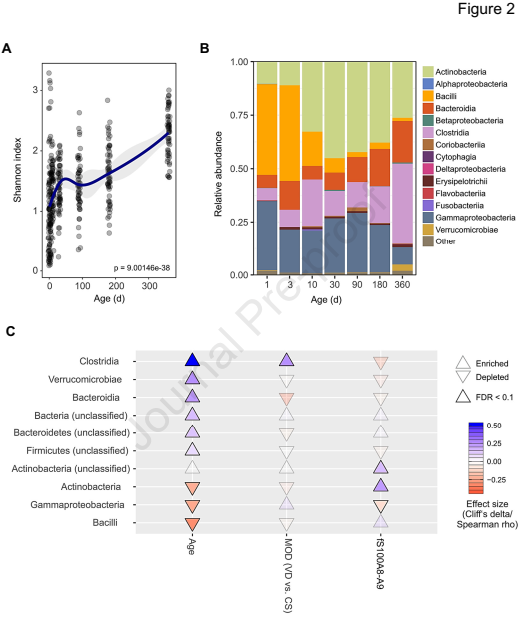
为了评估新生儿生理上的高S100A8-A9是否与肠道微生物群的发育有关,我们从足月婴儿(30-1年)队列中提取了414份粪便样本,生成了16S rRNA基因图谱。
肠道菌群组成的整体多样性在生命的第一年显著增加(图2A),最显著的是放线菌、拟杆菌和梭状芽胞杆菌的增加,γ-变形菌纲和肠杆菌的减少(图2B)。在整个婴儿期(30天到1年) 高水平的S100A8-A9与放线菌丰度正相关,和γ-变形菌纲丰度负相关(图2 c)。数据表明,S100蛋白与肠道菌群组成有关,导致肠道代谢功能向有利方向转换。
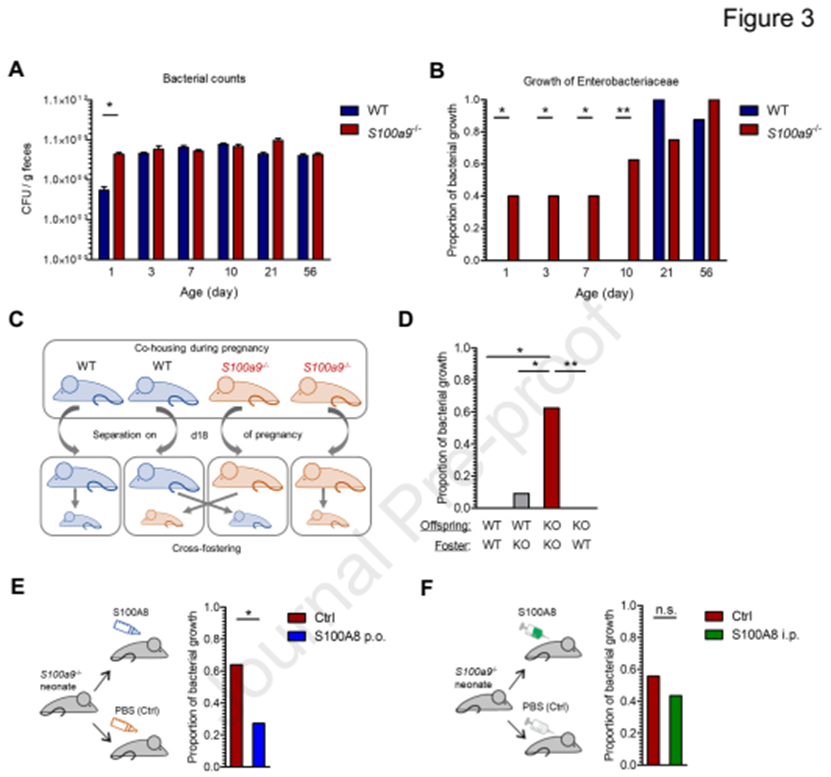
为了进一步了解机制,WT和S100a9-/-小鼠进行实验。在WT和S100a9-/-子代中,粪便细菌数量没有显著差异(图3A)。然而, S100a9-/-子代从第1天就可以检测到肠杆菌科(主要是大肠杆菌)的可培养数量,但野生型小鼠在21天才观察到(图3B)。在交叉培养环境中, S100a9 -/-新生儿通过WT母鼠饲养,能限制肠杆菌的生长,而在S100a9 - / -母鼠养育WT新生儿, 肠道杆菌科的可培养数量在第10天就可追踪(图3 C和D)。结果表明,母乳来源的S100A8-A9能限制肠杆菌科的生长。
3.S100蛋白调节LPMPs
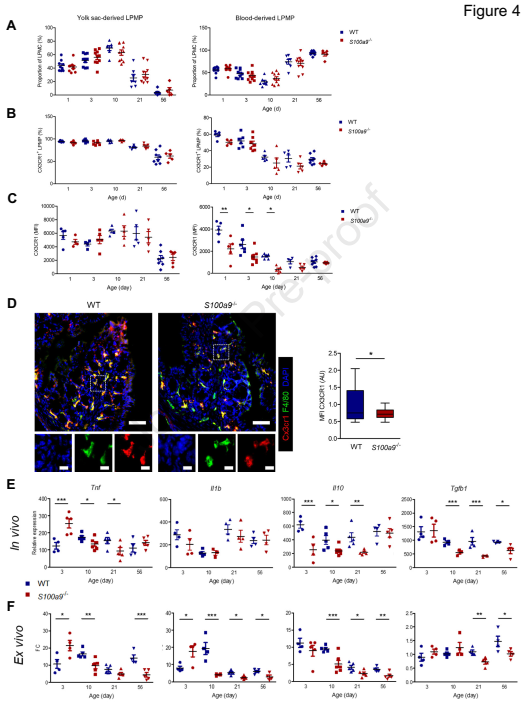
CX3CR1、IL-10、TGF-β1及Tregs是控制肠道菌群组成的重要因素,在卵黄囊和血液来源的LPMP中,LPMP比例,趋化因子受体1 (CX3CR1)阳性LPMPs的比例没有改变(图4A和B)。S100a9-/- BD-LPMPs中,CX3CR1的平均表达量明显低于WT BD-LPMPs (图4C和D)。在S100a9-/- LPMPs中,TNF在第3天显著高于WT LPMPs,但在第10天和第21天低于WT LPMPs, IL-1β的表达相似。通过体外LPS刺激研究LPS的微生物反应性(图4F)。与WT LPMPs相比,S100a9-/- LPMPs在第3天显著增强了TNF和IL-1β的表达,而在第10天开始转变为对这些促炎基因的诱导能力显著降低。在出生后的前几天,极高水平的S100A8-A9明显耐受LPS的LPMP反应,而随着年龄的增加,基础水平的S100A8-A9降低,其对诱导作用的功能放大。说明S100A8-A9对LPMPs的调控表型具有重要影响。
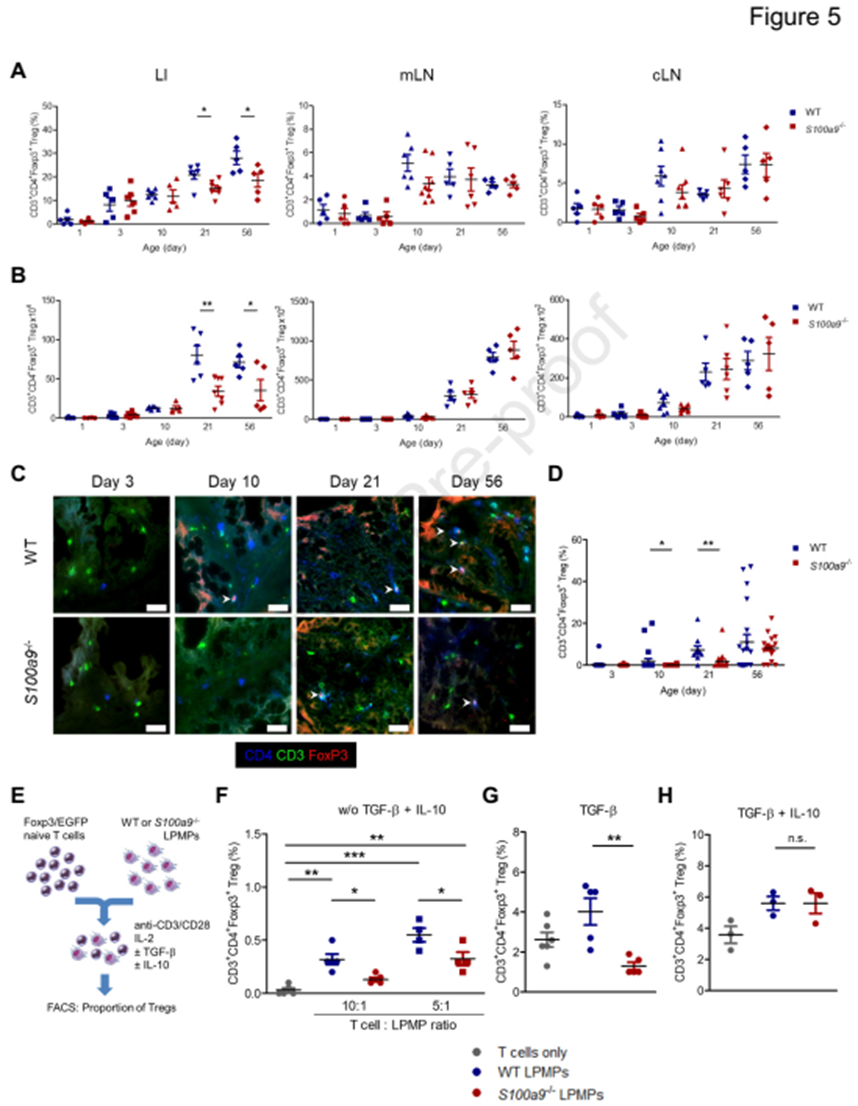
4. S100有助于调节 LPMPs促进Tregs
CX3CR1, IL- 10和TGF-β被确认为是Tregs增加的重要诱因。结果显示,在WT和S100a9-/-小鼠中,固有层的Treg在mLNs(肠系膜淋巴结)和cLNs(腹腔淋巴结)中的比例是相当的。然而,与WT小鼠相比, S100a9-/-小鼠结肠中随后的Tregs扩展明显受损(图5A-D)。在共培养条件下,WT LPMPs诱导Tregs的能力明显优于S100a9-/- LPMPs (图5 E和F)。补充TGF, S100a9-/- LPMPs中Tregs仍然较低(图5G)。然而,IL--10的补充弥补了S100a9-/- LPMPs缺乏的Tregs诱导能力(图3H)。这些发现表明S100A8-A9诱导的LPMP表型促进了出生后结肠黏膜中Tregs的发育,特别是通过提供IL--10。
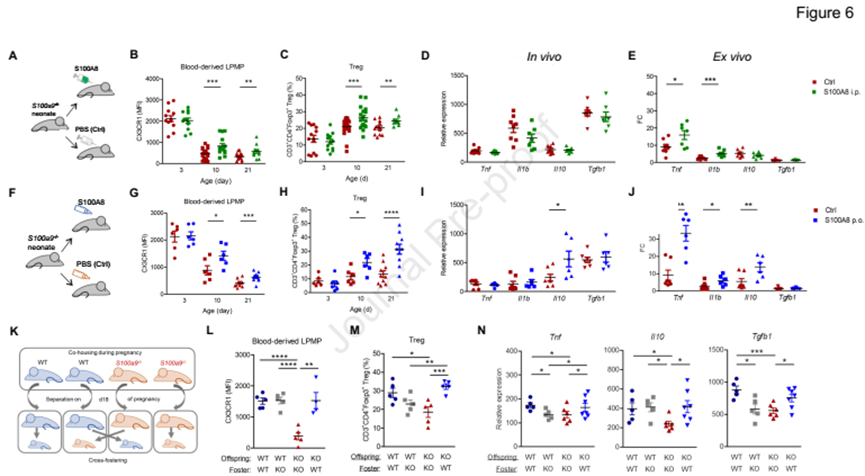
5. S100对新生儿肠道免疫的研究
从第十天开始,我们观察到S100A8补充后LPMPs中, CX3CR1水平更高 (图6 B和G)。Tregs的扩张效果明显更好,特别是通过肠内途径 (图6 C和H)。i.p.给予S100A8,对IL-10和TGF-β1的基础表达没有影响(图6D),只提高了LPS诱导TNF和IL-1β的能力(图6E)。然而,产后一次性喂养S100A8显著提高了IL-10的基础表达水平(图6I),并增强了所有LPS诱导基因,即TNF、IL-1β和IL-10的响应性(图6J)。
交叉培养实验(图6K-N)证实了肠内供应S100的重要性。综上所述,这些发现表明围产期肠内S100A8的供应调节了LPMPs的炎症反应,从而促进了出生后肠道中Tregs的发育
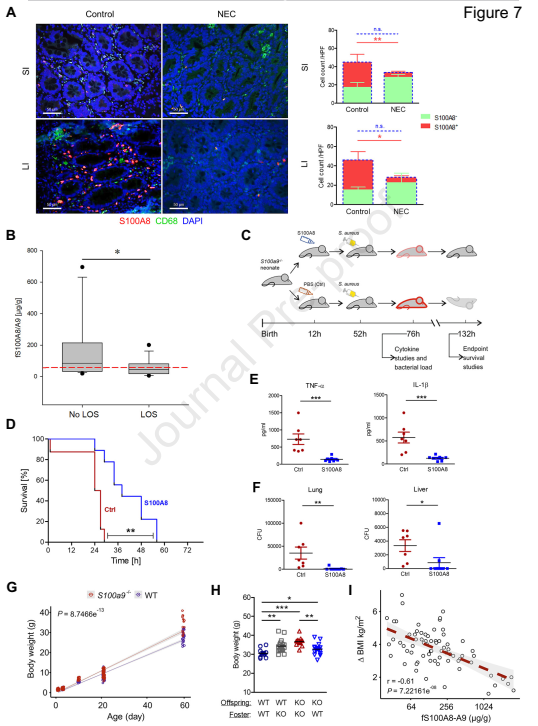
6. 婴儿期高S100A8-A9可预防肠道失调相关疾病
肠道失调伴随着肠道菌群的早期积累,会发生早产儿NEC(新生儿坏死性小肠结肠炎). NEC患者的禁食治疗会导致肠内S100A8-A9供应不足,以及内源性S100A8-A9产生减少,提示S100-alarmins可预防NEC。另一种与肠道失调有关的早期疾病是新生儿晚发败血症(LOS)。在早产儿队列中,LOS的S100A8-A9水平明显低于没有晚期脓毒症婴儿中的相应水平 (图7B)。在一个金黄色葡萄球菌诱导的小鼠感染模型中,S100A8预防新生儿败血症 (图7C)。S100A8显著降低了S100a9-/-新生儿晚期脓毒症的死亡率(图7D),同时有效抑制了细胞因子反应(图7E)和细菌负担(图7F)。在敲除S100的小鼠中,第8周大时比野生小鼠重21%。从出生到2岁的BMI与新生儿S100A8-A9平均水平存在反向关系 (图7I)。
总结:
1.S100A8-A9可作为母乳中的警报器,并且会进入婴幼儿的肠道
2.S100蛋白与肠道菌群有关,促进肠道内微生态平衡
3.S100蛋白改变固有层巨噬细胞的表型,增加Tregs细胞,促进肠道免疫。
4.S100蛋白能够改善肠道菌群失调相关疾病,如新生儿坏死性小肠结肠炎,新生儿晚发败血症,肥胖等。
S100A8-A9在临床上对新生儿肠道免疫适应具有高度调节作用,并提示S100是一种有价值的免疫调节措施,可预防与异常相关的疾病的发生






