lncRNA-ZNF649-AS1诱导曲妥珠单抗耐药
lncRNAs在曲妥珠单抗耐药中的调控机制至今尚未建立。今天小编为大家带来发表于影响因子为8.986的“Molecular Therapy”上的文章“lncRNA ZNF649-AS1 Induces Trastuzumab Resistance by Promoting ATG5 Expression and Autophagy”,为大家详细介绍lncRNA ZNF649-AS1在曲妥珠单抗耐药中调控的机制。

我们的结果显示,与敏感细胞相比,ZNF649-AS1在曲妥珠单抗耐药细胞中表达更高。ZNF649-AS1的表达增加与乳腺癌患者的不良反应和较短的生存时间有关。在曲妥珠单抗处理下,H3K27ac修饰上调了ZNF649-AS1,敲除ZNF649-AS1通过调节ATG5表达和自噬逆转曲妥珠单抗的耐药性。机制上,ZNF649-AS1与PTBP1蛋白相关,进一步促进了ATG5基因的转录活性。
技术路线:

结果:
1.lncRNA ZNF649-AS1在曲妥珠单抗耐药乳腺癌细胞中上调
为了确定与曲妥珠单抗耐药密切相关的lncRNAs,我们使用已建立的曲妥珠单抗耐药细胞进行HiSeq测序。分散图和火山图用于评估抗曲妥珠单抗治疗的SKBR-3细胞(SKBR-3-TR细胞)和SKBR-3细胞(图1A和1B)之间基因表达的变化。总共有639个lncRNAs被鉴定为显著差异表达(图1C)。为了确定最有前景的lncRNAs,我们将分析重点放在前20个上调和20个下调的lncRNAs上,如图1D中的热图所示。我们从上调最多的组中选择了三个候选的lncRNAs,从下调最严重的组中选择了两个。我们检测了30例HER2+患者配对乳腺癌组织和癌旁非肿瘤组织中所选基因的表达。ZNF649-AS1是上调幅度最大的lnRNA(图1E)。此外,与亲代细胞相比,抗曲妥珠单抗治疗的SKBR-3-TR细胞和BT474细胞(B7474-TR细胞)中的ZNF649AS1显著上调(图1F)。
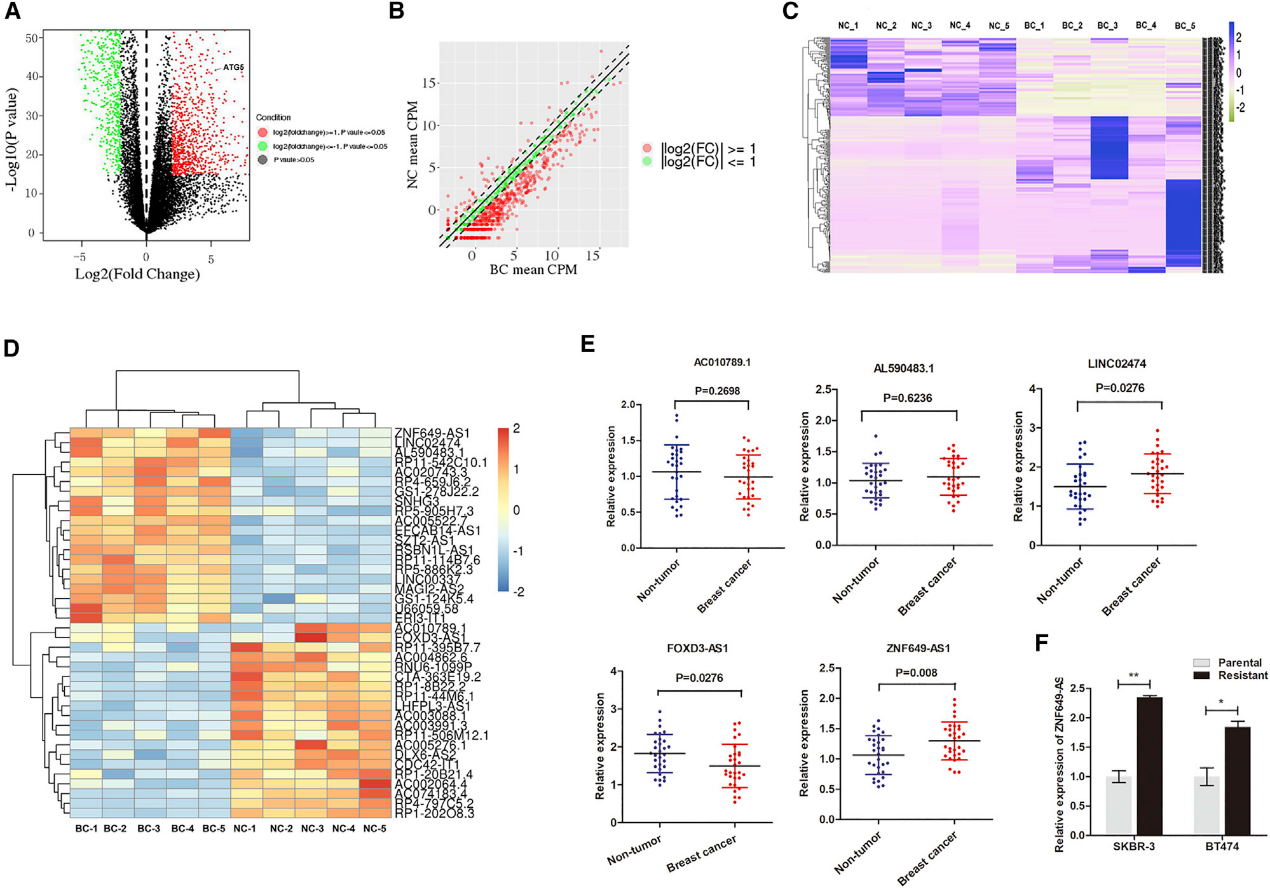
2.lncRNA-ZNF649-AS1与曲妥珠单抗治疗的不良反应相关
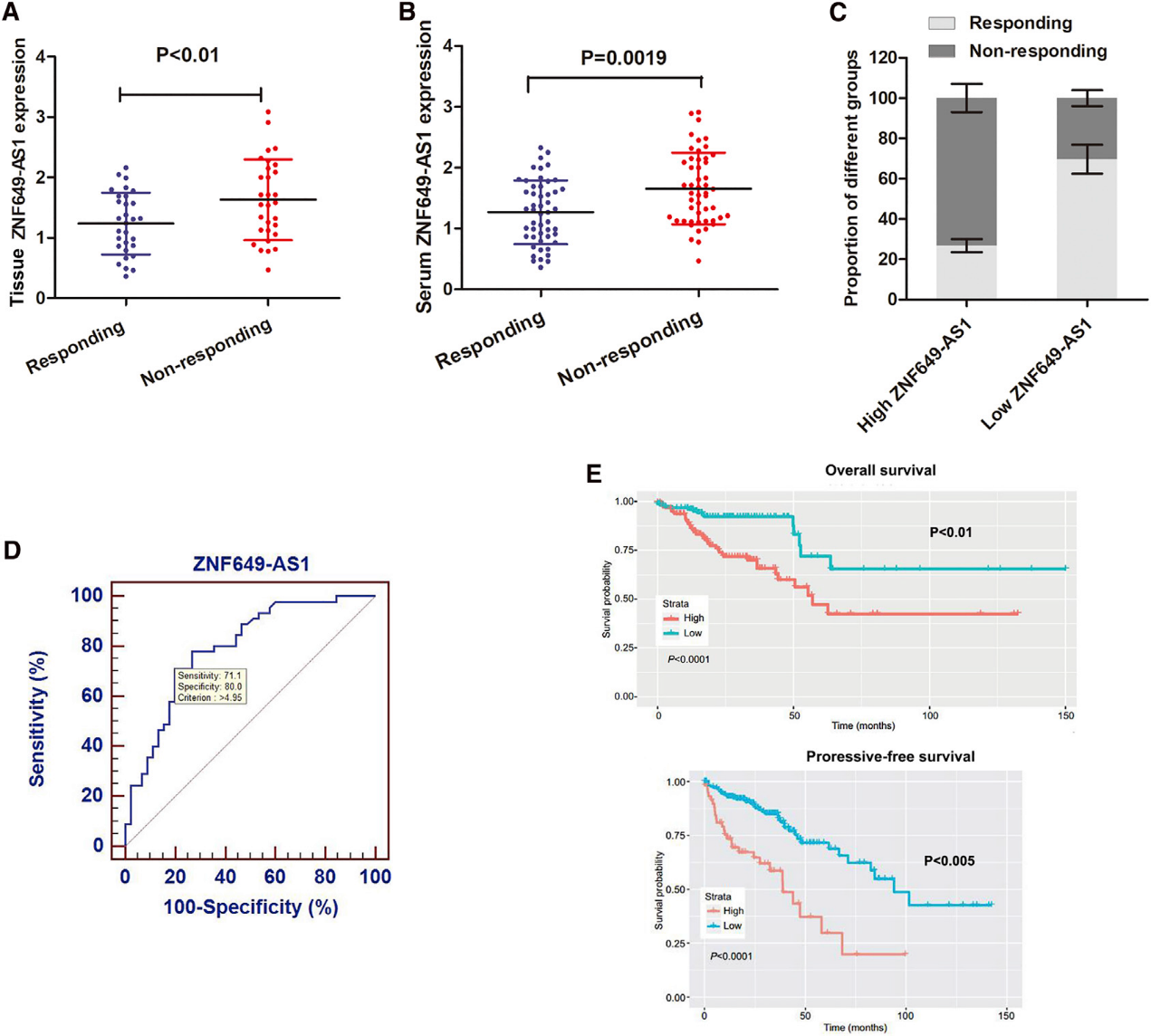
为了验证ZNF649-AS1是否与曲妥珠单抗治疗相关,我们检测了60例接受曲妥珠单抗治疗的乳腺癌组织中ZNF649-AS1的表达。如图2A所示,与有反应的患者相比,无反应患者的ZNF649-AS1上调。接着,90份接受曲妥珠单抗治疗的患者的血清样本被用来检测ZNF649-AS1的表达。与有反应的患者相比,ZNF649-AS1在无反应患者中显著上调(图2B)。此外,ROC曲线显示ZNF649-AS1表达具有较高的诊断价值(图2C)。通过将患者分为高或低ZNF649-AS1表达组,使用从ROC曲线获得的分层标准,我们发现高ZNF649-AS1表达组对曲妥珠单抗治疗反应的患者比例远低于ZNF649-AS1低表达组(图2D)。更重要的是,Kaplan-Meier生存分析表明,高表达的ZNF649-AS1与整体生存率和无进展生存率相关(图2E)。
3.曲妥珠单抗通过诱导H3K27乙酰化增加ZNF649-AS1的表达
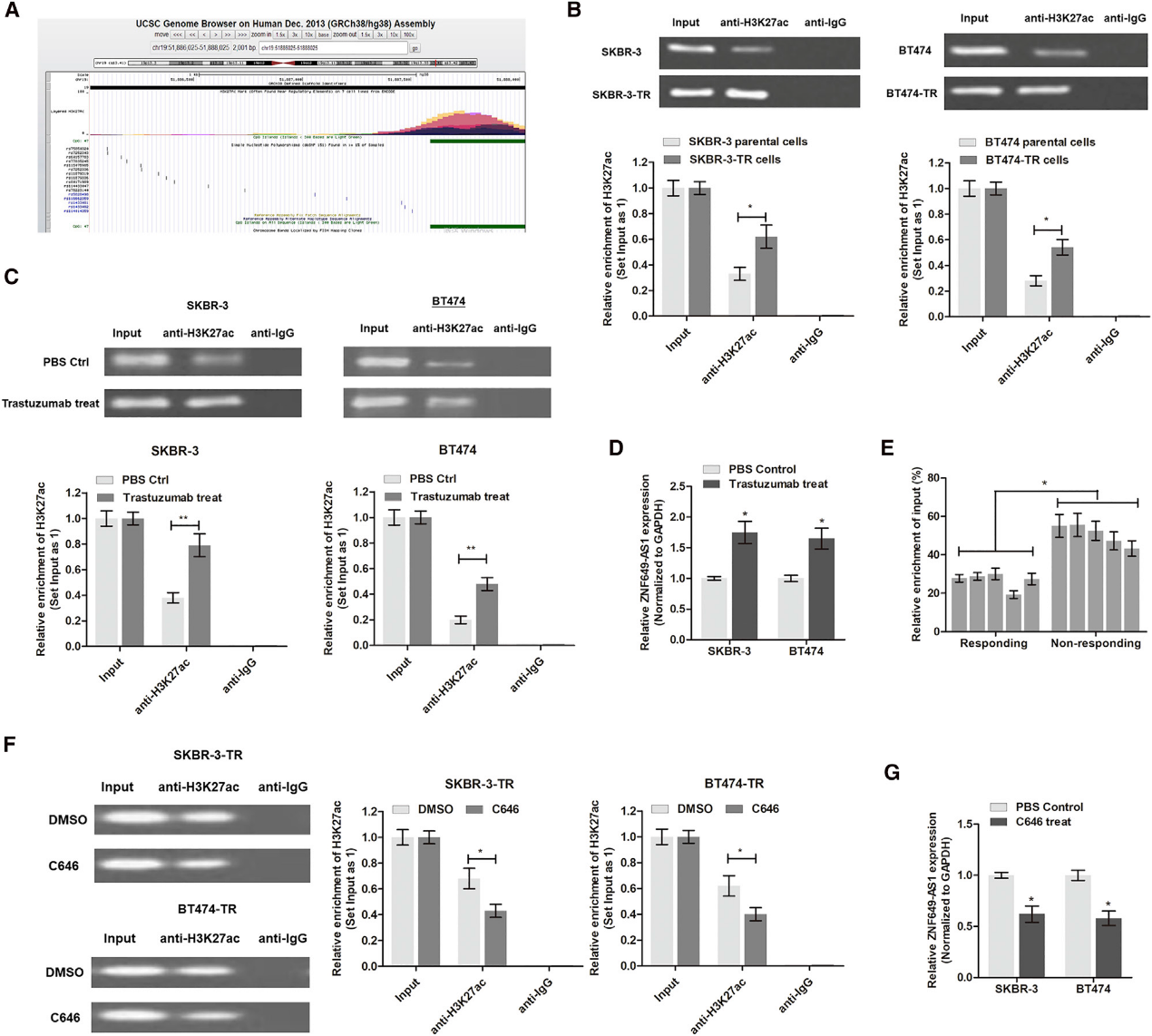
接下来,我们研究了曲妥珠单抗耐药细胞中ZNF649-AS1上调的潜在机制。通过分析转录修改区域,我们发现在7个细胞系中,在ZNF649-AS1启动子区上游有一个富集的H3K27ac结合区(图3A)。然后我们使用抗H3K27ac抗体进行染色质免疫沉淀(ChIP)分析,发现H3K27ac在ZNF649-AS1启动子区富集。此外,与亲代细胞相比,SKBR-3-TR和BT474-TR细胞中H3K27ac的富集水平显著提高(图3B)。为了进一步证实曲妥珠单抗治疗的效果,我们用曲妥珠单抗处理SKBR-3和BT474细胞48小时。如图3C和3D所示,与对照细胞相比,曲妥珠单抗处理细胞中H3K27ac富集和ZNF649-AS1水平增加。与化疗敏感患者相比,曲妥珠单抗耐药患者乳腺癌组织中H3K27ac富集也增加(图3E)。然后我们用C646(一种著名的乙酰转移酶抑制剂)处理细胞,发现H3K27ac富集和ZNF649-AS1表达被显著抑制(图3F和3G)。总的来说,我们的结果表明曲妥珠单抗处理通过诱导启动子区域H3K27ac富集来增加ZNF649-AS1的水平。
4.沉默lncRNA-ZNF649-AS1逆转乳腺癌细胞曲妥珠单抗耐药性
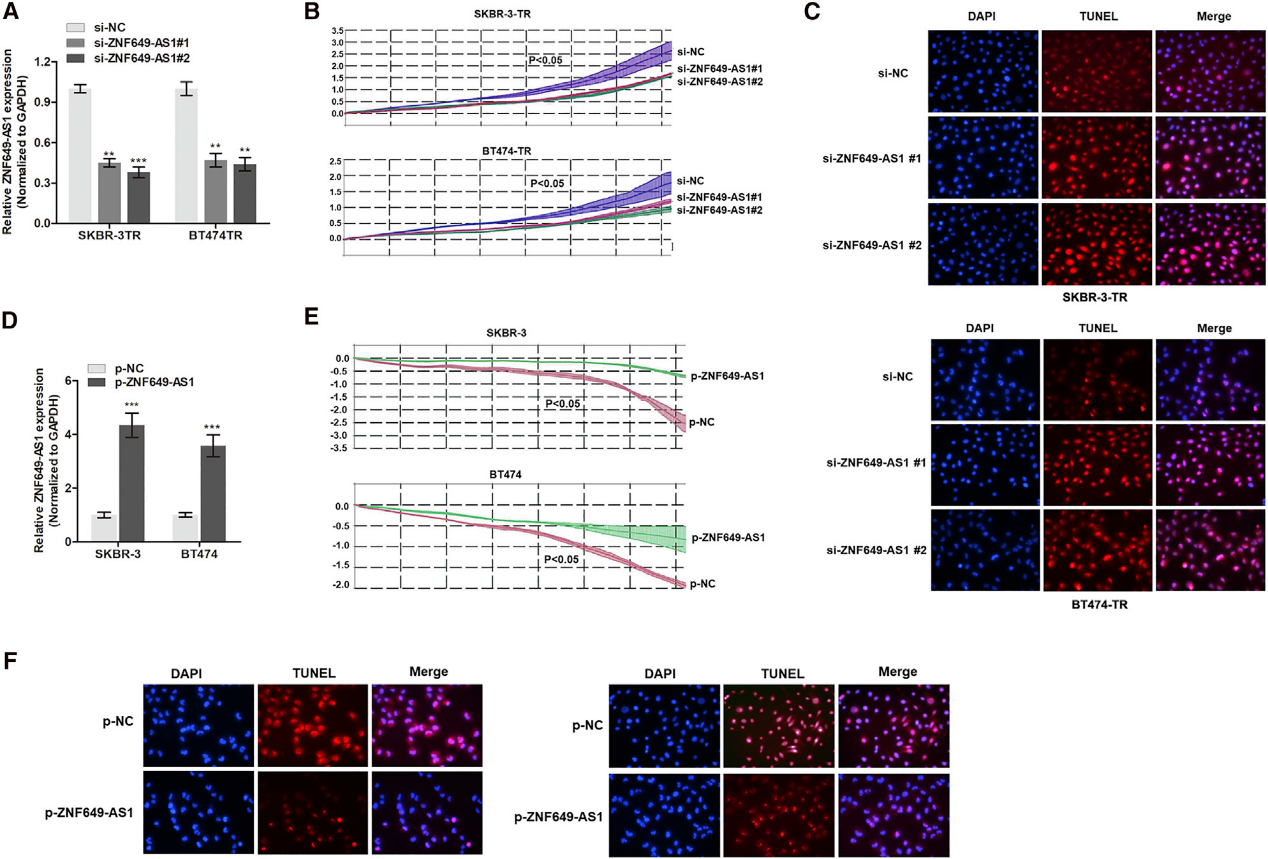
为了确定ZNF649-AS1在曲妥珠单抗耐药中的作用,我们使用特异性抑制剂沉默了ZNF649-AS1的表达。如图4A所示,我们观察到转染siRNA的细胞中ZNF649-AS1的表达显著降低。实时细胞分析(RTCA)显示,ZNF649-AS1的敲除显著抑制曲妥珠单抗治疗后的细胞活性(图4B)。此后,我们评估了它在细胞凋亡中的作用。TUNEL试验结果显示,ZNF649-AS1敲除后细胞凋亡增加(图4C)。接下来,我们研究了ZNF649-AS1过表达对SKBR-3和BT474亲本细胞抗曲妥珠单抗抗性的影响。如图4D所示,转染ZNF649-AS1质粒后,ZNF649-AS1在这些细胞中过表达。通过使用曲妥珠单抗处理SKBR-3和BT474细胞,我们发现与对照组相比,ZNF649-AS1诱导的对曲妥珠单抗的抗性增强(图4E)。此外,ZNF649-AS1可抑制SKBR-3和BT474细胞的凋亡(图4F)。
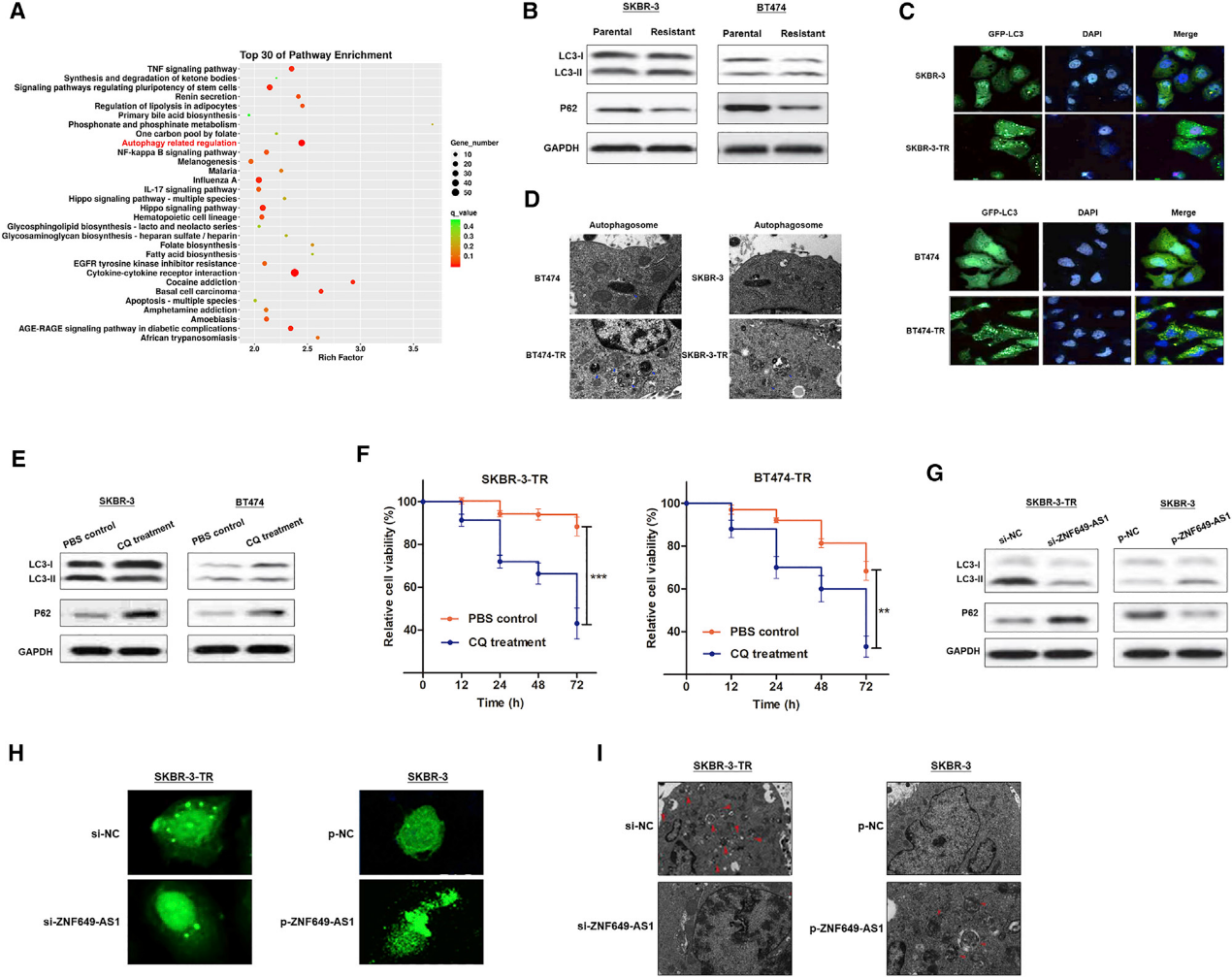
5.lncRNA ZNF649-AS1对曲妥珠单抗诱导的自噬是必需的
通过GO分析,我们假设自噬可能参与了ZNF649-AS1的功能(图5A)。为了验证这一假设,我们测量了自噬标记物的LC3和p62水平。值得注意的是,曲妥珠单抗耐药细胞比相应的亲代细胞显示出更高的LC3-II和更低的p62蛋白水平,这表明当发生化疗耐药时,自噬通量被诱导(图5B)。曲妥珠单抗耐药细胞显示出LC3斑点(图5C)和自噬体(图5D)的形成增加。为了验证自噬是否对曲妥珠单抗耐药至关重要,我们用氯喹(CQ)处理曲妥珠单抗耐药细胞。结果表明,CQ处理抑制了自噬,并逆转了化疗耐药状态(图5E和5F)。
接下来,我们研究了ZNF649-AS1在自噬活性中的作用。ZNF649-AS1基因敲除导致SKBR-3-TR中LC3-II水平降低,p62水平增强。相反,在ZNF649-AS1过表达的细胞中,LC3-II水平增加,而p62水平降低(图5G)。沉默SKBR-3-TR细胞中的ZNF649-AS1减少了LC3斑点的数量并阻止了自噬体的形成,而ZNF649-AS1的过表达导致SKBR-3细胞中LC3斑点和自噬体的数量增加(图5H和5I)。综上所述,我们的结果表明曲妥珠单抗耐药诱导自噬活性增强,而抑制ZNF649-AS1可以逆转自噬,从而诱导化疗敏感性。
6.ZNF649-AS1通过上调ATG5诱导曲妥珠单抗耐药和自噬
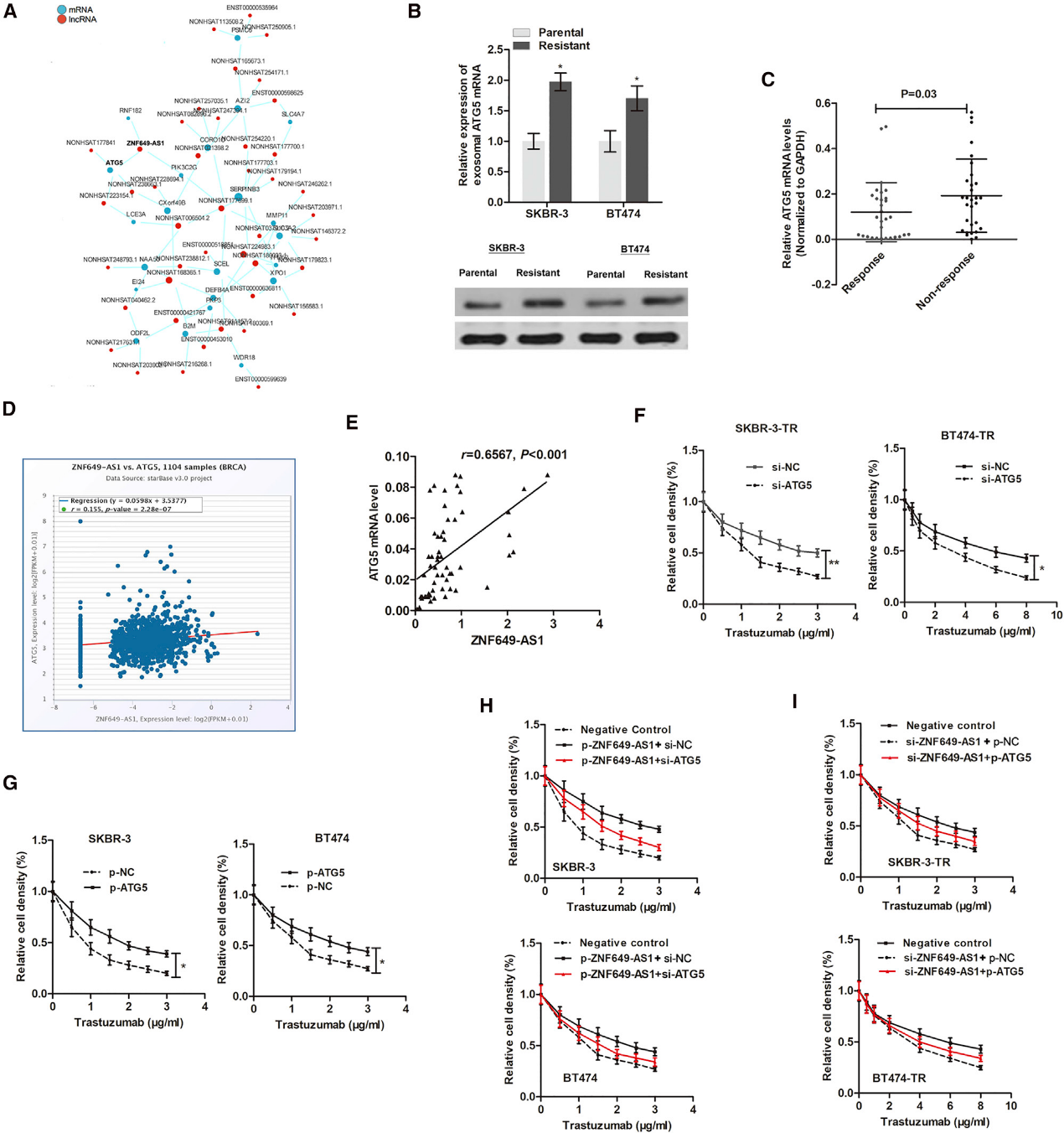
为了找到导致ZNF649-AS1诱导的自噬和曲妥珠单抗抗性的基因,我们分析了ZNF649-AS1和靶mRNAs的共表达网络(图6A)。有趣的是,我们发现了一个自噬相关的mRNA,ATG5,它被ZNF649-AS1靶向。与亲代细胞相比,在转录和蛋白质水平上,SKBR-3-TR和BT474-TR细胞中ATG5上调(图6B)。此外,与对治疗有反应的患者相比,对曲妥珠单抗耐药的患者组织中ATG5上调(图6C)。根据从Pan-Cancer Atlas获得的数据,ZNF649-AS1与ATG5表达略有正相关(图6D)。在接受曲妥珠单抗治疗的HER2+患者的60个组织中进一步证实了这种相关性(图6E)。接下来,我们试图确定ATG5是否对ZNF649AS1调节的曲妥珠单抗耐药性至关重要。我们发现ATG5的抑制减弱了曲妥珠单抗耐药细胞的化疗耐药性(图6F),而增加ATG5则促进了亲代细胞对曲妥珠单抗的耐药性(图6G)。此外,ATG5的抑制消除了ZNF649-AS1在敏感细胞中诱导的曲妥珠单抗耐药性(图6H),而增强的ATG5消除了ZNF649-AS1敲除诱导的耐药细胞的化学敏感性(图6I)。
7.ZNF649-AS1通过招募PTBP1激活ATG5的转录
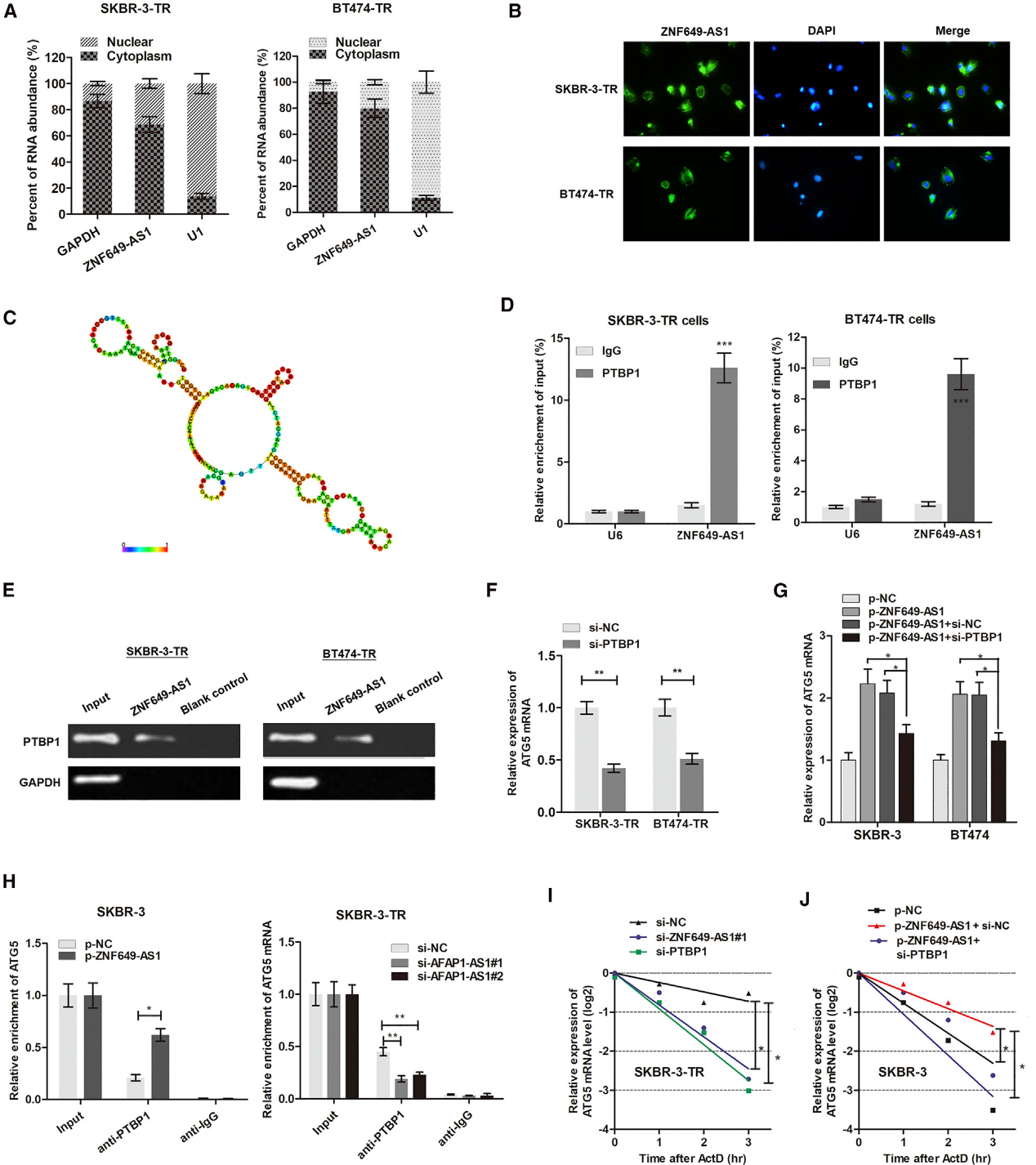
我们用细胞分离PCR发现ZNF649-AS1主要分布在乳腺癌细胞的细胞质中(图7A)。RNA荧光原位杂交(RNA-FISH)证实了这一结论(图7B),表明ZNF649-AS1在转录后水平上调节下游通路。基于MFE评估,我们预测981-1190 nt位点的ZNF649-AS1转录物形成了茎环结构(图7C),这对于与靶向RNA结合蛋白的关联至关重要。为了验证与ZNF649-AS1相关的蛋白质,进行了RNA下拉和质谱分析。我们发现了PTBP1,它可能参与定位、翻译起始和mRNA稳定性。通过设计ZNF649-AS1探针并进行RNA下拉分析,我们发现PTBP1蛋白被ZNF649-AS1富集(图7D)。此外,RNA免疫沉淀(RIP)试验证实ZNF649-AS1是由PTBP1抗体沉淀的(图7E)。这些发现提示ZNF649-AS1与PTBP1蛋白相关,发挥重要的生物学功能。
我们试图证明ZNF64-AS1通过与PTBP1结合来提高ATG5的mRNA稳定性。图7F显示PTBP1的沉默下调了ATG5的mRNA水平。此外,PTBP1的沉默消除了ZNF649-AS1诱导的ATG5 mRNA的增加(图7G)。为了确定PTBP1的作用,我们进行了RIP分析。ZNF649-AS1的过表达增加了SKBR-3细胞中与ATG5结合的内源性PTBP1,而敲除ZNF649-AS1在SKBR-3TR细胞中产生相反的作用(图7H)。此外,我们用actinomycin D 处理曲妥珠单抗耐药细胞,该actinomycin D广泛用于阻断转录过程,并发现沉默ZNF649-AS1或PTBP1导致ATG5 mRNA降解增加(图7I)。此外,ZNF649-AS1的过表达增加了半衰期,而PTBP1的敲除使半衰期回到正常水平(图7J)。因此,我们的结果证明,ZNF649-AS1结合的PTBP1通过提高mRNA的稳定性来增加ATG5的表达水平。
8.敲除ZNF649-AS1逆转曲妥珠单抗的体内自噬作用
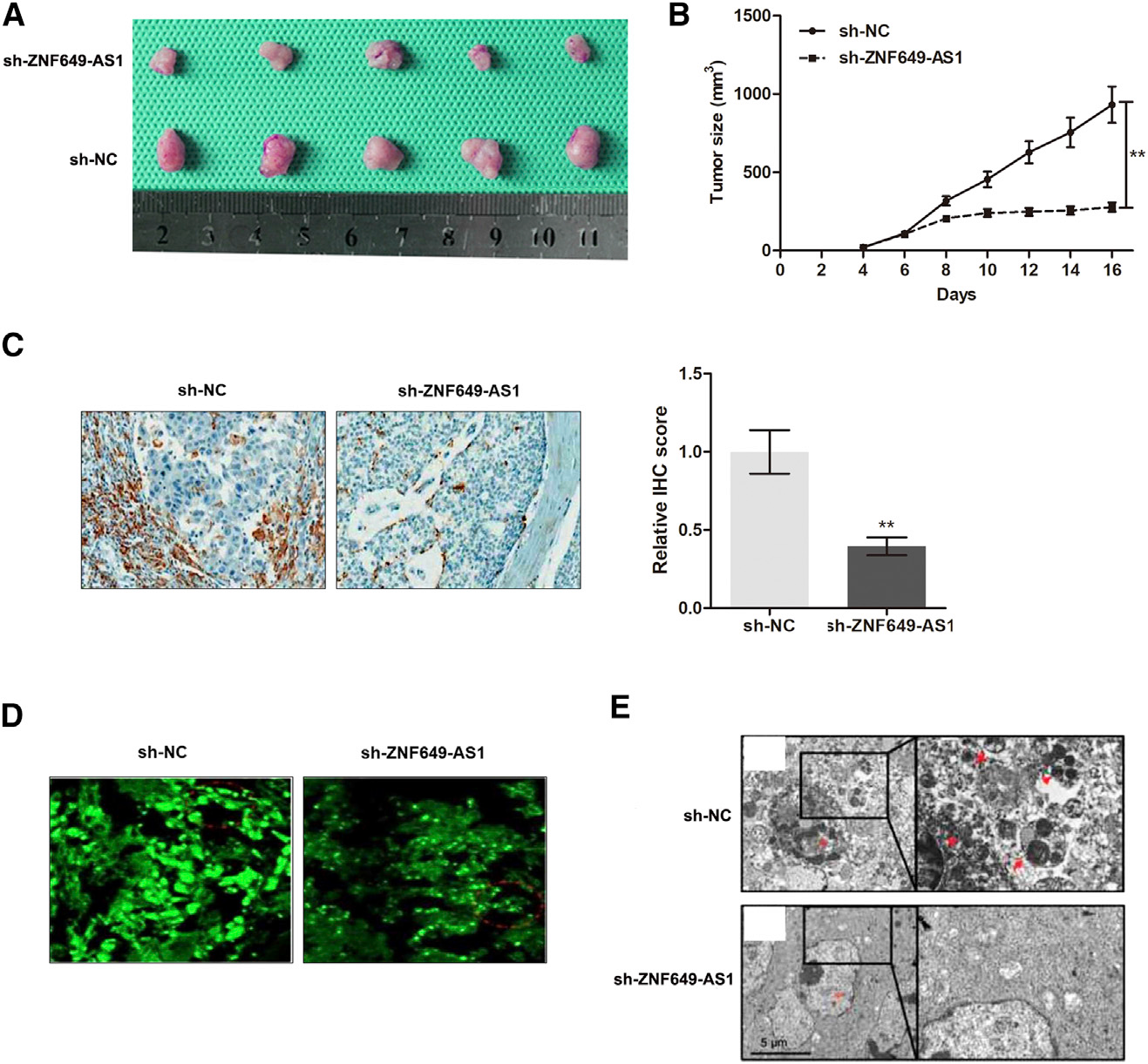
基于我们的体外观察,我们试图通过在BALB/c裸鼠模型中建立异种移植来验证我们的数据。通过从裸鼠身上剥离肿瘤,我们在治疗20天后为不同组建立异种移植(图8A)。在sh-ZNF649-AS1组中形成的肿瘤明显小于sh-NC组(图8B)。通过进行免疫组化(IHC)分析,我们发现由sh-ZNF649-AS1感染细胞形成的肿瘤与对照细胞形成的肿瘤相比,ATG5的表达水平降低(图8C)。此外,在sh-ZNF649-AS1组的小鼠中观察到低水平的LC3斑点(图8D)和自噬体(图8E)的形成。
结论:
我们发现ZNF649-AS1直接抑制ATG5的表达,从而抑制自噬,在乳腺癌抗曲妥珠单抗耐药中起着关键作用。我们的研究结果为深入了解ncRNA调控的肿瘤治疗效果提供了依据,并为开发更有效的策略来逆转乳腺癌患者曲妥珠单抗耐药性奠定了基础。






