急性肺损伤的Mas依赖性性别差异调控
急性肺损伤(Acute lung injury,ALI)是临床上十分常见的一类危重症,是由严重创伤、休克、酸中毒或严重感染等多种肺内外因素引起的,病死率高达40~31%,以炎症和血管通透性增强为特征,临床上表现为进行性低氧血症和呼吸窘迫,发展至严重阶段被称为急性呼吸窘迫综合征(Acute respiratory distress syndrome,ARDS)。流行病学研究对ARDS的性别差异产生了矛盾的结果:几项研究报告女性的年死亡率和住院死亡率较低,这一发现似乎得到了最近严重急性呼吸综合征冠状病毒2(SARS-CoV-2)爆发的新数据的支持,表明男性的死亡率高于女性。然而,在有风险的患者中进行的其他研究未检测到ARDS发生率或死亡率与性别显著相关,甚至与女性风险增加相关。
近期,科克大学的Thomas Walther教授发现改善肺内皮屏障功能可保护雌性小鼠免受ALI诱导的肺水肿,这种效应部分是通过雌激素依赖性Mas表达诱导Ang-(1-7)/Mas信号增强介导的,相关研究以“Estrogen-mediated upregulation of the Mas receptor contributes to sex differences in acute lung injury and lung vascular barrier regulation”为题发表在European respiratory journal杂志上,杂志影响因子为12.339。
技术路线:
结果:
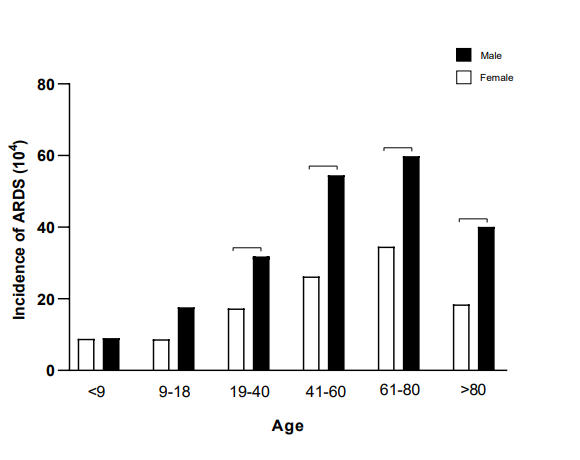
1、 ARDS发生率的性别差异
作者调查了2005年到2016年在柏林大学夏丽特医学院登记的734090名住院患者,发现有2475例诊断为ARDS,其中男性1553例(62.7%),女性922例(37.3%) (p<0.05)。除了幼儿(<9年),女性患者在所有年龄组中较少见,表明从青春期到绝经后的年龄阶段女性的肺受到保护(下图)。
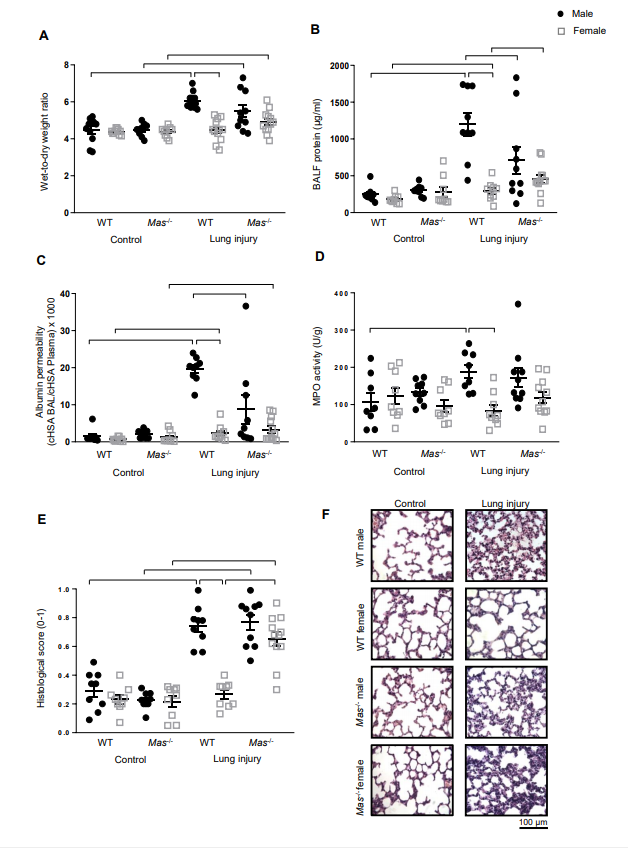
通过酸灌注和高潮气量通气双重打击诱导ALI小鼠模型,发现雄性老鼠发生显著肺部水肿,表现为湿干肺重比的增加(A),以及明显的血管渗漏,表现为支气管肺泡灌洗液(BALF)血清总蛋白浓度明显增加 (B)和大分子人血清白蛋白(HSA)外渗增加 (C),这些作用与中性粒细胞的聚集有关,表现为髓过氧化物酶(MPO)活性的增加(D)以及肺损伤的组织学特征(E,F)。雌性小鼠中,ALI的所有特征都被归一化(图2A-F),表明雌性小鼠与雄性小鼠相比具有显著的肺保护作用。为了探索ACE2/Ang-(1-7)/Mas轴在性别特异性保护中的作用,在Mas-/-小鼠中重复上述实验。对照组中,Mas-/-小鼠与相应的雄性和雌性野生型(WT)小鼠没有差异(A-F)。与Mas-/-对照相比,Mas-/-雌性小鼠ALI模型中肺湿干重比和组织学肺损伤评分增加,表现出较少的保护作用(A,E),并且BALF蛋白浓度和组织学评分超过了WT雌性小鼠ALI模型的相应值(B,E)。与相应的WT小鼠相比,雄性Mas-/-小鼠ALI模型中肺损伤加重并不明显,表现出ALI不那么严重的趋势,这种趋势仅对血管泄漏的参数有意义(B,C)。
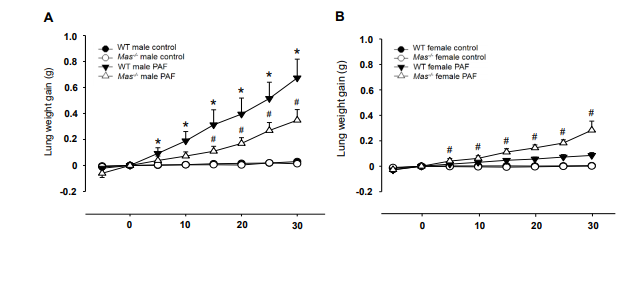
3、血小板活化因子对离体肺血管通透性的影响
由于Mas依赖的性别差异主要与血管渗漏和水肿形成的特征有关,与炎症无关(MPO活性)。接下来测量了血小板活化因子(PAF)刺激后肺重量变化,发现PAF刺激后雄性WT小鼠的离体肺发生显著的肺增重,经PAF刺激的雌性WT小鼠离体肺的重量无显著增加(p<0.05),而PAF刺激的Mas-/-雄性小鼠离体肺的肺增重低于雄性WT小鼠(A),PAF刺激的Mas-/-雌性小鼠离体肺的肺增重加速(B)。
4、雌激素通过Mas受体稳定培养内皮细胞的屏障功能
作者进一步检测了雌激素(E2)和Ang-(1-7)/Mas之间的作用,假设其可能是雌性小鼠部分Mas依赖性屏障保护的基础。研究分析了培养的人肺微血管内皮细胞(HPMECs)在凝血酶作用下的屏障功能,表现为跨内皮电阻(TEER)的变化 (A-C)。在融合HPMECs单层中,凝血酶刺激导致TEER在15 min内快速降低约15%,表明内皮间隙形成和内皮泄漏。用1 nmol/L E2预处理24 h,可完全阻止凝血酶的损伤作用。在凝血酶刺激前30 mi用七肽Ang-(1-7)预处理内皮细胞也达到类似的保护效果,两种处理联合使用导致了累加的屏障稳定(A)。接着,使用了两种药理学上不同的Mas受体阻滞剂A779和D-Pro7-Ang-(1-7),阻断了Ang-(1-7)的保护作用(1-7) (B,C)。重要的是,这两种拮抗剂也减弱了E2预处理的保护作用,表明雌激素至少部分是通过刺激Ang-(1-7)/Mas轴发挥作用的。

5、ALI模型中ACE2/Ang-(1-7)/Mas轴的性别特异性调控
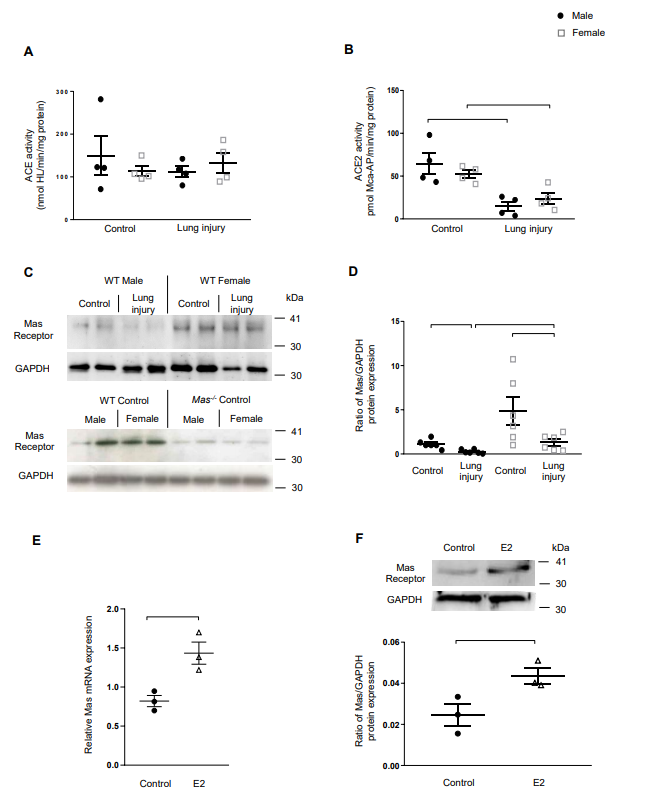
为了探索ACE2/Ang-(1-7)/Mas轴的性别差异调控,作者通过荧光测量了雄性和雌性小鼠肺中两种关键酶ACE和ACE2的活性。ACE活性在雄性和雌性WT小鼠肺之间没有差异,在对照组和ALI之间也没有差异(A)。ACE2活性在ALI的肺中明显下降,但没有性别特异性差异(B)。接着,发现全肺组织中,雌性小鼠的Mas受体表达高于雄性小鼠(C)。在仅显示最小条带的Mas-/-小鼠肺中证实了Mas受体抗体的特异性 (5),归因于Mas和Mas样家族的许多其他受体之间的序列相似性,由于轻微的交叉反应性而产生背景痕迹。免疫印迹和RT-qPCR实验发现ALI降低了雄性和雌性小鼠肺中Mas的表达,然而雌性Mas表达仍然是雄性的约5倍(C,D)。这些发现表明,较高的Mas表达可能有助于提高女性肺屏障功能,而Mas的丢失可能在肺血管泄漏中发挥重要作用,而与性别无关。相对应的,E2增加了培养的HPMECs中Mas受体mRNA(E)和蛋白(F)水平的表达,
提示E2刺激信号通过ACE2/Ang-(1-7)/Mas轴增加Mas受体的表达,而不是增加其配体的形成。
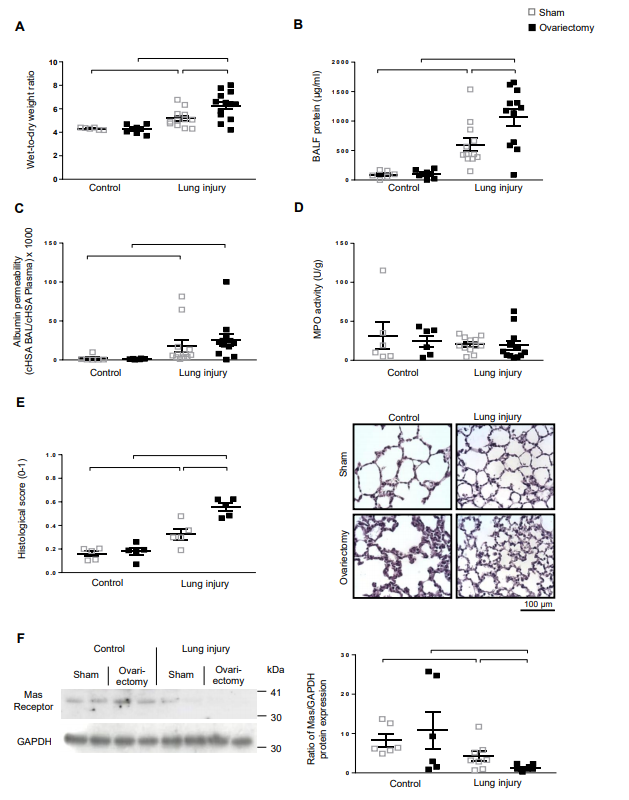
6、卵巢切除(OVX)小鼠对ALI的影响
为了验证E2在女性内皮屏障保护中的作用,作者研究了OVX小鼠ALI的影响。与假手术雌性小鼠相比,OVX小鼠在二次打击ALI模型中发生了更明显的肺损伤,表现为湿干肺重量比 (A)、BALF蛋白质浓度(B)和组织学肺损伤评分增加(E),而HSA比率或MPO活性在OVX小鼠和假手术雌性小鼠之间没有显著差异 (C,D)。重要的是,与假手术小鼠相比,OVX中ALI显著降低了Mas受体的表达(F),巩固了女性和雌激素至少在一定程度上通过上调Mas受体赋予内皮屏障保护的观点。