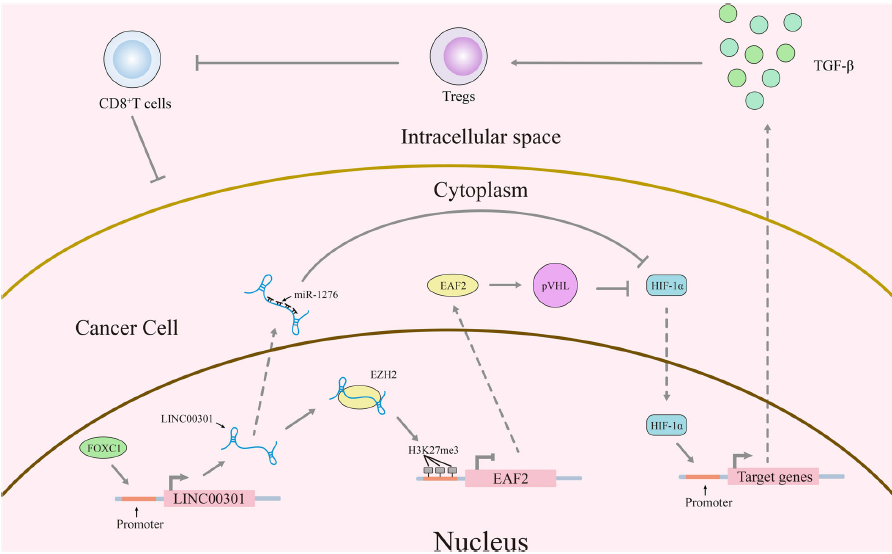
lncRNA与免疫抑制微环境的研究思路
导语:肿瘤微环境(TME)是肿瘤细胞赖以生存和发展的复杂环境,主要由细胞成分和非细胞成分组成,共同构成了复杂的肿瘤微环境。免疫抑制微环境是肿瘤微环境中起抑制免疫功能的部分,其组成包括免疫抑制性细胞和抑制性细胞因子。长链非编码RNA(lncRNA)已被报道参与肿瘤进展,lncRNA与免疫抑制微环境研究思路值得关注。
技术路线:
结果:
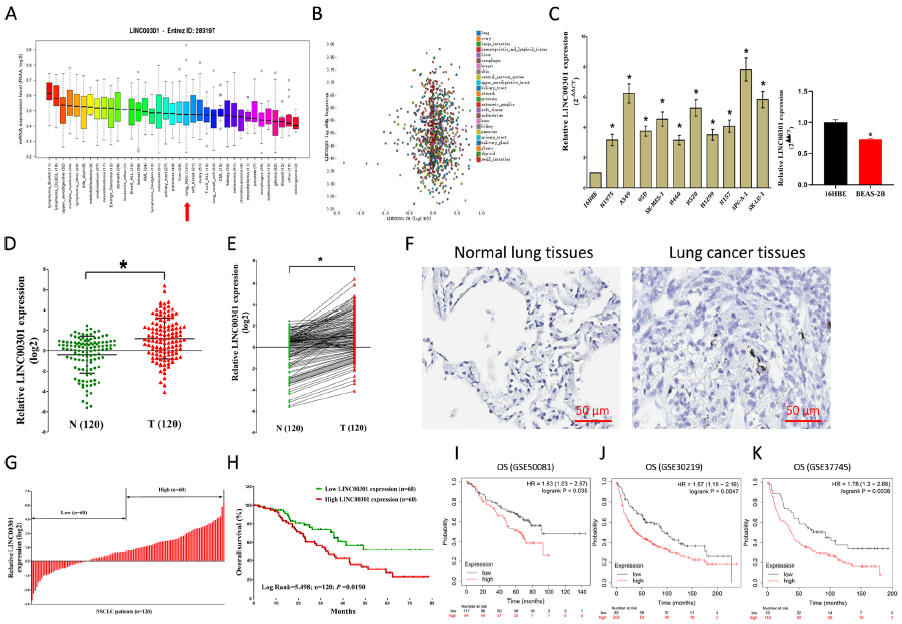
1. LINC00301在非小细胞肺癌(NSCLC)中高表达,提示预后不良
通过汇编癌细胞系百科全书(CCLE)以及细胞系、组织检测发现LINC00301在NSCLC细胞系中上调表达。评价LINC00301的临床意义,发现LINC00301与NSCLC的淋巴结转移、TNM分期和肿瘤大小密切相关,高LINC00301水平与较差的总体生存期相关,LINC00301高表达与较差的预后相关。
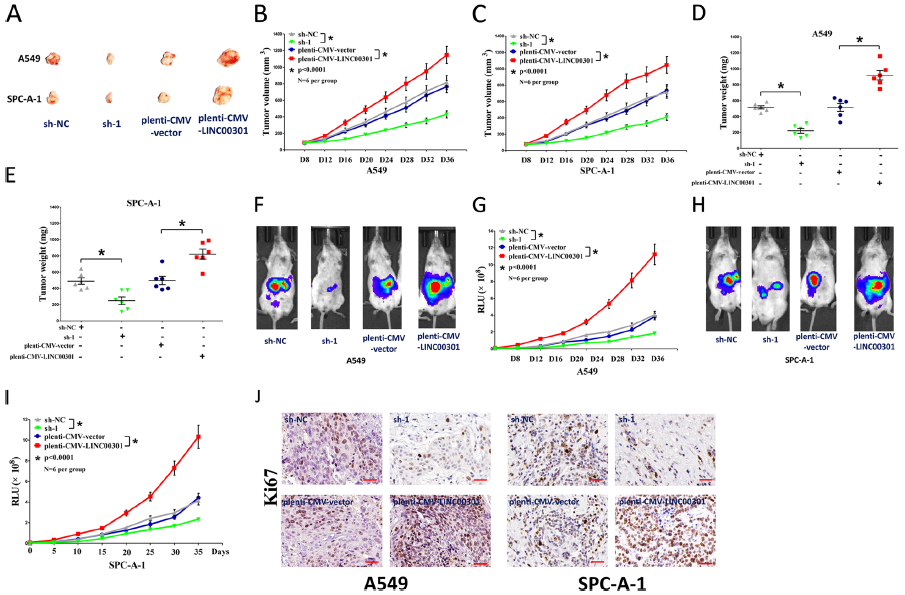
2. LINC00301在体外加速细胞生长和迁移/侵袭,抑制细胞周期阻滞/细胞凋亡
探索LINC00301在NSCLC细胞生长中的作用。在4种NSCLC细胞中敲低或过表达LINC00301,进行克隆形成试验、CCK8、台盼蓝染色和BrdU染色。结果表明,LINC00301可显著加速NSCLC细胞生长、细胞迁移和侵袭。沉默LINC00301有利于细胞周期停滞和凋亡。

3. LINC00301在体内促进肿瘤生长并促进Treg细胞浸润
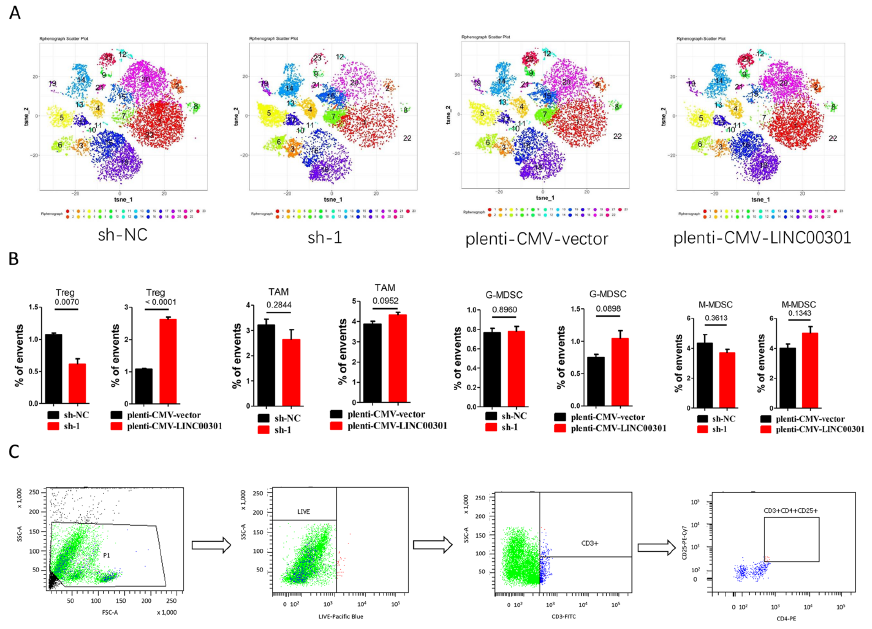
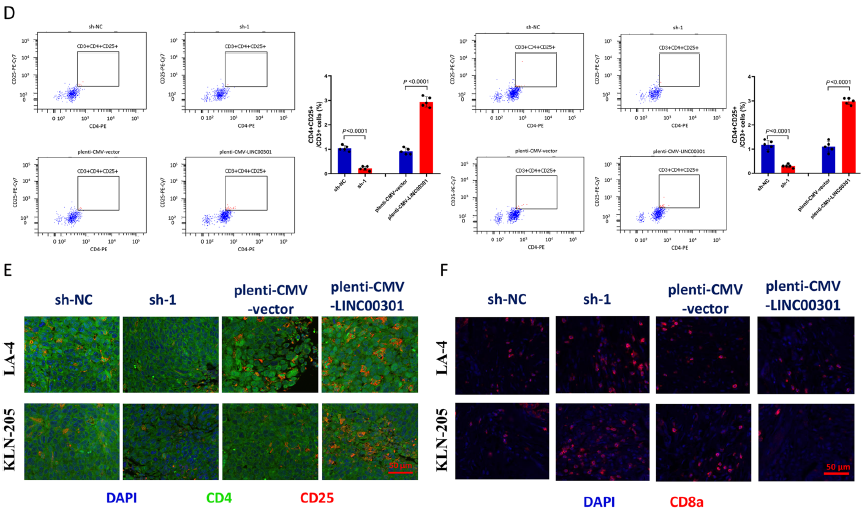
用A549和SPC-A-1细胞建立了BALB/c裸鼠异种移植模型,LINC00301 敲低鼠的肿瘤体积和重量显著受到抑制,LINC00301显著加速了人NSCLC细胞在小鼠模型中的致瘤能力。肿瘤免疫环境广泛参与包括NSCLC在内的不同癌症类型的肿瘤生长和发展。检测过表达和敲低LINC00301细胞对C57BL/6J小鼠分离的肿瘤中免疫细胞浸润的作用,分离肿瘤,消化成单细胞后应用22种抗体进行CyTOF分析,发现LINC00301 过表达组表现出较高的CD4 + CD25 + Treg细胞浸润和较低的CD8 + T细胞浸润,表明LINC00301通过募集Treg细胞在NSCLC中发挥免疫抑制作用。
4. 转录因子(TF)FOXC1,并不是甲基化和去乙酰化调节NSCLC中LINC00301表达
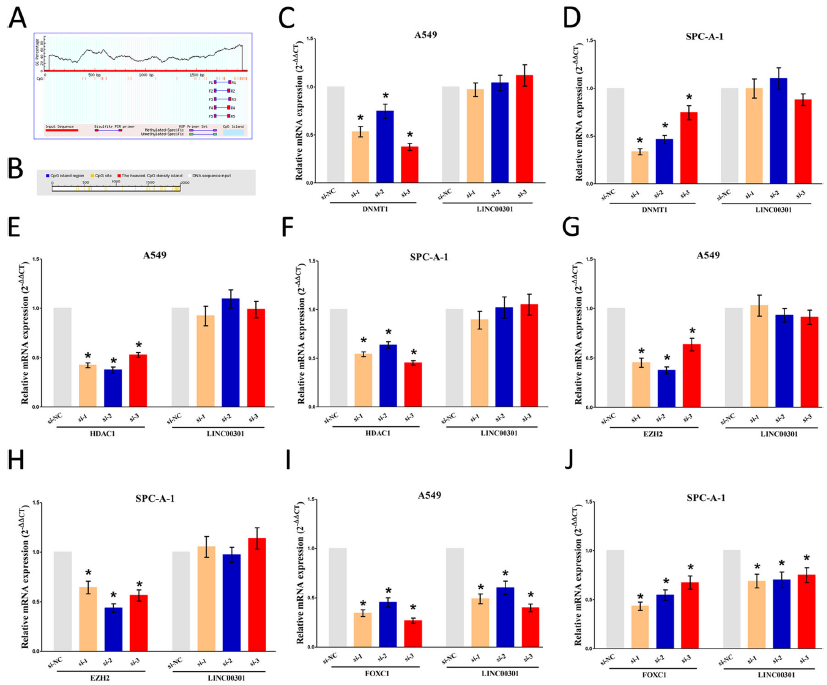
探索LINC00301的调节因子,染色质甲基化和去乙酰化可能沉默或激活基因表达。通过在线软件MethPrimer和DBCAT分析LINC00301启动子,未发现CpG岛;细胞沉默DNA(cytosine-5)-甲基转移酶1(DNMT1)DNMT1不会显著影响LINC00301的表达,表明DNA甲基化不参与NSCLC细胞中LINC00301的上调。在细胞中阻碍HDAC1后,LINC00301水平未增强,表明去乙酰化不参与NSCLC中LINC00301的上调。沉默组蛋白赖氨酸甲基转移酶EZH2不会显著影响LINC00301的表达,表明组蛋白甲基化不参与NSCLC细胞中LINC00301的上调。综上所述,甲基化和去乙酰化不参与NSCLC中LINC00301的上调。
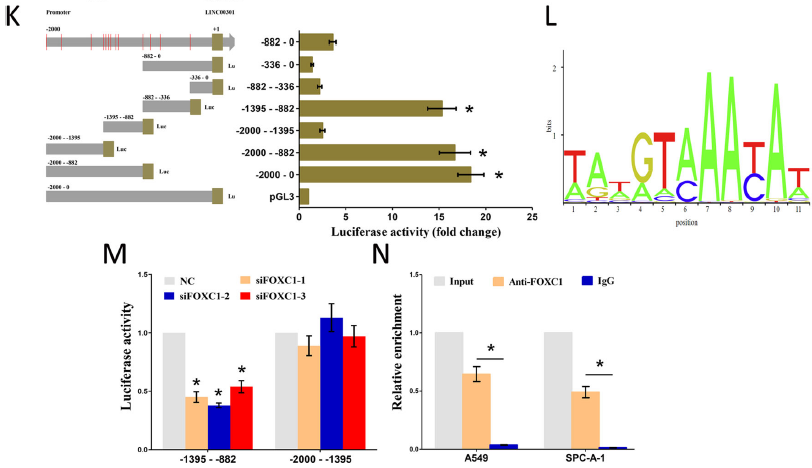
为进一步确定LINC00301的上游,通过JARSPAR在线数据库预测了可能与LINC00301启动子相互作用的潜在转录因子,发现在NSCLC中上调的FOXC1。沉默FOXC1显著促进LINC00301下调。为证实LINC00301是FOXC1的转录靶标,将LINC00301启动子的片段序列克隆到pGL3-basic载体中,转染HEK-293 T细胞后测定荧光素酶活性。结果发现前两个荧光素酶活性是-1395到-882 nt和-2000到-1395 n,表明含有调控元件的两个片段对LINC00301转录至关重要。FOXC1 敲低显著降低了-1395到-882 nt片段的荧光素酶活性,表明LINC00301启动子上-1395至-882 nt的区域负责foxc1诱导的LINC00301活化。染色质免疫沉淀(ChIP)实验发现FOXC1可以直接结合NSCLC细胞系中LINC00301启动子上的位点6(-1395到-1388 nt)。以上结果显示,在NSCLC中,LINC00301上调确实是由FOXC1介导的。
5. LINC00301通过PRC2正向控制H3K27三甲基化
为阐明LINC00301调控NSCLC细胞的分子机制,首先评估了LINC00301在NSCLC细胞中的亚细胞定位。FISH鉴定LINC00301位于细胞质和细胞核中,但细胞核中LINC00301的比例远高于细胞质中的比例。因此,怀疑LINC00301可能通过细胞核和细胞质途径作为癌基因发挥作用。
组蛋白甲基化与NSCLC进展过程中的转录组重编程有关。NSCLC细胞中LINC00301缺陷特异性地降低了H3K27的二甲基化和三甲基化,而不影响H3K9位点的二甲基化和三甲基化水平。这些表明LINC00301在NSCLC中对H3K27甲基化有特异性正调控。H3K27的二甲基化和三甲基化一般是由组蛋白甲基转移酶多梳抑制复合物2(PRC2)催化的,RIP试验发现在A549和SPC-a-1细胞中,LINC00301在与PRC2元件EZH2和SUZ12的相互作用组中显著富集。使用链霉亲和素偶联微珠进行RNA下拉试验验证生物素化的LINC00301在NSCLC细胞中与EZH2结合。
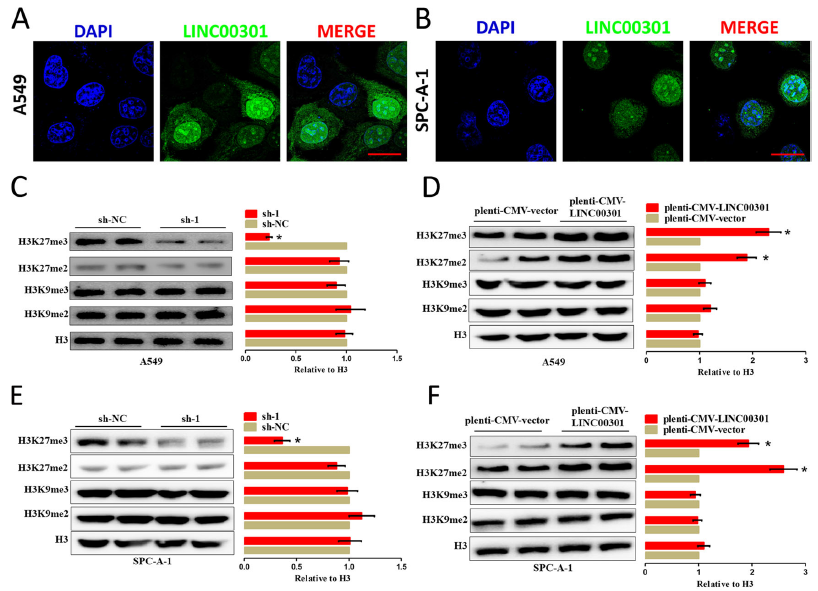
6. LINC00301和EZH2之间的相互作用
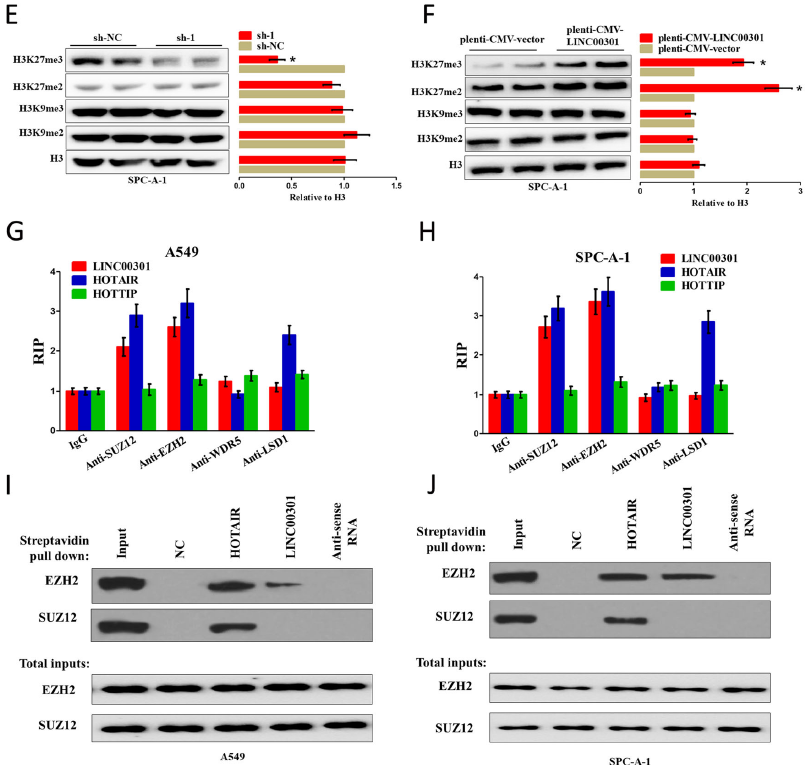
为确定LINC00301与EZH2蛋白哪个结构域结合,蛋白结构域图谱分析显示LINC00301直接与EZH2的612–727 aa区域结合。体外RNA下拉实验发现LINC00301的包含83-123 nt基序序列,结合并受EZH2保护。消除LINC00301的这个序列可消除其与EZH2的相互作用。RNA EMSA发现从细胞纯化的LINC00301与重组EZH2之间形成复合物。因此得出结论,LINC00301通过特定区域直接与EZH2结合。
7. LINC00301招募EZH2并介导EAF2启动子H3K27me3抑制EAF2转录
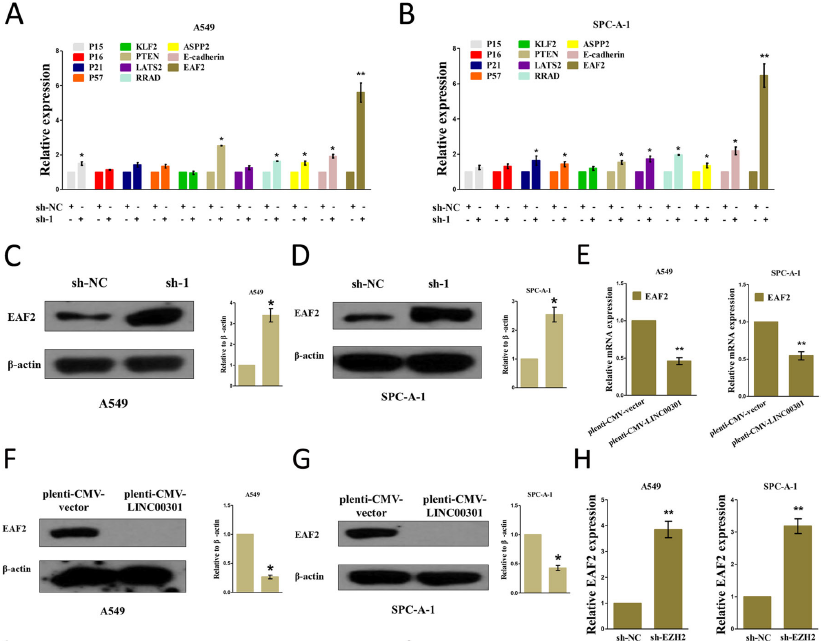
H3K27的三甲基化是由EZH2催化的。LINC00301的沉默显著增加了细胞中EZH2的靶抑制基因EAF2 mRNA和蛋白水平,EZH2沉默显著增加细胞中EAF2的mRNA和蛋白水平。因此,LINC00301通过直接与EZH2结合介导NSCLC细胞中EAF2启动子H3K27me3来抑制EAF2的表达。
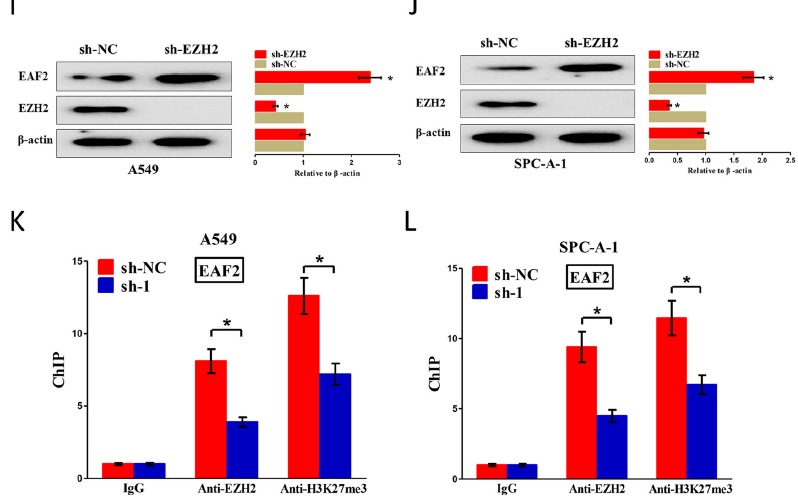
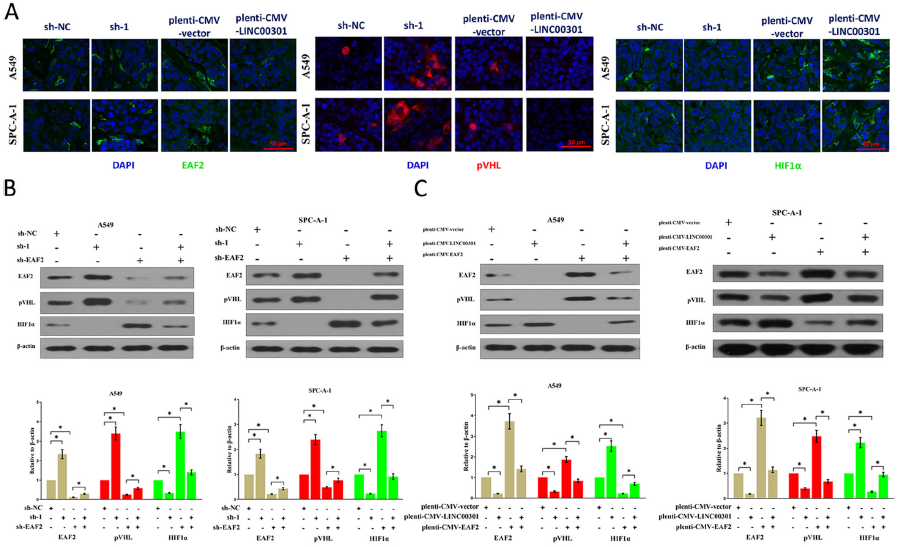
8. LINC00301通过调节EAF2/VHL/HIF1α通路促进NSCLC细胞生长和迁移/侵袭
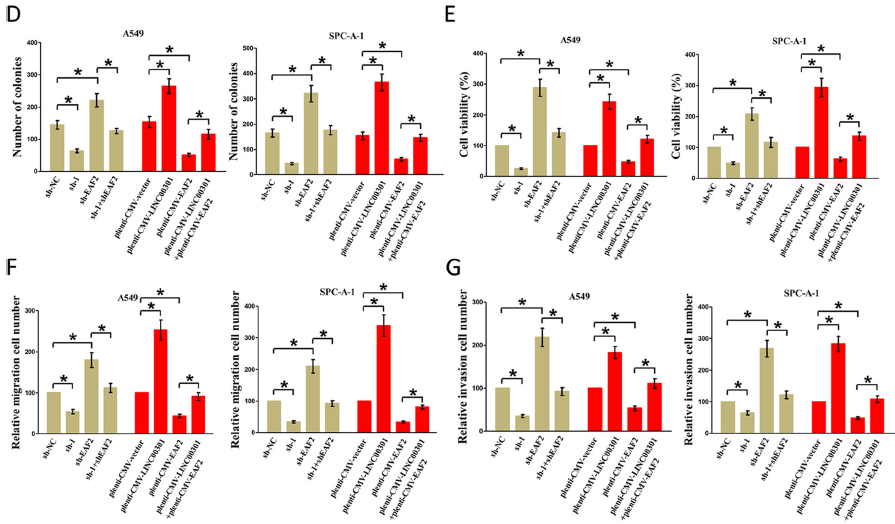
肿瘤抑制因子EAF2在肿瘤中下调,文献报道EAF2可结合并稳定pVHL,进而促进HIF1α降解。因此,EAF2可能是EZH2上调和HIF1α活化之间的关键连接因子。为证明这一假设,敲低LINC00301,发现显著增加EAF2和pVHL蛋白表达,降低HIF1α蛋白表达,过表达有相反效果。随后检测LINC00301/EAF2通路在NSCLC细胞增殖、迁移和侵袭中的作用,LINC00301 敲低和EAF2过表达阻碍细胞增殖、迁移和侵袭。
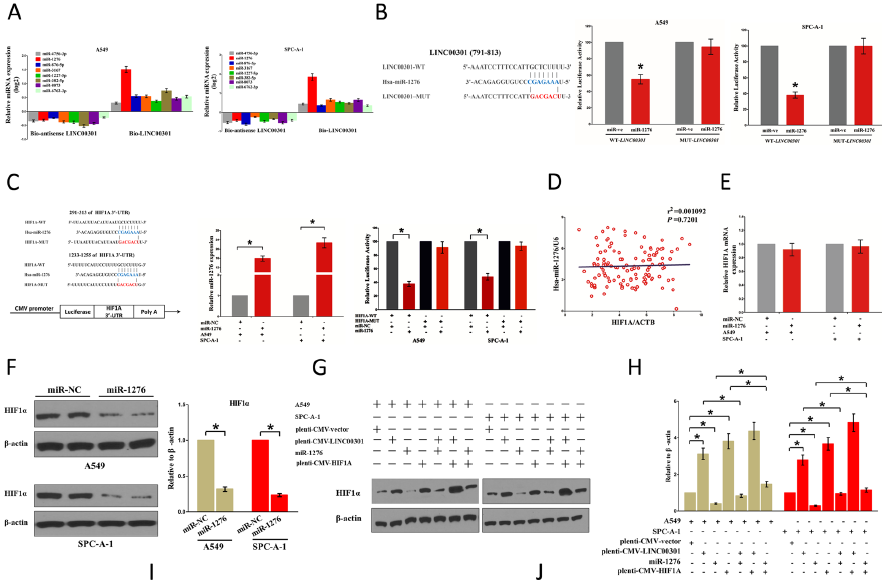
9. LINC00301通过海绵miR-1276激活HIF1α发挥致癌作用
鉴于LINC00301位于细胞核(初级)和细胞质(次级),推测LINC00301也可能通过细胞质途径发挥其致癌作用。LncRNA可能作为ceRNA调控miRNA的生物学效应。探索与LINC00301相关的特异性miRNA,发现miR-1276是与LINC00301结合的最富集的miRNA。双荧光素酶报告基因检测进一步确定LINC00301与miR-1276的结合。数据库miRanda和PicTar筛选miR-1276的潜在靶标-癌基因HIF1α,双荧光素酶受体试验以验证miR-1276调控HIF1α。在NSCLC样本中,HIF1A mRNA水平与miR-1276表达无显著相关性,miR-1276不影响HIF1A mRNA表达水平,但抑制HIF1A蛋白表达水平。这表明miR-1276在转录后水平影响HIF1α蛋白表达。
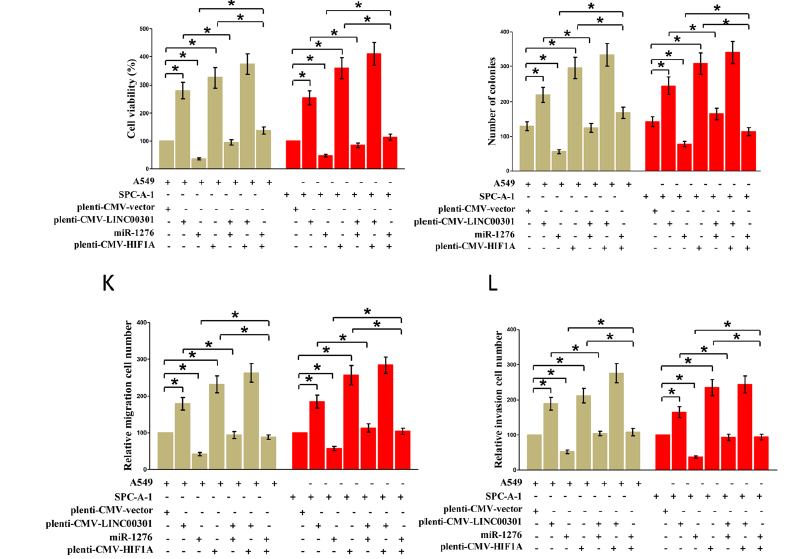
研究LINC00301/miR-1276/HIF1α轴在NSCLC细胞增殖和迁移/侵袭中的功能。台盼蓝染色、克隆形成、迁移/侵袭实验证明miR-1276模拟物抑制生长/迁移/侵袭,HIF1A 过表达促进细胞的生长。当用miR-1276模拟物加HIF1A 过表达处理细胞时,miR-1276逆转了HIF1A在细胞增殖/迁移和侵袭中的作用,HIF1A 过表达逆转了miR-1276的生长抑制功能。这些结果证明miR1276通过直接靶向HIF1A mRNA的3’-UTR来调控细胞迁移/侵袭。因此,LINC00301的致癌效率部分归因于海绵miR-1276,然后触发NSCLC中的HIF1α。
总结:1. LINC00301在NSCLC中高表达,促进肿瘤生长,促进肿瘤微环境中Treg浸润,抑制CD8 + T细胞浸润;
2. 转录因子FOXC1调节LINC00301在NSCLC中的表达;
3. LINC00301通过与EZH2直接结合,介导细胞核中EAF2的表观遗传沉默,介导HIF1α的活化,部分介导致癌作用;
4. LINC00301通过作为miR-1276的ceRNA增加NSCLC细胞质中HIF1α的表达,介导致癌作用。