单细胞测序与TCGA数据助力膀胱癌发表高分文章
膀胱癌是世界上最普遍的泌尿生殖系统恶性疾病之一,每年诊断出约430,000例新病例,造成165,000多例死亡。尽管在癌症生物学和治疗方面已取得实质性进展,但膀胱癌患者的临床结果仍不令人满意。在过去的十年中,与药物发现的治疗靶标有关的肿瘤微环境(TME)一直是癌症生物学研究的热门领域。值得注意的是,膀胱癌是免疫力最低的浸润癌之一,这可能是对抗PD1治疗反应差的原因,为膀胱癌设计新的治疗策略一直是一项艰巨的任务。之前,已经报道了膀胱癌的分子亚型显示出不同的细胞类型特异性表达模式,这表明膀胱癌的异质性至少部分是由微环境内部的不同细胞类型组成的。但是,直到最近,相关的研究还很少。近期,华中科技大学同济医学院附属医院泌尿科陈科教授及其团队分析了膀胱尿路上皮癌或癌旁粘膜样品中单细胞的转录组,并绘制了膀胱癌组织内整个TME的图集,促进了对膀胱癌患者之间异质性的理解,并为膀胱尿路上皮癌的个体化治疗提供了基础。相关研究以“Single-cell RNA sequencing highlights the role of inflammatory cancer-associated fibroblasts in bladder urothelial carcinoma”为题发表在Nature communications杂志上,杂志影响因子12.121。
技术路线:

结果:
1、膀胱癌细胞异质性
作者通过质量控制消除了批次之间的批次效应,将52721个单细胞聚集为八个主要簇,簇特异性基因被用来标记来注释细胞类型:上皮(EPCAM+)细胞;内皮(CD31+)细胞;两种类型的成纤维细胞(COL1A1+)-iCAF(PDGFRA+)和肌CAF(mCAFs)(RGS5+);B细胞(CD79A+);骨髓细胞(LYZ+);T细胞(CD3D+);和肥大细胞(TPSAB1+)(a,b)。随后,将EPCAM +上皮细胞(EPC)重新聚集以产生17个簇,通过InferCNV证实了癌细胞显示出患者特异性的表达模式可能是由拷贝数变异(CNV)引起的极高的异质性的假设,且发现肿瘤组织中的一些细胞几乎不具有CNV,表现出与正常EPC相似的表达模式,同时发现一系列基因在对照组和CNV未检出组中特别表达,但在肿瘤细胞中几乎不存在(c,d)。基因本体富集分析表明,这些基因富集于免疫相关途径,特别是B细胞相关途径(e)。与正常上皮细胞相比,癌细胞几乎丧失了产生免疫球蛋白的能力,免疫组化分析发现它们表达的MHC-II分子水平较低(f,g),表明膀胱癌细胞可能下调免疫原性以逃避免疫检测。通过基因组变异分析(GSVA)进行的途径分析显示,CNV高水平人群中E2F靶标、MYC靶标和G2M检查点途径富集,而炎症和其他免疫相关途径则被下调(h),进一步证实了处于膀胱癌晚期的癌细胞下调了免疫原性并显示出高增殖能力。

2、肿瘤区域的单核细胞经历M2极化
作者共鉴定出7种细胞类型:肿瘤相关的巨噬细胞、CD1C+树突状细胞、单核细胞、增殖性骨髓细胞、交叉呈现DC、卵泡B细胞和LAMP3+DC。两个细胞簇均表达髓样标志物以及上皮或内皮标志物被认为是双峰(a)。单核细胞大部分起源于正常的粘膜组织,而肿瘤相关巨噬细胞则富集在膀胱癌组织中。此外,这两种细胞类型的转录组表现出连续的变化,表明募集到肿瘤区域的单核细胞被重新编程为肿瘤相关巨噬细胞(b)。作者发现BACH1,MAFG和NFE2这三个基序的活性被下调,而MAF,STAT1和STAT2基序的激活导致M2极化过程,为抑制或逆转免疫抑制微环境的形成提供了潜在的目标(c,d)。此外,在这种分化过程中,共抑制因子CD274,LGALS9,CD276,TIGIT和PDCD1LG2均被上调,而共激活因子被下调(e)。三个DC亚组中,LAMP3+ DC组表达了各种编码细胞因子的基因,包括CCL17,CCL19和CCL22(f),这些细胞因子几乎完全来源于膀胱癌的LAMP3+ DC(g)。LAMP3+ DCs显示出最高水平的CD274(f),甚至高于从膀胱癌组织的Tregs中观察到的水平,表明该DC亚组可以直接抑制CD8+ T细胞或通过募集Tregs进入肿瘤区域。在TCGA膀胱尿路上皮癌队列中,LAMP3+ DC签名与均为CCR4+的Treg签名和Th2签名高度正相关,但与CTL签名没有高度相关(h)。

3、膀胱癌成纤维细胞亚型
成纤维细胞(COL1A1+)分为两种不同类型:PDGFRA+成纤维细胞表现出各种细胞因子和趋化因子的强表达,包括CXCL12,IL6,CXCL14,CXCL1和CXCL2;RGS5+成纤维细胞具有与肌癌相关的成纤维细胞(mCAFs)相似的特征(a,b)。通过免疫荧光法评估了肿瘤和非恶性膀胱基质组织中现有的iCAF和mCAF发现在,不同类型的癌症中CAFs具有类似的亚群(c)。为了调查每个亚组的功能,作者对iCAF和mCAF的差异表达基因进行了GO富集分析发现iCAF与细胞外基质的组织,细胞迁移的调节和血管生成有关,而肌肉系统过程,粘着斑和细胞外基质相关的途径则明显富含mCAF(d)。GSEA同样显示iCAF与细胞外基质降解有关,表明其在肿瘤转移中的潜在作用。细胞因子-细胞因子受体的相互作用途径也丰富了iCAFs。相反,肌肉收缩和PGC1A途径富含mCAF(e,f)。由于细胞因子与细胞因子受体的相互作用在iCAF中富集,因此研究了膀胱癌TME中细胞因子的表达水平。CXCL12与TCGA膀胱尿路上皮癌队列中的肿瘤相关巨噬细胞签名呈正相关,而较高水平的CXCL12与不良预后显着相关。免疫荧光实验发现CXCL12在膀胱癌组织中通过iCAFs表达(g-h)。

4、iCAF的增殖作用
通过SCENIC分析确定了两个CAF亚组中的必需基序,TCF21和TWIST2基序在iCAF中被高度激活(a,b)。随后,通过GO富集预测iCAF具有生长因子活性,并分析了膀胱癌TME中VEGF,FGF和IGF家族的表达水平(c),在这些生长因子中,IGF1是iCAF特异性的组因子,与总体生存期较差有关(d,e)。为了验证其促增殖作用,作者通过流式细胞术对iCAF进行了分类,并将它们与膀胱尿路上皮癌细胞系进行了共培养,显示出更高的增殖能力,这证实了iCAF在膀胱癌中的肿瘤作用(f,g)。
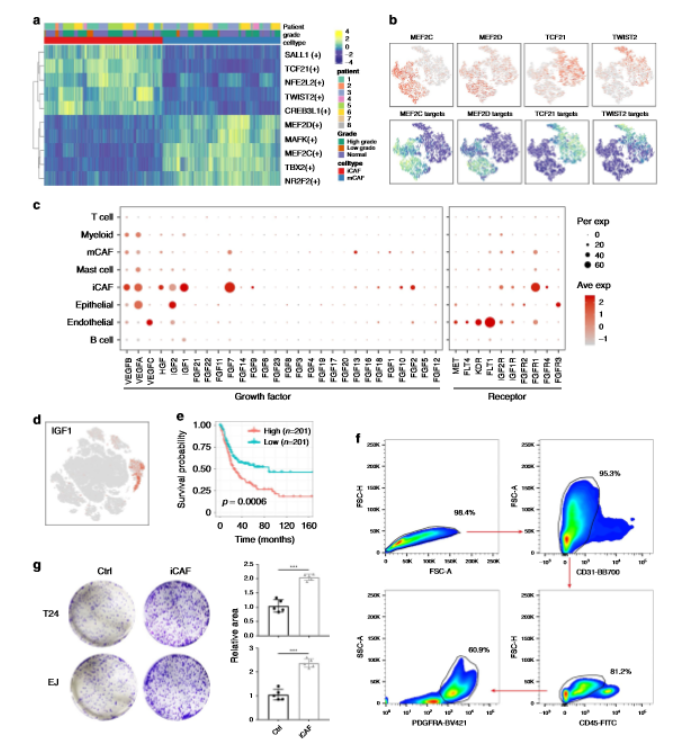
5、scRNA-seq与公共数据集相关分析
为了研究本研究中确定的细胞类型的临床作用,作者使用CIBERSORTx 评估TCGA膀胱尿路上皮癌队列样本中每种细胞类型的比例,发现只有iCAF和mCAF的积累与较差的总体生存率相关(a,b)。当将细胞分数数据与临床信息相关联时发现先前描述的分子亚型之间的细胞类型丰度变化很大,肿瘤纯度最高的乳头状乳头状瘤的预后最好,而其他四组的总生存率则无明显差异,其中基底鳞癌显示出最低的肿瘤纯度,还富集了T细胞,表明抗免疫检查点疗法可能适合这些患者(c,d)。随后,作者扩大了临床队列,从GEO和ArrayExpress数据库中收集了3000多个微阵列分析的膀胱癌和非恶性粘膜样品,通过Combat功能消除了可能的批量效应,然后使用ConsensusClusterPlus将2959个肿瘤样品分为五个主要簇,四个主要的团簇显示了与荧光团簇相似的特征:乳头状团簇、管状团簇、荧光浸润团簇和基底鳞状团簇。另一簇与TCGA 膀胱尿路上皮癌中的神经组不同,同时具有光鳞状和管腔特征,故命名为管腔跃迁。该荟萃队列中的总生存率与TCGA高度对应,证明了CAF在膀胱癌进程中的重要作用(e-f)。

6、构建基于iCAF的监管网络
作者通过CellphoneDB2研究了细胞类型之间的细胞-细胞相互作用网络,iCAFs与其他细胞类型的相互作用最多,并且与ECs的相互作用特别强(a)。iCAFs中CXCL12表达水平较高,其受体包括DPP4、CXCR3、CXCR4和ACKR3 (CXCR7)。由于CXCR4和CXCR3在免疫细胞上广泛表达,iCAFs分泌CXCL12负责膀胱癌的免疫浸润状态。iCAFs分泌的CCL2和CXCL1可与ECs表面高表达的ACKR1相互作用。这些细胞因子之前被报道与膀胱癌的转移有关,确定它们的起源为iCAFs(b,d)。作者认为,iCAFs可产生VEGF,包括VEGFA和VEGFB,它们与内皮细胞上的VEGF受体(FLT1、KDR、MET和FLT4)结合,促进血管生成。此外,FGFR1在iCAFs和ECs上表达,而FGFR3在肿瘤细胞上表达。这些受体可与FGF结合,包括来自iCAFs的FGF2和FGF7,并表现出促增殖作用。IGF1R是IGF1的受体,在肿瘤细胞和间质细胞上均有表达,提示iCAF也可介导对顺铂的耐药。值得注意的是,肿瘤细胞中VEGFA表达水平较高,其促血管生成能力最强。此外,高级别肿瘤细胞在iCAFs上高表达IGF2,并与IGF2R相互作用,促进肿瘤进展(c, e)。综上所述, iCAFs可以促进肿瘤细胞和基质细胞的增殖。
结论:
1、作者在膀胱癌微环境中鉴定出19种不同的细胞类型,表明肿瘤内异质性很高。
2、研究发现肿瘤细胞下调了MHC-II分子,提示癌细胞的下调免疫原性可能有助于形成免疫抑制性微环境,且发现单核细胞在肿瘤区域经历M2极化并分化。
3、LAMP3+ DC亚组可能能够募集调节性T细胞,可能参与免疫抑制性TME的形成。
4、炎症相关的成纤维细胞与肿瘤不良的预后显着相关。
参考文献:
Chen, ZH; Zhou, LJ; Liu, LL,et al. Single-cell RNA sequencing highlights the role of inflammatory cancer-associated fibroblasts in bladder urothelial carcinoma. Nature communications. 2020.






