国自然热门—铁死亡
铁死亡(Ferroptosis)最早是2012年由Brent R. Stockwell提出的,研究发现Erastin可以特异性诱导Ras突变细胞死亡。它与铁依赖的脂质过氧化代谢有关,通过NADPH/H+、多不饱和脂肪酸代谢、谷氨酰胺分解代谢途径调节细胞死亡。我们回顾2019年度铁死亡的相关研究课题,发现一共有128项课题。铁死亡是目前国自然申请的热点。小编接下来为大家讲解铁死亡的机制和研究思路。
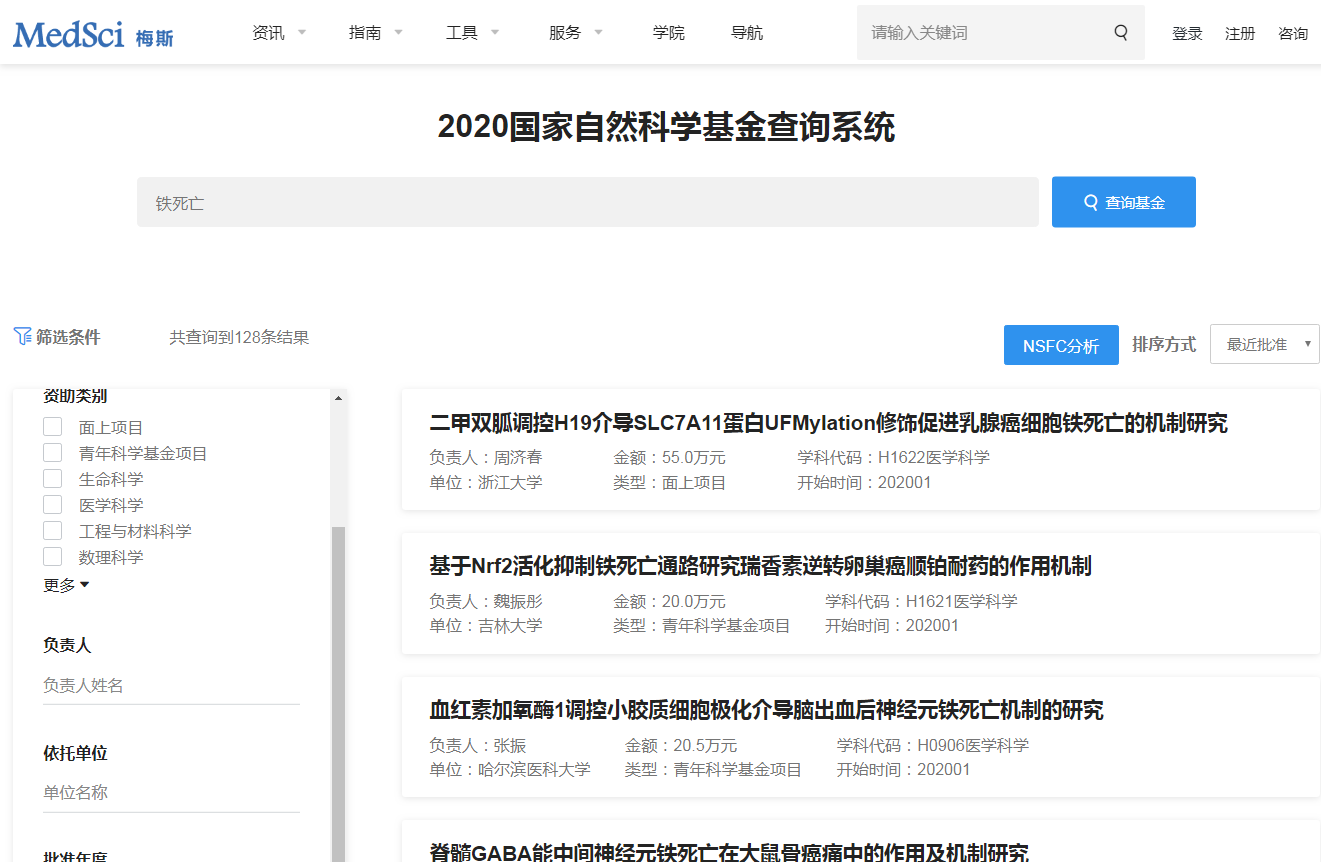
1.铁死亡机制
(1)抑制GPX4诱导铁死亡:GPX4 能降解小分子过氧化物和某些脂质过氧化物,抑制脂质过氧化。研究发现,若细胞中 GPX4 表达下调则会对铁死亡更敏感;相反,若上调 GPX4 的表达,则会产生对铁死亡的耐受。因此,将GPX4抑制后将诱导细胞发生铁死亡。
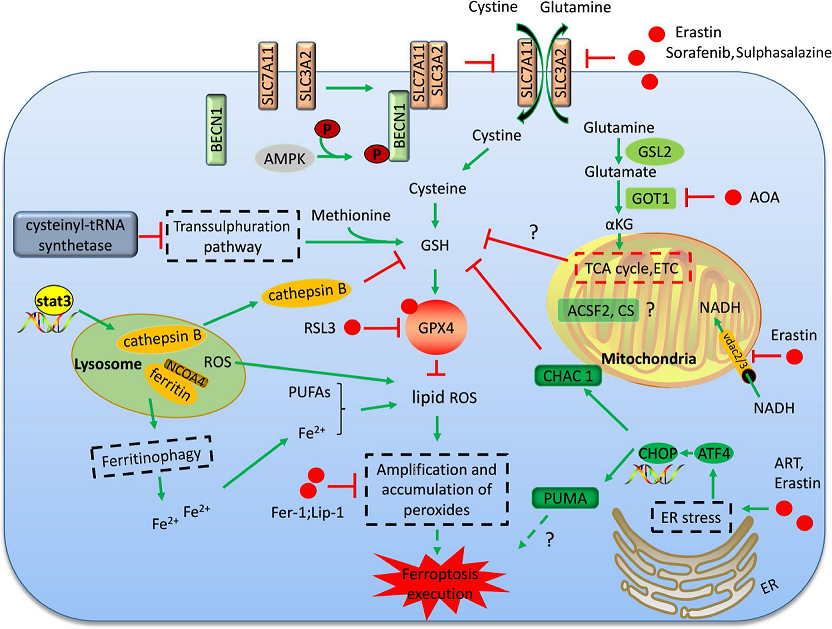
(2)抑制胱氨酸谷氨酸转运受体 (systemXC-)诱导铁死亡:通过systemXC-,谷氨酸与胱氨酸以1:1比例交换,因此,谷氨酸的水平会影响到systemXC- 的功能。细胞外高浓度的谷氨酸会抑制systemXC-从而诱导铁死亡。敲除systemXC-的小鼠由于细胞外谷氨酸水平减少,可以防止神经毒性损伤。
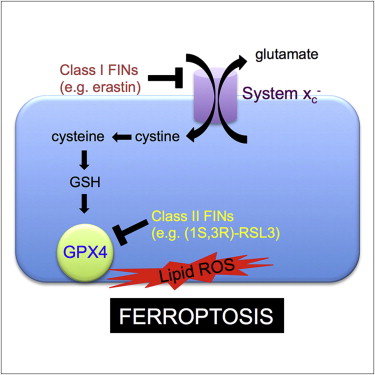
(3)p53介导铁死亡:p53是一种抑癌基因,通过下调systemXC-组分SLC7A11的表达抑制细胞对胱氨酸的摄取,导致谷胱甘肽过氧化物酶活性降低,削减细胞抗氧化能力,增强细胞对铁死亡的敏感性。同时,研究发现,在人肿瘤细胞中SLC7A11过度表达,这种过表达能够抑制活性氧诱导的“铁死亡”,同时削弱p53 3KR介导的对肿瘤生长的抑制作用。
2.铁死亡研究思路

3.文献例证
这篇发表于影响因子9.986的“redox biology”杂志的文章首次报道了HSCs中铁死亡的分子机制和信号转导机制。我们发现BRD7-P53-SLC25A28轴在调节肝星状细胞(HSCs)的铁死亡作用中起关键作用。BRD7-P53-SLC25A28轴是肝纤维化的潜在靶点。

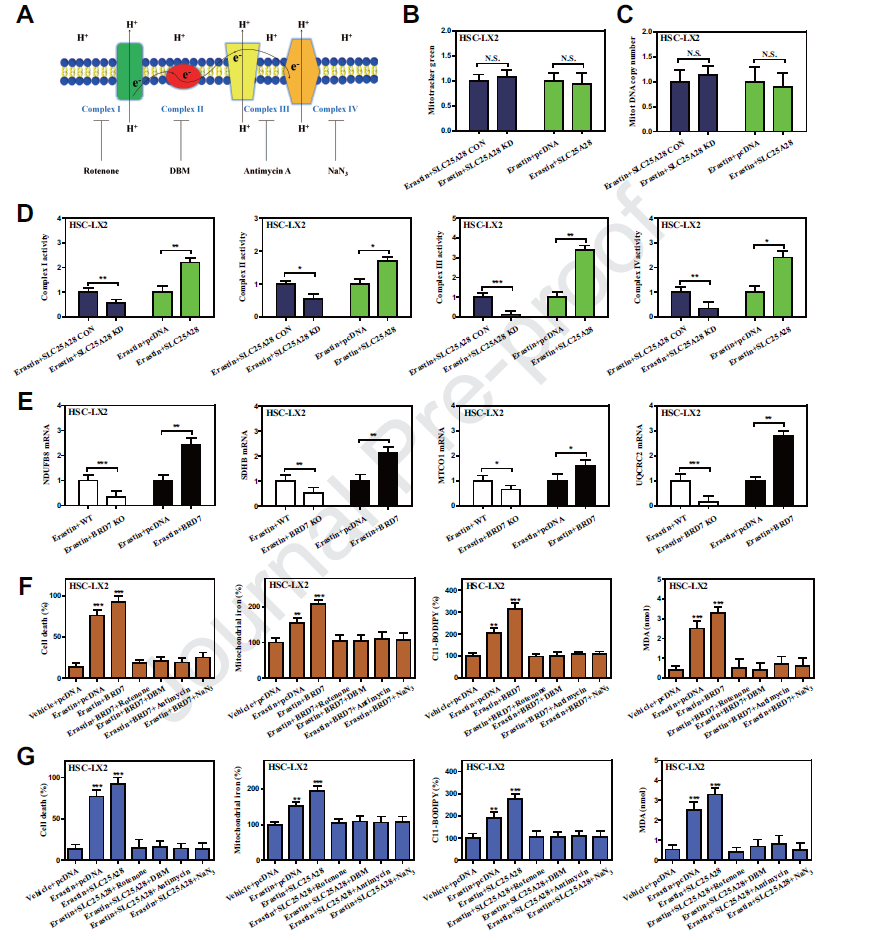
1) HSC铁死亡过程中BRD7蛋白水平上调
BRD7在调控细胞命运中发挥关键作用,涉及细胞生长、凋亡、衰老、焦亡和坏死。但BRD7是否参与HSC铁死亡尚不清楚。在本实验中,BRD7蛋白表达在诱导铁死亡过程中显著上调。MG-132处理显著增加了Xc抑制介导的铁死亡系统中BRD7蛋白的表达。
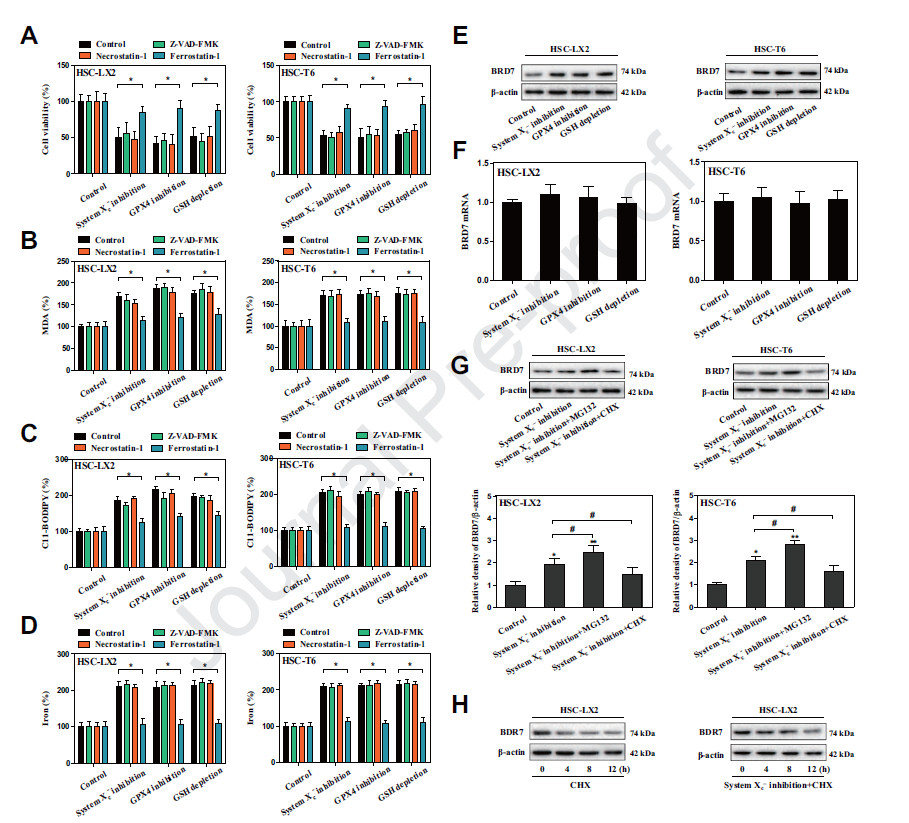
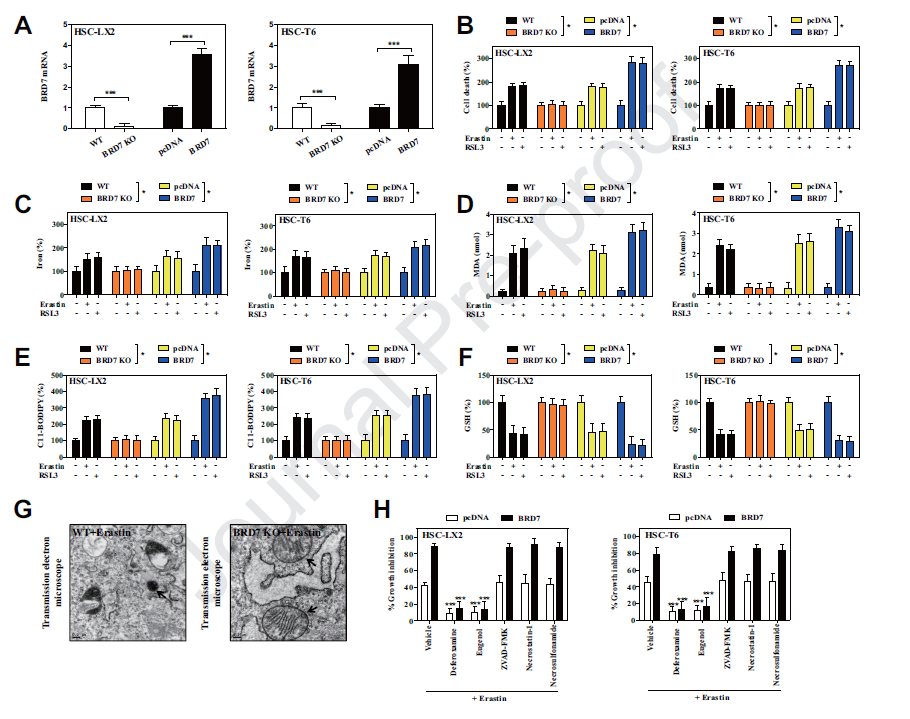
2) BRD7表达上调导致星状细胞铁死亡
为了明确BRD7表达上调是否导致星状细胞铁死亡,我们利用修饰诱导的CRISPR/Cas9系统进行实验。敲除BRD7显著废除了系统Xc抑制或GPX4抑制介导的铁积累、脂质过氧化、脂质ROS生成和谷胱甘肽耗竭。CRISPR/ cas9介导的BRD7基因敲除完全消除了铁细胞的典型变化。此外,几种铁螯合剂去铁胺和脂质过氧化抑制剂丁香酚显著逆转了系统Xc抑制介导的BRD7过表达的HSCs的生长抑制。
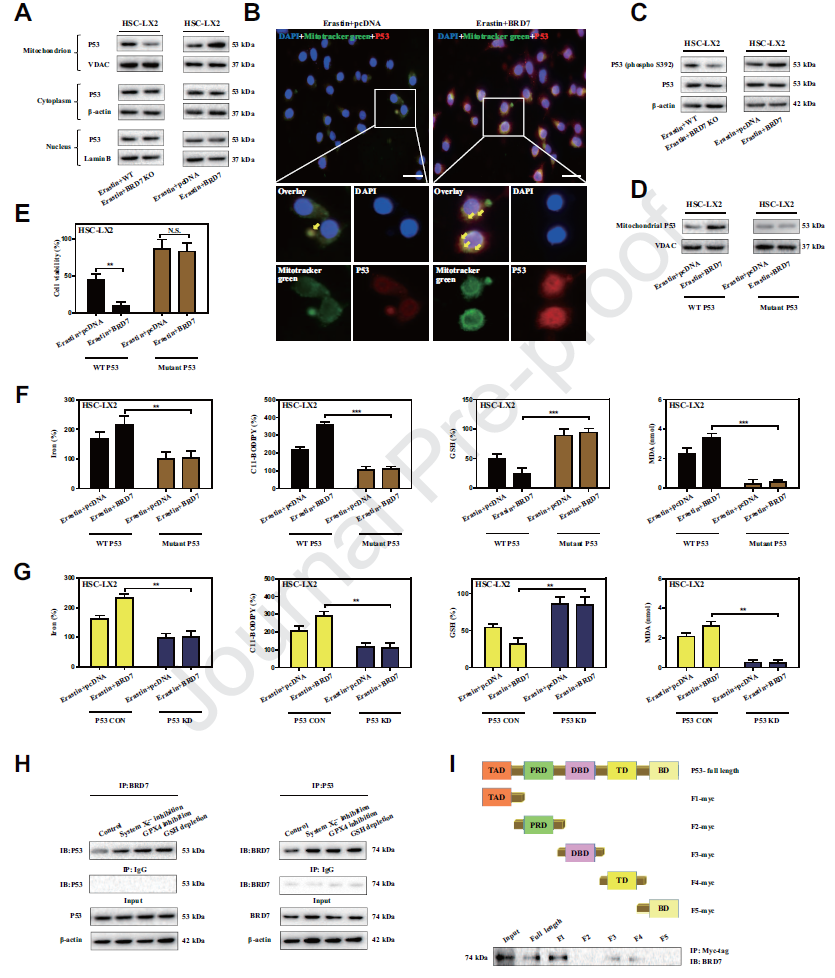
3) 线粒体易位p53介导的BRD7增强星状细胞铁死亡
已有研究表明p53发挥其生物学功能需要BRD7。BRD7的上调是否通过p53依赖机制导致星状细胞铁死亡?我们发现敲除BRD7后,p53在线粒体中的表达显著降低。BRD7敲击促进了HSC 铁死亡过程中p53和线粒体的共定位。BRD7可以通过TAD结构域直接与p53结合。p53线粒体易位可能介导BRD7增强的HSC铁死亡。
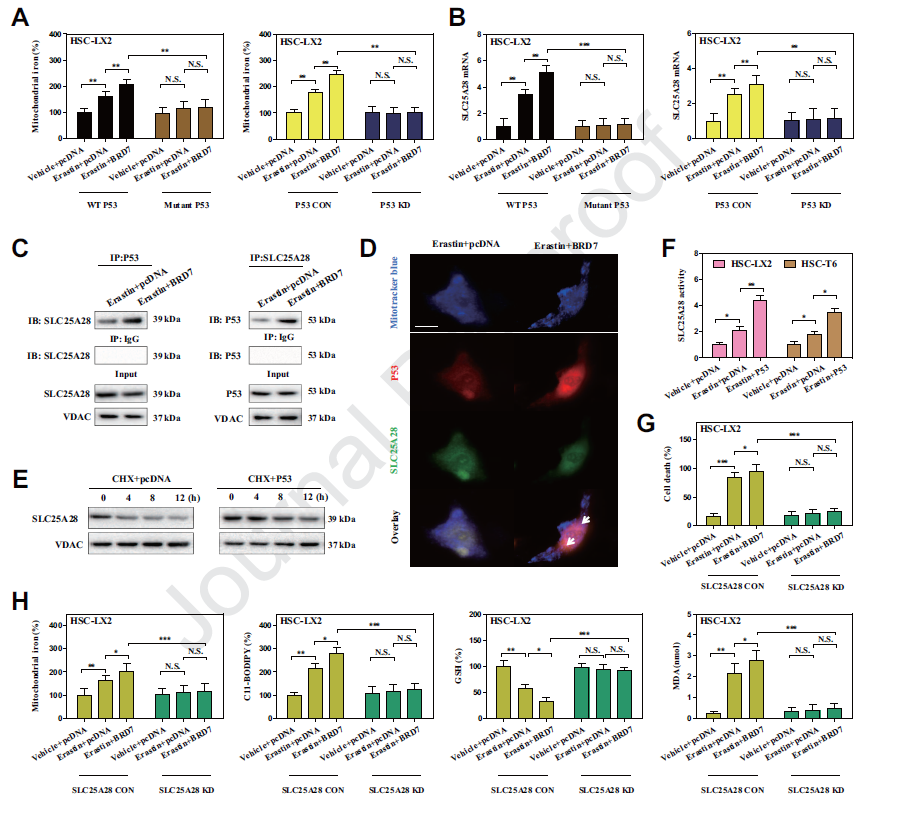
4) 线粒体p53与SLC25A28相互作用,破坏了BRD7增强的HSC铁死亡的铁稳态
线粒体作为铁储存和利用的主要枢纽, p53线粒体易位是否参与了线粒体铁稳态的调节?我们研究表明erastin处理明显增加了线粒体铁含量。而S392A突变体和p53敲低则完全减少了铁细胞的线粒体铁积累。另外,我们在铁运输中鉴定了一个候选靶点SLC25A28。p53 knockin显著增强了铁死亡中SLC25A28的活性。SLC25A28敲除完全消除了线粒体铁的积累,进而损害BRD7 knockin增强的铁死亡。
5) BRD7-P53-SLC25A28轴干扰了电子传递链,加重了BRD7增强的HSC铁死亡的脂质过氧化
铁是铁硫团簇和血红素的重要组成部分,是参与线粒体电子传递链的酶所必需的。我们发现SLC25A28基因沉默显著降低了复合物I、II、III和IV的活性,而SLC25A28 knockin显著增加了这些复合物在铁死亡中的电子传递活性。erastin处理后,NDUFB8(复合物I)、SDHB(复合物II)、707 MTCO1(复合物III)和UQCRC2(复合物IV)在BRD7过表达的HSC-T6细胞中表达显著增加。线粒体复合物I(鱼藤酮)、复合物II (DBM)、复合物III(抗霉素)和复合物IV (NaN3)的抑制剂可使BRD7 knockin、p53 knockin或SLC25A28 knockin增强的铁死亡受到损害。
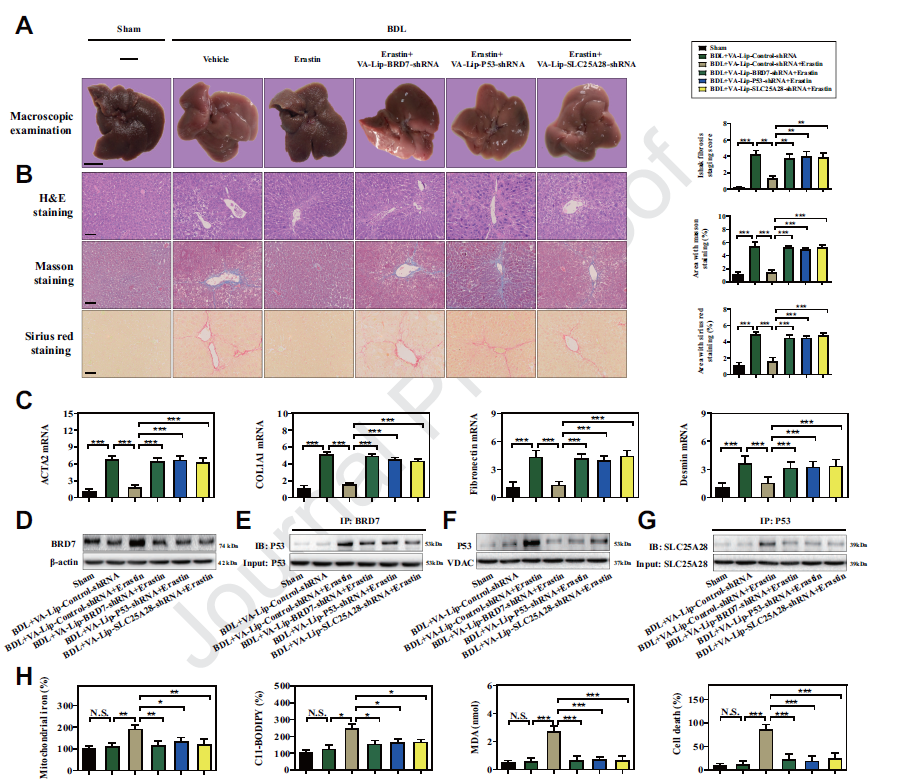
6) HSC特异性阻断BRD7-P53-SLC25A28轴可损害erastin诱导的小鼠肝纤维化中的星状细胞铁死亡
为了评价BRD7-P53-SLC25A28轴是否在体内调节铁死亡,建立了经典的BDL小鼠肝纤维化模型。我们发现模型组小鼠肝脏出现了严重的肝纤维化损伤,但erastin治疗改善了BDL介导的纤维化病理改变。VA-Lip-BRD7-shRNA或VA-Lip-P53-shRNA或VA-Lip-SLC25A28-shRNA治疗后,erastin对肝纤维化的改善作用明显受损。腹腔内注射的erastin显著减少ACTA2,COL1A1,fibronectin和 desmin的表达,但VA-Lip-BRD7-shRNA或VA-Lip-P53-shRNA 751或VA-Lip-SLC25A28-shRNA损害erastin的抑制作用。此外,通过VA-Lip-BRD7-shRNA或VA-Lip-P53-shRNA或VA-Lip-SLC25A28-shRNA特异性阻断BRD7-P53-SLC25A28轴,可以完全消除erastin诱导的BRD7上调、p53线粒体易位、线粒体铁积累、ETC亢进、脂质过氧化和铁死亡。
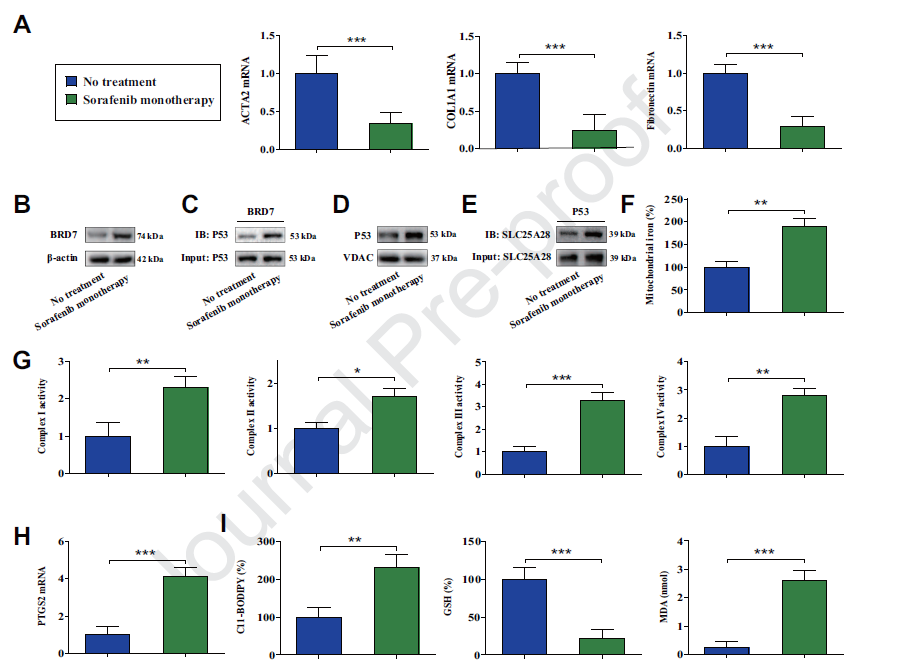
7) BRD7-P53-SLC25A28轴调节索拉非尼治疗的纤维化患者HSCs的铁死亡
为了在临床中验证这一潜在机制,我们分析了肝活检样本。索拉非尼单药治疗显著降低了纤维化标志物ACTA2、COL1A1和纤维连接蛋白的水平。在接受索拉非尼单药治疗后,人HSCs中BRD7水平显著上调。此外,索拉非尼单药治疗促进了BRD7和p53在原发性人HSCs中的结合。索拉非尼单药治疗引起原发性人HSCs中p53线粒体易位、p53与SLC25A28相互作用、线粒体铁积累和ETC亢进。此外,索拉非尼单药治疗可能导致PTGS2的上调和铁中毒事件。
参考文献:Zhang Z , Guo M , Shen M , et al. The BRD7-P53-SLC25A28 axis regulates ferroptosis in hepatic stellate cells[J]. Redox Biology, 2020, 36:101619.






