CircRNA调控肿瘤能量代谢
导语:有氧糖酵解,也称为Warburg效应,是正常细胞和恶性肿瘤细胞之间最显著的差异。肿瘤细胞主要利用糖酵解途径提供能量,提高逃避凋亡、侵袭和抵抗化疗药物的能力。代谢异常是恶性肿瘤的标志之一。环状RNA(circRNA)是一类内源性非编码RNA,在转录或转录后水平调控基因,执行多种生物学功能。circRNA是否参与肿瘤的代谢转化?
参考文献:Shen, S., et al., CircECE1 activates energy metabolism in osteosarcoma by stabilizing c-Myc. Molecular cancer, 2020. 19(1): p. 151. (IF= 15.302)
技术路线:

结果:
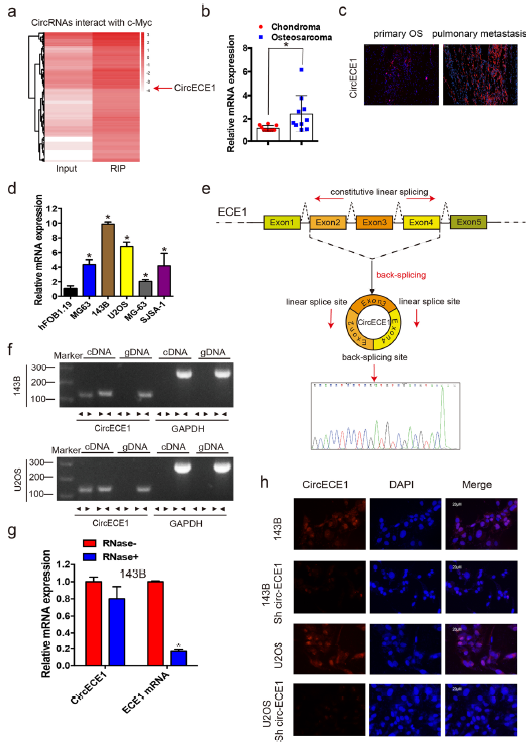
1. CircECE1在骨肉瘤(OS)组织和细胞系中过表达
RNA免疫沉淀用于检测OS细胞系中与c-Myc结合的circRNA,发现hsa_circ_0002402(CircECE1)富集最为显著。CircECE1在OS组织中的表达高于软骨瘤组织,肺转移瘤中CircECE1的表达高于原发性OS组织。CircECE1在OS细胞系中的表达也高于hFOB1.19细胞系,在U2OS和143B细胞中表达最高。CircECE1由位于1号染色体上的ECE1基因生成,用收敛和发散引物、RNase R处理评估CircECE1的环状结构。RNA FISH检测发现CircECE1主要定位于细胞质和细胞核。这些发现揭示了CircECE1在OS组织和细胞系中过表达,并定位于细胞质和细胞核。
2. CircECE1促进OS细胞的迁移和增殖,调控c-Myc功能
使用CCK-8和EDU试验评估细胞活力,发现CircECE1敲除损害增殖,增强了凋亡率,CircECE1过表达促进增殖,显著降低OS细胞的迁移能力,可以通过CircECE1过表达来挽救。这些发现表明CircECE1在体外OS细胞的存活和增殖中发挥作用。
为确定CircECE1是否影响C-Myc功能靶基因。在CircECE1过表达和敲除细胞中分析一些已知的c-Myc靶标(JunB、Mdm2、HIF1α、c-Jun、ELK-1和Cdc25a)的表达,发现几个c-Myc靶标在CircECE1过表达的OS细胞中上调,在CircECE1敲除的OS细胞中下调。c-Myc敲低阻断了由CircECE1过表达诱导的JunB、Mdm2、HIF1α、c-Jun、ELK-1和Cdc25a的上调。说明CircECE1调控c-Myc功能。

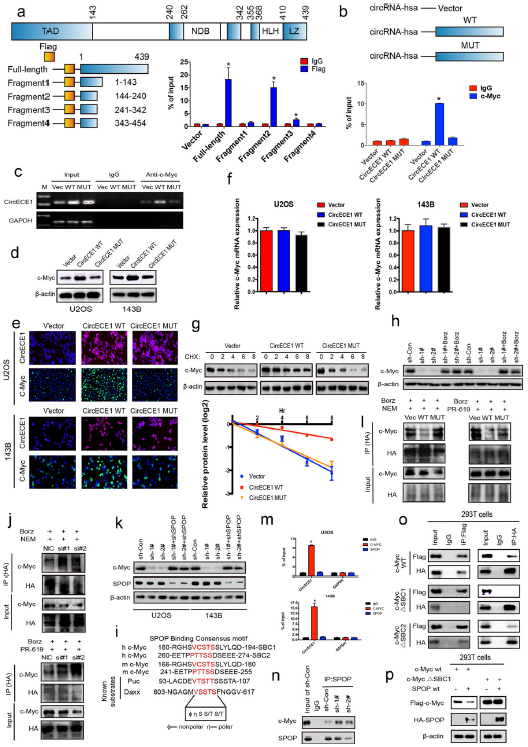
3. CircECE1与c-Myc相互作用,防止其被SPOP降解
HEK-293 T细胞与CircECE1和编码各种c-Myc蛋白片段的载体共转染,证明c-Myc片段2与CircECE1相互作用。CircECE1过表达导致细胞中c-Myc蛋白水平增加。蛋白合成抑制剂CHX处理CircECE1-WT/MUT过表达细胞,用蛋白酶体抑制剂硼替佐米处理CircECE1敲低细胞。CHX处理降低细胞中的c-Myc蛋白,CircECE1 WT细胞中c-Myc的半衰期显著延长。硼替佐米治疗逆转CircECE1敲低诱导的c-Myc蛋白下降。在用NEM(内源性去泛素化酶抑制剂)或PR-619(非选择性去泛素化酶抑制剂)处理后,c-Myc在CircECE1敲除细胞中泛素化更多,在CircECE1过表达细胞中泛素化更少。这些表明CircECE1转录后调节OS细胞中c-Myc水平。
为检测E3泛素连接酶接头SPOP是否参与CircECE1介导的c-Myc表达调控,在CircECE1敲除细胞中敲除SPOP。SPOP敲除消除了CircECE1敲除诱导的c-Myc蛋白水平的下降。
RIP实验显示CircECE1与c-Myc相互作用,但不与SPOP相互作用,Co-IP实验发现CircECE1敲低增强了细胞中SPOP和c-Myc之间的相互作用。这些结果表明CircECE1与cMyc相互作用阻止SPOP介导的降解。
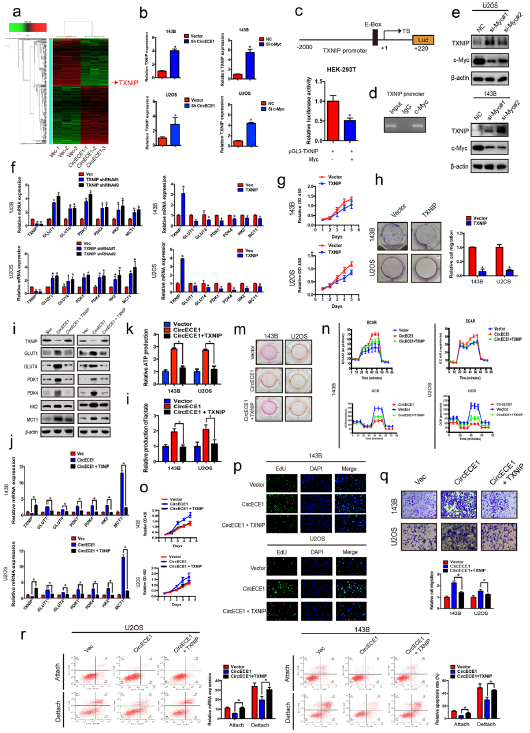
4. CircECE1过表达促进Warburg效应
研究CircECE1是否参与糖酵解和能量代谢。CircECE1失调影响参与葡萄糖摄取、糖酵解和乳酸分泌的各种关键调节因子的表达水平,而CircECE1敲低具有相反的作用。为满足快速增殖和转移的需求,恶性肿瘤细胞依靠葡萄糖代谢产生ATP,CircECE1过表达增加细胞中ATP的产生,增加细胞的线粒体膜电位。在circECE1过表达细胞中,细胞外酸化率(ECAR)和耗氧率(OCR)增加。综上所述, CircECE1在OS细胞的葡萄糖代谢中起着至关重要的作用。

5. c-Myc介导CircECE1在糖代谢中的功能
c-Myc敲除后,与葡萄糖代谢相关的糖酵解酶的表达不能上调。CircECE1 MUT过表达导致ATP生成减少。与CircECE1 WT相比,CircECE1 MUT也降低了细胞的线粒体膜电位,抑制葡萄糖摄取和乳酸生成。这些结果证实c-Myc介导了CircECE1在葡萄糖代谢中的功能。CircECE1 MUT显著抑制OS细胞的增殖和集落形成能力,降低迁移能力,增强了细胞凋亡率。这些表明c-Myc介导了CircECE1在葡萄糖代谢中的功能。

6. TXNIP是OS中CircECE1的靶点
为确定CircECE1介导的糖代谢调节的分子机制,RNA-seq鉴定CircECE1过表达改变的信号通路。TXNIP是差异表达基因之一,是一个公认的糖代谢调节因子,在一些癌细胞中受c-Myc的调控。在两个OS细胞系中,cMyc和CircECE1敲除均显著改变TXNIP mRNA表达,c-Myc抑制TXNIP启动子活性,c-Myc敲低增加细胞中TXNIP蛋白水平。这些发现表明c-Myc阻断TXNIP转录。TXNIP可抑制与葡萄糖代谢相关的糖酵解酶的表达,降低细胞的增殖。CircECE1过表达后TXNIP蛋白水平下降,TXNIP可以在体外逆转CircECE1 WT过表达的影响,包括调节参与葡萄糖摄取、糖酵解、乳酸分泌、ATP产生、葡萄糖摄取、乳酸产生、ECAR、OCR、增殖、迁移和凋亡。TXNIP是CircECE1调节糖代谢的重要下游效应因子。
7. CircECE1在异种移植模型中促进肿瘤生长和转移,增加葡萄糖利用
裸鼠皮下注射CircECE1 WT-或MUT-过表达的143B细胞。与对照或CircECE1 MUT细胞相比,CircECE1 WT细胞具有更高的肿瘤生长率,糖酵解酶的mRNA和蛋白水平在CircECE1 WT组异种移植瘤的组织中显著上调。将同时用发光染料和GFP标记的143B细胞注射到尾静脉接种到肺腔,体内生物发光成像证明CircECE1 WT促进OS细胞原位转移,而CircECE1 MUT细胞不能形成肺转移。IHC测量软骨瘤和OS患者样本中TXNIP和糖酵解酶的表达,发现OS中TXNIP表达降低,糖酵解酶表达增加。这些表明CircECE1通过阻止OS中SPOP降解c-Myc介导能量代谢。







