3D培养模型助力癌症机制的真实揭示
癌细胞重新连接代谢网络,以提供细胞分裂和快速生长所需的能量和生物合成中间体的稳定来源。然而,这会导致产生毒性代谢副产物,包括活性氧(ROS),可促进氧化应激并损害癌细胞活力。因此,选择上调氧化应激防御程序的肿瘤细胞来克服氧化应激的毒性,这是阻碍肿瘤起始和进展的一个重大障碍,转录因子NRF2是氧化应激反应中细胞氧化还原稳态的主要调节因子。NRF2激活可诱导抗氧化剂以及谷胱甘肽(GSH)合成相关酶的表达,并通过调节磷酸戊糖和丝氨酸生物合成途径中的酶促进烟酰胺腺嘌呤二核苷酸磷酸的生成。稳态条件下,NRF2通过直接结合KEAP1在蛋白水平受到严格控制。值得注意的是,在多种类型的人类癌症中经常观察到诱导NRF2组成性激活的NFE2L2(编码NRF2的基因)、KEAP1或CUL3突变。NRF2过度激活与较差的临床预后相关,表明NRF2过度激活的癌细胞具有竞争适合性优势。然而,NRF2过度激活赋予肿瘤细胞生存和增殖优势的分子机制仍不明确。近期,哈佛医学院细胞生物学系Brugge教授及其团队利用肺鳞癌3D球体模型偶联CRISPR-Cas9筛选,研究了NRF2过度激活介导的分子发病机制,为NRF2诱导的表型变化提供了关键的见解,相关文章以“3D Culture Models with CRISPR Screens Reveal Hyperactive NRF2 as a Prerequisite for Spheroid Formation via Regulation of Proliferation and Ferroptosis”为题发表在Molecular Cell杂志上,杂志影响因子15.584。
技术路线:

结果:
1、与2D单层细胞模型相比,肺癌细胞的3D球体模型更依赖于NRF2进行存活和增殖
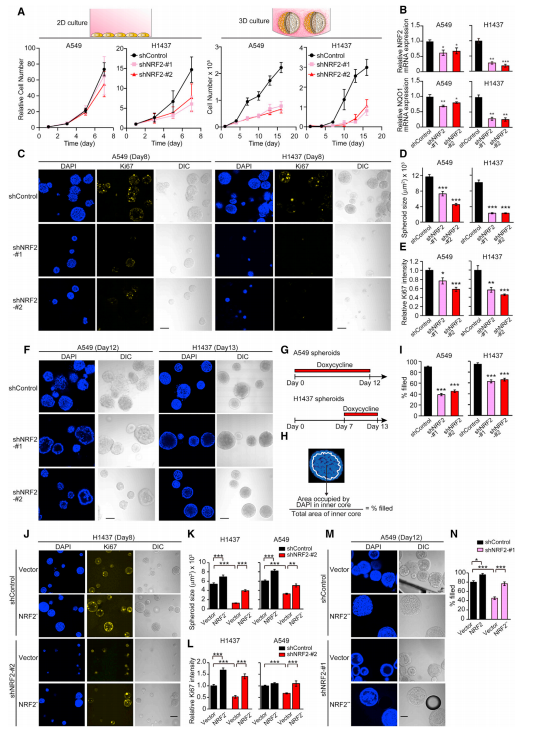
为了检测NRF2下调在传统的2D单层和3D球体培养中的作用,作者建立了A549和H1437非小细胞肺肿瘤细胞系,在多西环素的控制下表达两种不同的、可诱导的靶向NRF2 mRNA的shRNAs,发现与2D单层培养相比,NRF2下调导致3D培养中细胞数量显著减少(图A),且发现H1437和A549细胞中细胞数量减少程度的差异与NRF2表达和NRF2活性的降低有关(图B)。在3D培养中生长8天(即早期阶段)后,NRF2敲低的球体比没有敲低的球体小(图C,D)。此外,在NRF2敲除的球体中,细胞增殖标记物Ki67的免疫荧光染色也降低(图C,E),表明NRF2调控3D培养球体的增殖。在3D培养中生长12天(即晚期)后,NRF2敲除诱导A549球体中内部基质剥夺细胞的死亡(图F–I),表明NRF2控制了球体形成晚期内基质剥夺细胞的存活。NRF2敲除诱导的表型是靶向的,因为shNRF2不能靶向NFE2L2突变体(NRF2*和NRF2**)(图J–N)。
2、肺癌球体需要高NRF2活性
为了获得NRF2基因标记,作者在癌症基因组图谱(TCGA)项目中挖掘了NRF2通路中具有频繁基因改变的四种癌症类型(LUSC、LUAD、头颈部鳞状细胞癌和宫颈鳞状细胞癌)的主要患者数据,鉴定了1466个基因,这些基因在NRF2通路中有NRF2过度激活基因改变(NFE2L2突变/扩增或KEAP1或CUL3突变/缺失)的肿瘤中的表达显著高于或低于无NRF2过度激活基因改变的肿瘤(图A),获得了55基因的NRF2签名(图B,2C)。NRF2标记基因的中位数标准化表达值被用作“NRF2评分”,作为一组癌细胞系NRF2过度激活的指标(图C)。与3D培养的NRF2敲低数据一致,NRF2评分较低的肺癌细胞系不能有效形成球体,表明肺癌细胞系的NRF2评分与球体大小相关(图D,E)。值得注意的是,在NRF2途径中没有基因改变但表现出较高NRF2评分的细胞系(即H520和SK-MES-1细胞)形成了球体,在NRF2途径中有基因改变但表现出较低NRF2评分的细胞系(即H23细胞)没有形成球体。有趣的是,一小部分表现出中间NRF2评分的H596细胞形成了球体,但表现出很强的内部细胞清除率(图D)。因此,高NRF2活性对于瘤球体形成是必要的,至少在肺癌细胞系中是如此。
为进一步研究NRF2过度激活对球体形成的影响,作者通过CRISPR-Cas9证实KEAP1敲除增加了NRF2蛋白的表达和活性(图F),且KEAP1敲除增加了两种细胞系中球体的大小(图G–J),减轻了H596细胞中内球体细胞的死亡(图I和J),表明高NRF2活性可以促进肺癌细胞中高效的球体形成。

3、抗氧化剂不能挽救NRF2下调引起的增殖缺陷
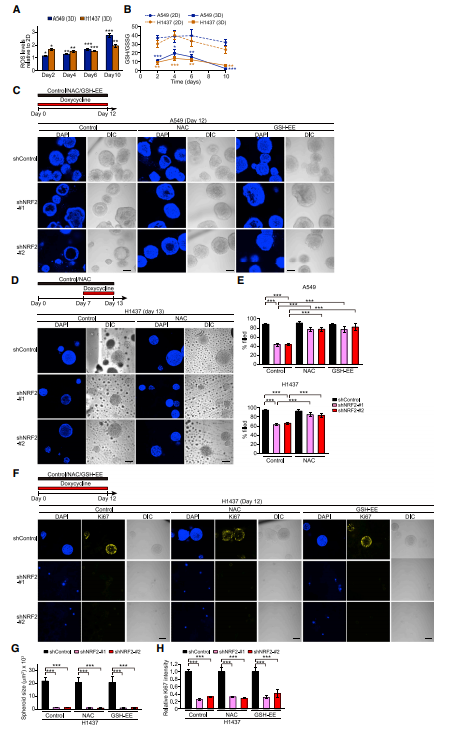
鉴于NRF2调节细胞抗氧化序,作者研究了2D与3D培养条件下的细胞氧化还原状态。相对于2D培养,3D培养显示ROS水平增强和GSH/GSH二硫化物(GSSG)水平降低(图A,B),表明与单层细胞相比,球体细胞受到更多的氧化应激。接下来用抗氧化剂NAC或GSH-EE处理,发现NRF2敲除后A549和H1437球体模型内部细胞的存活率显著增加(图C-E)。相反,基于Ki67信号或H1437球体的大小,这些抗氧化剂并不能挽救NRF2缺失导致的球体增殖抑制(图F–H),表明抗氧化剂反应不足以促进NRF2介导的球体增殖。因此,这些结果表明NRF2通过不同的机制调节肺癌球体中内部细胞的存活和增殖。
4、CRISPR-Cas9筛选NRF2过度激活诱导球体生长的关键基因
为了确定介导NRF2过度激活诱导球体生长的关键基因和/或程序,在A549和H1437细胞中进行了CRISPR-Cas9筛选,选择最有可能在NRF2过度活化的肿瘤中发挥作用的基因,即与人类肿瘤中NRF2过度活化的基因改变显著相关的基因(A),通过去除肺肿瘤或KEAP1/CUL3/NFE2L2改变的细胞系中低水平表达的基因和与NFE2L2共扩增或与KEAP1/CUL3共缺失的基因,绘制列表(图B),总计14058个sgRNA靶向大约1500个基因(图B)。作者在2D和3D培养条件下同时在A549和H1437细胞中进行合并的CRISPR-Cas9筛选(图C),与2D培养条件相比,3D条件下两种细胞系中富集或耗尽(D)。值得注意的是,在3D培养条件下最一致和显著的命中表示更大的依赖性,包括富集靶向TSC1的sgRNA和耗尽靶向GPX4的sgRNA。

5、铁死亡对瘤球体增殖和内部细胞存活的影响
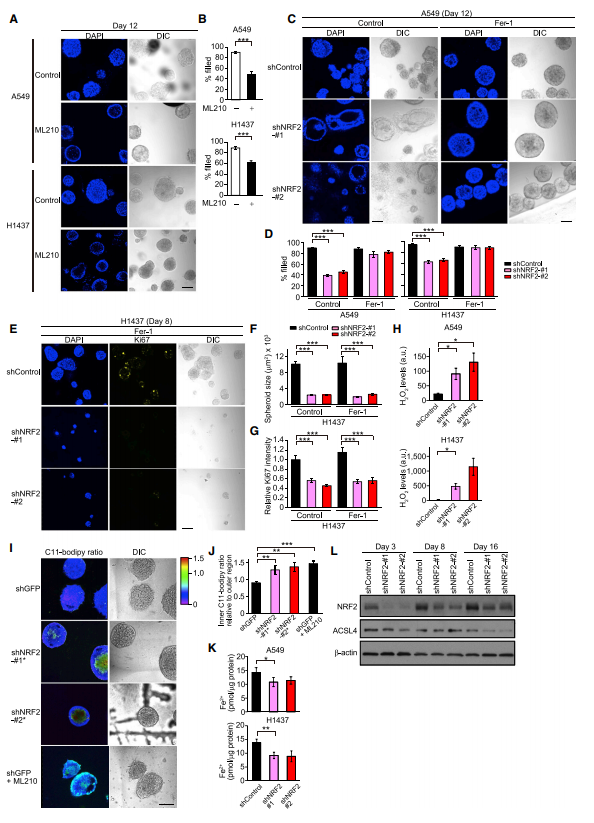
A549和H1437细胞中最显著的脱落打击是GPX4,形成球体后,用GPX4抑制剂ML210处理的球体显示A549、H1437和H520细胞内腔空间的细胞存活率下降(图A,B)。为了阐明与NRF2敲除球体内部细胞死亡是否由铁死亡介导,在Fer-1(铁死亡抑制剂)存在的情况下培养A549和H1437球体,发现Fer-1处理阻止NRF2敲除球体内部细胞死亡(图C,D),提示NRF2通过保护铁死亡调节内部细胞存活,然而用Fer-1处理球体并不能增加球体大小(图E–G),这表明NRF2介导的增殖调控并不涉及对铁死亡。NRF2敲除增加了A549和H1437球体中H2O2的水平(图H),表明NRF2通过降低细胞ROS水平抑制脂质过氧化。值得注意的是,通过BODIPY测定发现NRF2敲低以及ML210处理显著增加了球体内部的脂质过氧化物水平(图I,J),表明球体内部细胞容易受到脂质过氧化的影响,NRF2能调节球体的脂质过氧化。NRF2敲除没有增加细胞内Fe2+和ACSL4的表达水平,(图K,L),表明NRF2敲除的细胞对铁死亡的敏感性增加不是由于Fe2+或ACSL4。这些结果表明NRF2通过球体中抗氧化剂依赖的途径调节内部细胞的存活。
6、NRF2和GPX4之间的关系
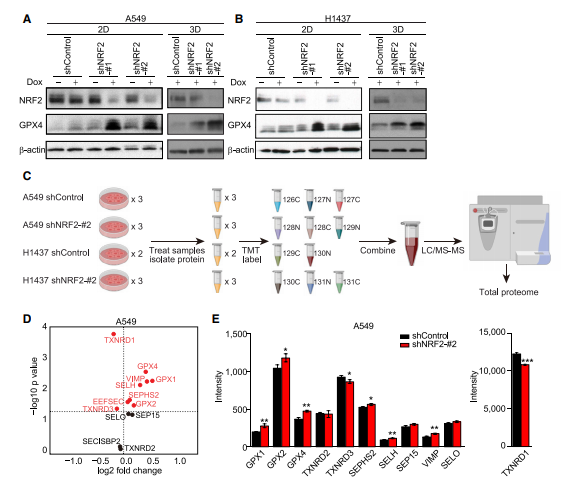
作者检测了NRF2下调细胞中的GPX4水平,发现在2D和3D培养条件下,NRF2下调显著增加了GPX4水平(图A,B)。作者通过等压串联质量标签(TMT)标记结合液相色谱-串联质谱(LC-MS/MS)分析(图C),发现大多数检测到的硒蛋白在NRF2下调后表现出表达增加(图D,E)。这表明NRF2敲除后GPX4的表达增加并不是特有的。相反,TXNRD1,一个真正的NRF2靶基因,在NRF2敲除后强烈降低,即使TXNRD1也是一种硒蛋白(图E),推测NRF2敲低细胞中TXNRD1蛋白水平的降低会增加其他硒蛋白的硒利用空间,导致增加硒蛋白的表达。
7、靶向NRF2和GPX4导致肺癌球体中大量细胞死亡
鉴于球体细胞表现出更高水平的脂质过氧化,作者观察到NRF2下调增加GPX4的表达,球体内外细胞可能具有不同的氧化应激能力,用ML210处理NRF2敲除的球体导致球体内部和外部细胞死亡(图A,B)。接下来研究了NRF2下调联合GPX4活性抑制在3D培养中是否具有特异性致死性,或者这种组合在2D培养条件下是否也对细胞具有致死性,发现A549细胞即使在2D培养条件下无基因操作也对ML210敏感,而H1437、H520和SK-MES-1细胞不太敏感或不敏感(图C,左图)。在2D培养中,NRF2下调使A549、H1437、H520和SK-MES-1细胞对ML210轻微敏感(图C,左图)。在3D培养中,shNRF2的诱导使细胞对ML210更敏感(图C,右图)。在2D和3D培养条件下,与Fer-1共同处理可完全挽救对ML210的敏感性(图D,E)。KEAP1敲除增强了ML210处理的H596细胞中球体内部细胞的存活率(图D),这揭示了NRF2在NRF2过度活化的肺癌细胞系中的作用。作者评估了NRF2和GPX4联合缺失是否加剧了脂质过氧化以增强细胞死亡(图F,G),在shGFP转导的对照A549球体中,ML210处理增加了脂质过氧化,特别是在球体内部区域。在NRF2敲除的A549球体中,ML210处理增加了球体内外区域的脂质过氧化,尽管与球体外区域相比,内区域的诱导更显著。有趣的是,ML210处理的NRF2敲低球体外部的脂质过氧化水平与无ML210处理的NRF2敲低球体和有ML210处理的shGFP球体内部的脂质过氧化水平相当(图7G)。因此,需要多种氧化应激防御程序的联合靶向作用来高效杀死肿瘤细胞。

结论:
1.NRF2是肺肿瘤球体增殖和存活所必需的。
2.NRF2阻止内部基质剥夺瘤球体的铁死亡。
3.NRF2通过改变晒利用调控硒蛋白的表达。
4.靶向NRF2能够有效杀死瘤球体细胞。
参考文献:
Nobuaki T, Patricia C, Laura MS, et al. 3D Culture Models with CRISPR Screens Reveal Hyperactive NRF2 as a Prerequisite for Spheroid Formation via Regulation of Proliferation and Ferroptosis. Molecular Cell. 2020.






