细胞外囊泡测序和反卷积模型预测追踪黑色素瘤检查点阻断
免疫检查点抑制剂(ICI)为疾病治疗带来了希望,但是大多数患者不响应ICI。作者鉴定验证来源于细胞外囊泡(EV)的生物标志物,允许无创监测肿瘤内在和宿主免疫状态,以及预测ICI反应。最终证实,EVs作为一种非侵袭性生物标志物,联合探测ICI的肿瘤内在和免疫改变,作为ICI反应的预测标志物,监测肿瘤的持久性和免疫激活。本文于2020年11月发表于SCIENCE ADVANCE,影响因子13.116。
技术路线如下:

主要结果如下:
1、肿瘤与EV RNA的一致性
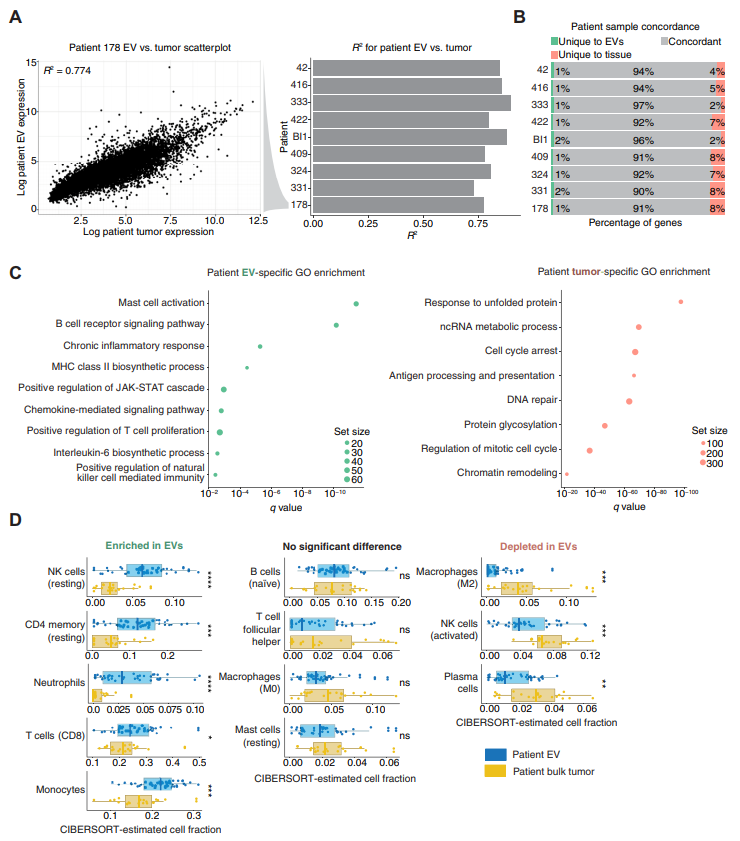
为了确定患者血浆来源的EV是否与肿瘤表达谱相关,作者分析了9个患者的配对EV和肿瘤组织的表达谱,结果显示两个表达谱的相关性很高,R2为0.82(图1A)。相关性分析表明,大多数存在于肿瘤的基因也存在于EV中(图1B)。通过GAGE进行基因集富集分析,发现仅在EV中显著富集免疫相关特征,如T细胞激活和NK细胞激活,而肿瘤特异的转录本富集于代谢和肿瘤相关途径(图1C)。为了确定EV中所代表的细胞群,使用CIBERSORT来推断患者EV中免疫细胞类型的富集。作者观察到有5种免疫细胞亚群特异性存在于EV中(中性粒细胞,NK细胞,CD4+/CD8+T细胞),而EV中巨噬细胞/肥大细胞相对消耗,这些表明EV是被过度富集用于免疫人群对抗程序性细胞死亡(PD1)响应很重要的信号。总之,这些结果使得作者猜测患者治疗前和治疗中的EV转录本可用于预测或反映ICI抗性。
2在处理后EV表达谱中,对有反应者和无反应者进行分层的生物途径和基因
鉴于肿瘤治疗后的特征比预处理值更能代表ICI响应,作者将处理后的EV转录本和ICI响应进行关联。通过分子特征图谱使用不同的基因集进行基因集变异分析,作者观察到258个途径显著区别开响应者和非响应者,其中有25个在验证队列中显著,如图2A,包括T细胞受体,CTLA4, TGF-beta,SMAD2/3, Notch,肿瘤坏死因子受体2,血管表皮生长因子受体都涉及了ICI抗性和黑色素瘤进展。根据纵向数据,作者通过单样本GSVA可视化了处理途径的动力学并观察到在非响应者处理中T细胞受体途径激活下降(图2C)。在基因水平,有1240个正常的和43个FDR校正的DEGs在发现的队列中,在验证的队列中有514个正常的和3个DEGs。80个DEGs共享了成功的P值验证,47个DEGs在P值、最小表达和log fold change水平成功复制(图2C)。大量共享的DEG反映出基因集富集,包括KLF10和WNT8B。作者检测了睾丸癌抗原(MAGEA1 and MAGEA3),在处理中的这4个DEGs都表现出时间动态相对于在第一次收集的标准化表达变化(图1D)。
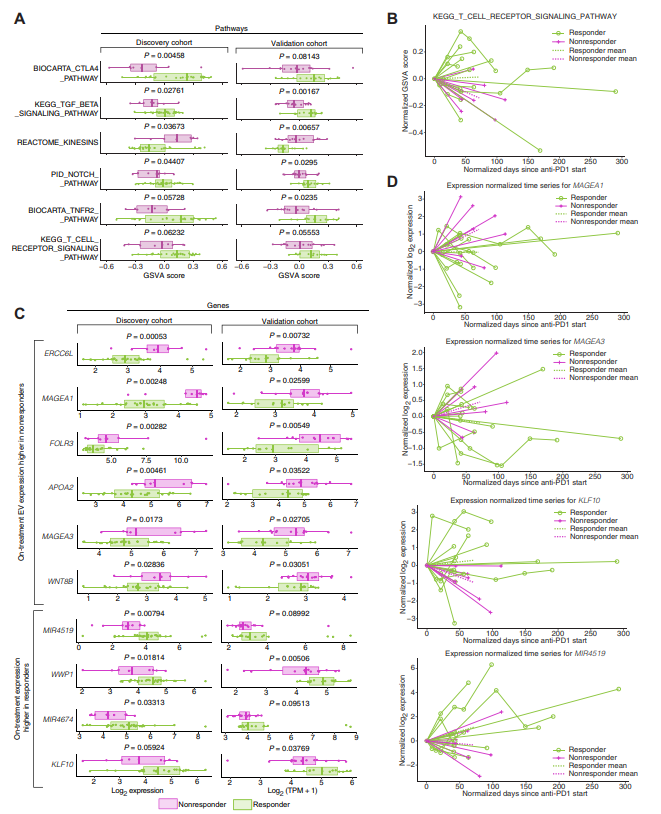
图2在处理后EV表达谱中,对有反应者和无反应者进行分层的生物途径和基因
3在预处理的EV表达谱中,有反应者/无反应者的分层生物途径和基因
作者评估了预处理的EV转录本是否是区分响应者和非响应者的,通过执行基因集富集使用GSVA,显示101差异表达的MDigDB途径在发现的队列,其中26在验证队列重复(图3A)。与处理中的途径相比,Notch和TGF-beta途径在发现的队列中差异,MAPK-ERRB4和角质化也观察到差异。DEGs在内的成员包括免疫和肿瘤相关途径反映出ICI抗性或肿瘤生长,如CD1A,MAPK2K4,TRBV7-2,和IGFL1(图3B)。作者随后使用最好性能的超级参数集去评估参评集的性能。通过总计所有100个指标的结果,作者构建了ROC曲线反映了训练交叉检测性能和参评集性能(图3C)。为了评价二分类精度,使用AUROC,这是一个二元分类器,可以将随机选择的有反应的病人排在随机选择的无反应的病人前面。作者观察到多个验证的DEGs (IGFL1、TFF2和MAP2K4)在无进展或总生存率中显示显著分层(图3D)。

图3在预处理的EV表达谱中,有反应者/无反应者的分层生物途径和基因
4、EV表达谱的反卷积和RNA-seq表达谱中驱动突变的分析
对肿瘤来源EV和非肿瘤来源EV的贡献进行分析,可能揭示反应相关的变化是反映了肿瘤微环境的变化还是非肿瘤的变化。因此,作者建立了一个概率反卷积模型来进行推断,其模型示意图如图4A所示。为了评估模型预测的准确性,分析了参与EV功能或免疫治疗反应的已知基因(图4B),其次是在处理前和处理后的时间点的DEGs的分析(图4C)。该模型还探索了跨基因集的富集,并计算了一个基因集水平的肿瘤片段,显示了肿瘤来源转录本的显著富集(图4D)。在评估ICI和黑素瘤相关的KEGG途径,模型结果与预期排序一致,例如与黑素瘤相关的途径具有更高的肿瘤分数(图4E)。经验证的预处理的DEGs富集了肿瘤来源的基因,为治疗时的DEGs在非肿瘤方面有更大的贡献(图5F)。这些结果表明处理中的DEGs优先反映ICI诱导的改变。
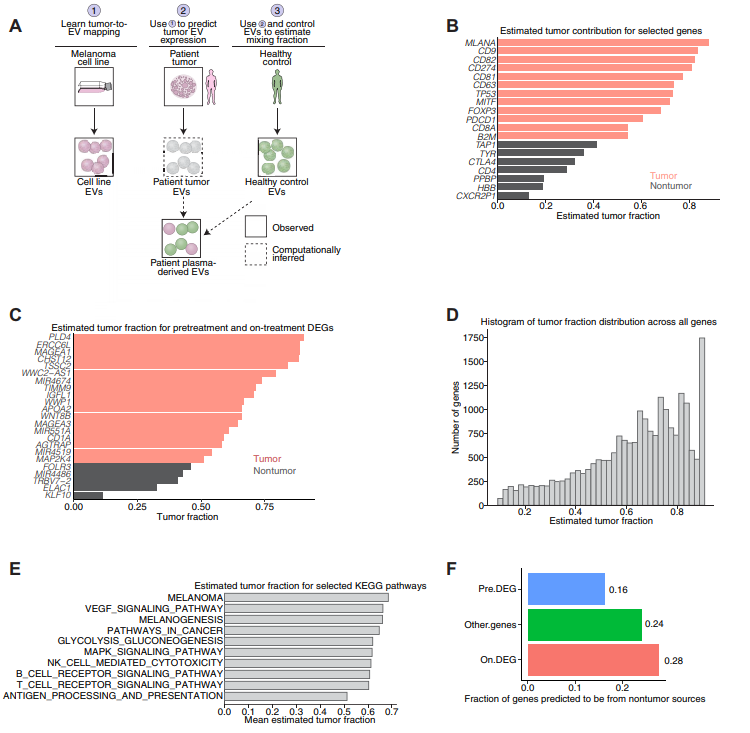
图4 EV表达谱的反褶积和RNA-seq表达谱中驱动突变的分析
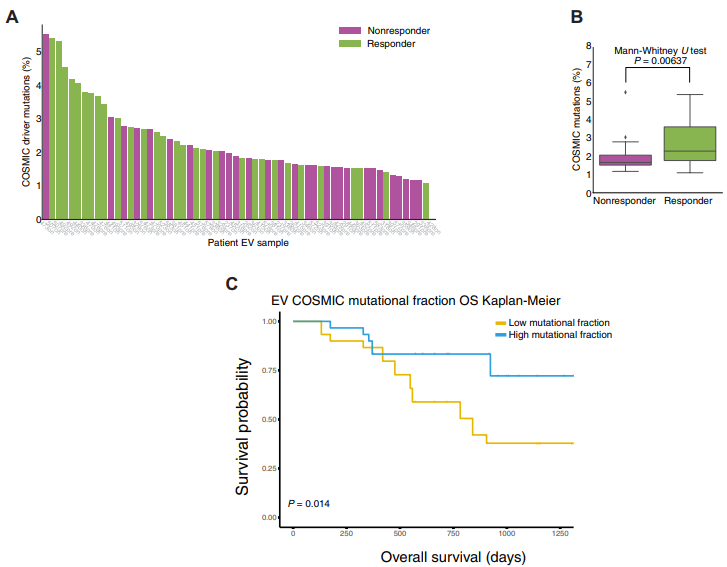
5、比较响应者和非响应者间COSMIC突变驱动的装载
相对于总体突变库的癌症体细胞突变目录(COSMIC)数据库可归因于体细胞突变量的变化,而不是种系突变的差异。作者观察到响应者的COSMIC驱动程序体细胞突变率明显高于无反应者(图5A和5B)。这也反映在生存分析中,如图5C,可以观察到在高COSMIC突变率(队列中前50%)的患者与低COSMIC突变率的患者之间显著分层(图5C),高突变分数的患者总体存活时间更长。这表明EV RNA-seq癌症驱动信息对于预测ICI治疗的长期疗效可能比短期疗效更有效。
总之,EV表达谱揭示了ICI耐药性和黑色素瘤进展的驱动因素,及表现出差异表达的基因/途径,并与ICI的临床反映相关。非卷积模型估计了肿瘤和非肿瘤来源的贡献,从而能够解释差异表达的基因/途径。EV RNA-seq突变也区分了ICI反应。EV可以作为非侵袭性生物标志物去共同探测肿瘤内源性及对ICI的免疫变化,也可作为ICI反应性的预测标记,并监测肿瘤的持久性和免疫激活。
参考文献:
Shi Alvin., Kasumova Gyulnara G., Michaud William A., Cintolo-Gonzalez Jessica., Díaz-Martínez Marta., Ohmura Jacqueline., Mehta Arnav., Chien Isabel., Frederick Dennie T., Cohen Sonia., Plana Deborah., Johnson Douglas., Flaherty Keith T., Sullivan Ryan J., Kellis Manolis., Boland Genevieve M.(2020). Plasma-derived extracellular vesicle analysis and deconvolution enable prediction and tracking of melanoma checkpoint blockade outcome. Sci Adv, 6(46), undefined. doi:10.1126/sciadv.abb3461






