帕金森病的幕后黑手circSLC8A1与氧化应激
环状RNA(circRNA)大量存在于大脑中,但绝大部分功能未知。为了寻找它们在帕金森疾病(PD)中的功能,作者对PD捐赠患者和对照供体大脑的不同脑区域组织进行RNA测序,筛选出与PD相关的circRNA和脑组织。本文于2020年9月发表在《EMBO Molecular Medicine》IF:8.821期刊上。
本文技术路线如下:

主要结果如下:
1、研究PD大脑circRNA的基因组资源
为了确定大范围的基因表达和circRNA表达谱,特别是circRNA在PD个体特定脑区中是如何发生改变的,作者对PD患者和健康人的杏仁核(AMG),黑质(SN)和内侧颞肌脑回(MTG)进行了测序。最初的非监督层次聚类的样品异质性分析显示MTG和ATG样品的大量集群不能区分PD和对照患者(Figs 1A and B)。这可能反映了个体间的异质性。但SN脑区的基因表达可以区分PD和对照,这可能反映了由于SN中多巴胺能神经元缺失而导致的基因表达的更大差异(Figs 1C)。相一致的,酪氨酸羟化酶(TH)的水平在PD SN样本中显著下降,与PD时该脑区多巴胺能代谢的主要减少相匹配(Fig 1D)。
随后作者对差异表达基因(DEG)进行了GO分析,结果显示主要富集与细胞粘连,多巴胺生物合成过程等(Fig 1E)。随后作者使用单细胞RNA测序数据确定表达这些DEG的细胞类型,发现这些DEG转录本主要表达在内皮细胞、少突胶质细胞和星形胶质细胞比神经元和小胶质细胞表达更高的比例(Fig 1F and G)。此外,SN神经元特异性DEG在PD中显著减少,少突胶质细胞和小胶质细胞表达基因有增加的趋势,可能反映了炎症的升高。
为了寻找特异性DEG的共表达基因,进行了WGCNA分析,结果显示基因被分成15个不同的模块,并评估了模块与性别,年龄,脑区等特征的关系。还鉴定了几个模块与特征的相关性,如Fig 1I所示,蓝色模块与脑区具有相关性,青色模块与性别相关。通路分析和对组织相关模块丰富GO项的搜索进一步发现了各种神经元和突触功能项,并将疾病相关模块与转录调节、RNA加工和线粒体联系起来(Fig 1J)。这些结果可以确定PD大脑中circRNA水平的潜在变化。

Figure 1脑区域特异性mRNA表达谱显示多细胞PD相关过程
2、SN表现出独特的受PD影响的circRNA表达谱
外显子环化反映了线性和反向剪接过程的选择(Fig 2A)。为了鉴定PD中发生改变的circRNA,使用两种不同的方式进行circRNA鉴定和定量。结果发现3407个只在PD大脑中表达的circRNA,1028个只表达于健康人的(Fig 2B)。重要的是,2755个circRNA存在于所有的脑区,但2914,3918,2483个circRNA分别只存在于AMG,SN,MTG中(Fig 2C)。无监督分层PCA聚类将SN circRNA和AMG,MTG的区分开来,和之前的DEG类似(Fig 2D)。此外,分别有26%的circRNA和mRNA特异性只存在于SN中,而只有19%的circRNA存在于所有组织,但有82%mRNA同时存在于所有组织(Fig 2E and F)。随后,作者对表达这些差异circRNA的细胞进行分类,发现这些circRNA主要由神经元,少突细胞和星形胶质细胞表达(Fig 2G),表明在这些组织中circRNA多由这几类细胞表达。
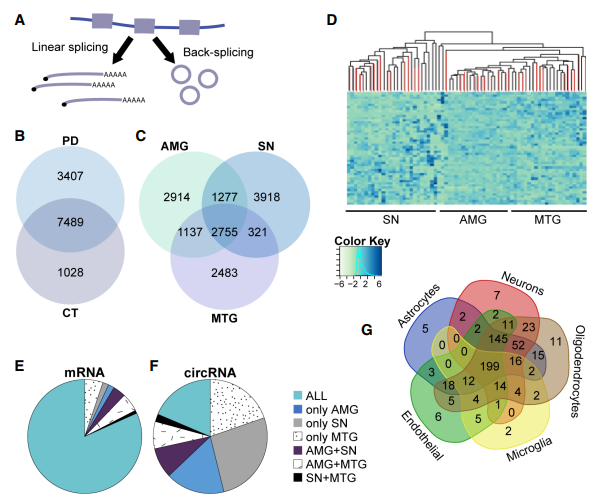
Figure 2 CircRNA丰度具有脑区依赖性和PD修饰性
在健康供体中,SN表达circRNA的总数目显著高于MTG和AMG,这暗示着SN细胞拥有circRNA生物发生的特定调控模式(Fig 3A);当与健康供体相比,可以发现circRNA的数目在PD患者的MTG和AMG显著升高,而PD患者的SN中显著减少(Fig 3A)。这些可能与PD患者的SN中的神经元细胞丢失相关并可能是继发性的,以及/或该脑区域的剪接事件的改变。随后计算了Alu编辑指数,它代表了所有RNA样本中所有表达Alu序列的加权平均编辑水平。结果显示,与其他大脑区域相比,SN的整体编辑水平较低(Fig 3B)。这些差异是RNA编辑活性的结果。还观察到在个体样本中,RNA编辑水平和circRNA的数量呈负相关(Figs 3D)。虽然从对照到PD样本ADAR1水平没有变化,但对不同组织分别进行探查发现,SN中ADAR1水平较其他组织低(Fig 3E)。因而认为RNA编辑和RNA环化在PD和对照组的脑的几个区域中是负相关的。
接下来验证circRNA积累与年龄的关系,结果在健康SN中发现circRNA积累与年龄正相关,但在PD患者的SN中 circRNA积累与年龄负相关(Fig 3F and 3G)。这些差异可能是由于circRNA在SN中的整体合成或降解速率的差异。但是circRNA积累和年龄的相关性在病变组织中并为观察到,提示这种SN中circRNA积累和年龄的特异性相关反应了PD中多巴胺能神经元的大量丢失,尽管不能排除次生效应。差异表达分析鉴定到了24个差异表达的circRNA,并表明circSLC8A1在PD中显著上调从而引起了作者的兴趣(Fig 3H)。这些结果表明,相对于其他被测的大脑区域,circRNA在SN中受到独特而强烈的调控,并提示了circRNA在PD中可能受到损害的潜在年龄相关作用。
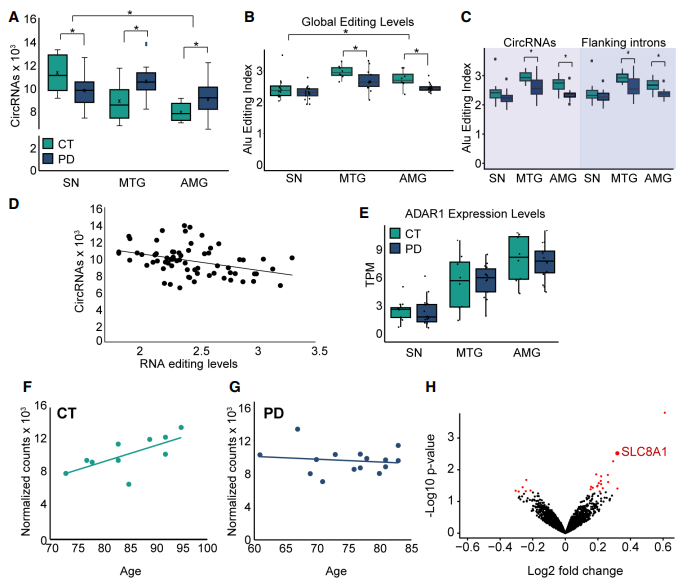
Figure 3 circRNA丰度在PD SN中降低,与RNA编辑水平呈负相关
3、CircSLC8A1在PD脑中上调
CircSLC8A1,在PD SN中显著上调,起源于神经表达的SLC8A1基因,它编码一个Ca2+/Na+转运体,有助于平衡细胞质Ca2+水平和监控Ca2+依赖的神经传递(Fig 4A and B)。不同于circSLC8A1在PD SN中显著上调,线性的SLC8A1 mRNA在CT和PD之间没有明显差异(Fig 4C and 4D)。circSLC8A1的表达与性别无关,但在健康的SN中与线性mRNA的表达呈正相关,而在PD中这种相关性丢失了(Fig 4E-G)。这些表明疾病诱导的circSLC8A1下降的调控超过了circSLC8A1生产和/或破坏。
4、氧化应激使神经元的circSL8A1升高,并减少SLC8A1蛋白质
百草枯(PQ)已知会增加PD的风险,作者将神经细胞暴露于PQ中,结果发现PQ暴露选择性诱导了circSL8A1的剂量依赖性升高,但对其余的circRNA的表达没有显著影响,暗示氧化本身可能会增加神经元中circSLC8A1的环化或减少circRNA的降解(Fig 4H)。还观察到SLC8A1的蛋白水平呈剂量依赖性下降,尽管SLC8A1 mRNA水平不变(Fig 4I and J)。这可能反映了在24小时内该蛋白降解速率加快和/或转译速率降低。

Figure 4 PD脑中的CircSLC8A1升高,PQ暴露时伴有SLC8A1蛋白的抑制
考虑到PQ对circSLC8A1水平的强烈影响,作者想知道两种已知的PD保护剂,降胆固醇药辛伐他汀和已知的LRRK2抑制剂PF-06447475是否会以相反的方式改变circSLC8A1。事实上,两种神经保护剂均能显著降低circSLC8A1的表达,也观察到线性SLC8A1 mRNA水平下降(Fig 5A),这导致他汀类药物治疗的SH-SY细胞中SLC8A1蛋白水平下降(Fig 5B and C)。免疫染色显示,在他汀类药物作用下,SLC8A1免疫标记蛋白的细胞质表达较低。结论是,在神经保护细胞中,SLC8A1和circSLC8A1水平都下降。
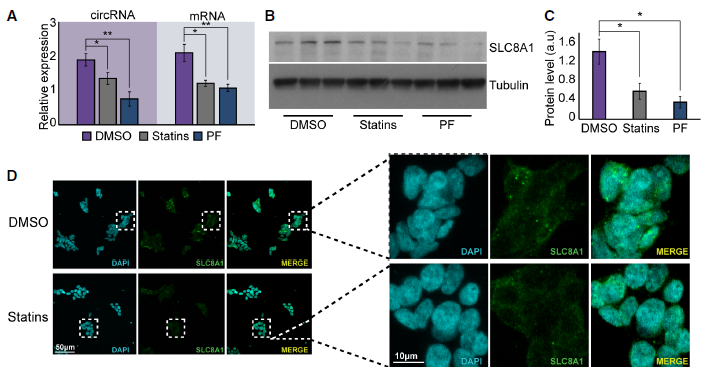
5、CircSLC8A1与Ago2结合,可能调节miR-128的靶点
形成人的circSLC8A1转录本的外显子是开放阅读框的一部分。因此,这个外显子在进化上保守:在人类、小鼠和大鼠的基因组中,这个外显子分别有88%和87%的序列保守(Fig 6A)。通过qRTPCR对细胞进行亚分类,发现circSL8A1像大多数circRNAs一样定位于细胞质(Fig 6B)。进一步发现人circSLC8A1在神经细胞中与Ago2相互作用(图6C),并具有特异性的连接位点(Fig 6D)。于是,作者预测了与circSLC8A1相互作用的miRNA,如Fig 6E。其中在circSLC8A1上发现了7个miR-128的潜在靶点,其中三个位点被鉴定为ago2结合位点(Fig 6E)。因此预估了circSLC8A1与miR-128的相互作用。如果两者有调控关系,则miR-128的靶基因会随着circSLC8A1的表达上调(Fig 6F)。结果表明,miR-128的所有靶基因都在PD的SN中显著上调,而PQ处理的神经细胞系中,miR-128的靶基因上调趋势和circSLC8A1的表达一致(Fig 6G and H)。表明circSLC8A可能调控miR-128靶点。
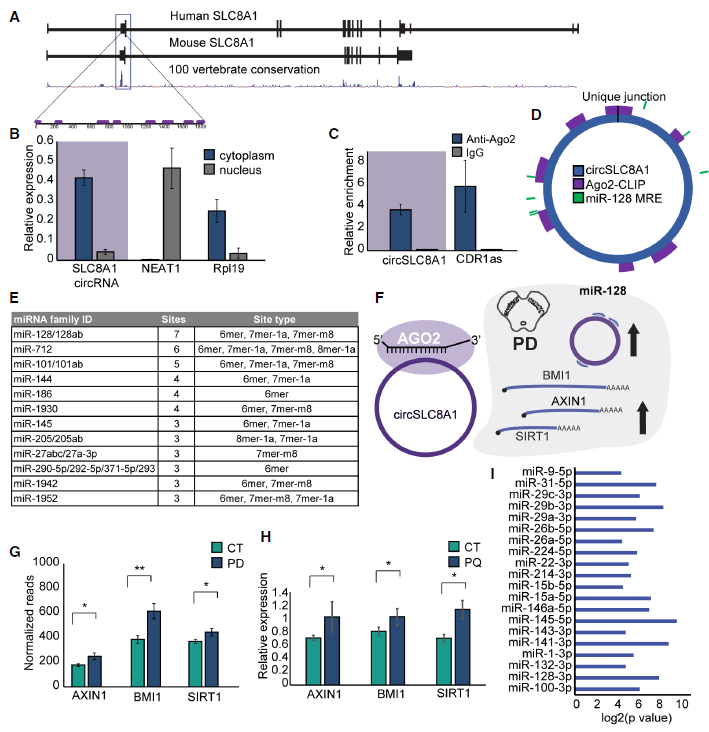
Figure 6在细胞质内circSLC8A1与Ago2结合并调控miR-128靶点
本文的发现建立了PD患者大脑中circRNA表达谱,揭示了之前未知的circRNA表达、氧化应激和PD病理之间的联系,并呼吁探索circSLC8A1积累对PD神经退行性过程启动的影响。
参考文献:
Hanan Mor., Simchovitz Alon., Yayon Nadav., Vaknine Shani., Cohen-Fultheim Roni., Karmon Miriam., Madrer Nimrod., Rohrlich Talia Miriam., Maman Moria., Bennett Estelle R., Greenberg David S., Meshorer Eran., Levanon Erez Y., Soreq Hermona., Kadener Sebastian.(2020). A Parkinson's disease CircRNAs Resource reveals a link between circSLC8A1 and oxidative stress. EMBO Mol Med, 12(9), e11942. doi:10.15252/emmm.201911942






