微生物组和转录组联合揭示肝细胞癌发病机制和临床预后
据统计,包括肝细胞癌(HCC)在内的原发性肝癌(占病例的80%)是全球癌症相关死亡的第四大主要原因。肝脏与肠道关系密切,并执行与营养代谢、免疫力和细菌代谢产物的生物转化有关的必要功能,这种交流称为肠道-肝轴。完整的肠肝轴取决于完整的肠屏障、健康的肠道菌群和正常的肝功能。肠道菌群是与人体共生的最重要的微生态系统。此外,还发现了一些临床特征(年龄、体重指数、饮食习惯和体育锻炼)对健康中国人的肠道微生物组有不同的影响。肝疾病,如非酒精性脂肪肝病和肝硬化,通常与具有改变的肠道微生物群相关联,并且肠道细菌产物有助于肝癌发生。先前的研究已经表明,肠道微生物是西北、中部和华东地区早期和晚期HCC的非侵入性生物标志物。然而,尚无关于大批HCC患者的肠道微生物特征是否可用于评估临床预后的报道,以及肠道菌群如何影响HCC转录组谱尚不清楚。近期,浙江大学医学院第一附属医院肝胆胰外科郑树森教授及其团队获得了华东地区患者肝转录组和肠道微生物组的配对数据,发现在具有高肿瘤负担的HCC患者中,拟杆菌、毛螺旋菌和梭菌XIVa富集,且这三个属中与肿瘤免疫微环境或胆汁酸代谢相关的六个重要微生物标志物具有预测临床结果的潜力,相关研究以“Integrated analysis of microbiome and host transcriptome reveals correlations between gut microbiota and clinical outcomes in HBV-related hepatocellular carcinoma”为题发表在Genome Med上,杂志影响因子10.675。
技术路线:
结果:
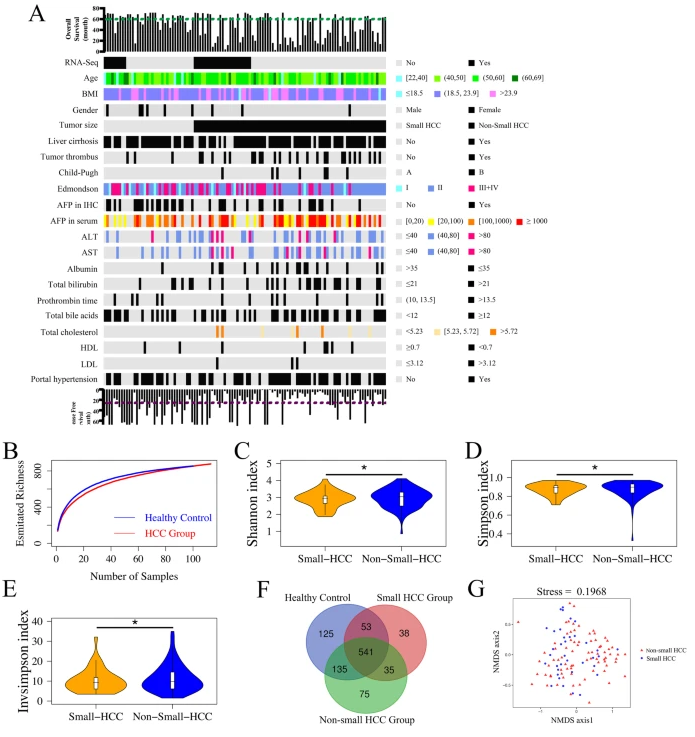
1. 临床特征和微生物多样性
113例HBV相关的HCC患者和100名健康志愿者,都是华东地区的汉族人群,他们具有类似的饮食习惯(混合饮食),以排除饮食差异。这些组的临床病理特征通常匹配,包括年龄、性别、BMI、肿瘤分化和Child-Pugh评分,表明在收集样本之前,尚无确定的混杂因素影响群体歧视(图A)。肝癌患者的血清甲胎蛋白(AFP)水平明显高于健康对照者,但AFP水平无法区分HCC患者的肿瘤大小或肝硬化。进行分类分配后,总共获得了7934068个合格序列和1296个OUT。稀疏分析发现,健康对照组和HCC组OTU的估计丰富度几乎达到饱和(图B)。与对应物相比,在非小型HCC中,每个样品中粪便微生物物种的多样性显着增加(图C-E)。然而,健康志愿者和HCC患者之间无差异。维恩图显示,三组共有1002个OTU的总丰富度为541个(所有参与者中294个OTU的丰度均为零),而小HCC和非小HCC亚组共有877个OTU中的576个(图F)。值得注意的是,1002个OTU中有75个是非小HCC组所特有的。对于β多样性,通过Bray-Curtis距离评价的NMDS图揭示了肠道菌群在所有成对样本中的对称分布(图G)。
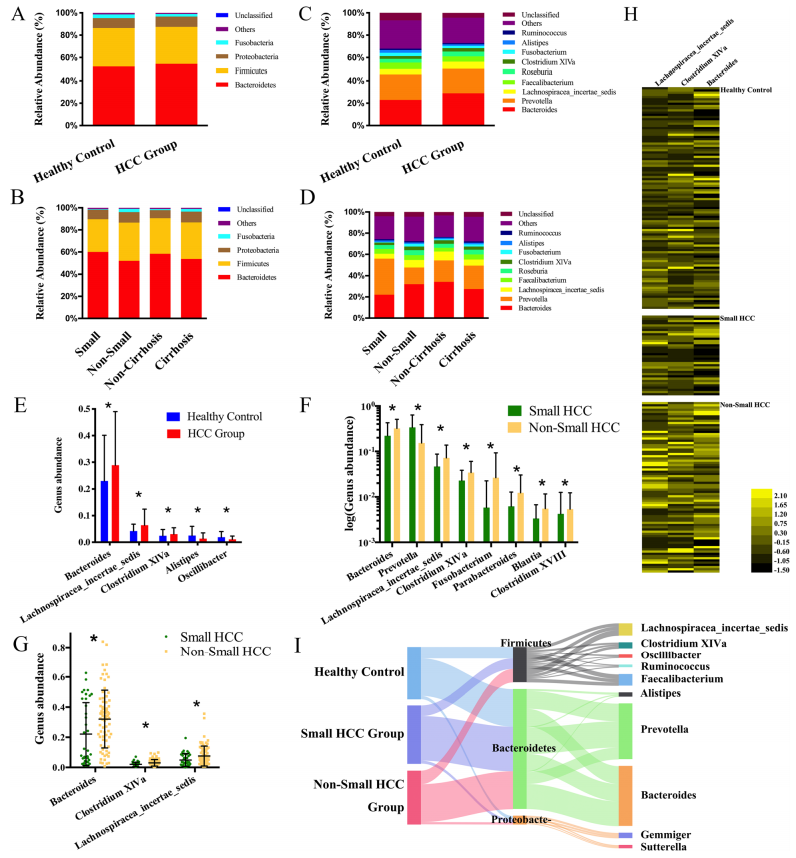
2. 微生物群落表达谱
三个主要细菌门是拟杆菌门、厚壁菌门和变形菌门,总共占OTU的90%(图A,B)。图C和图D显示了属水平上细菌群落(前10位)的平均组成。与健康对照组相比,HCC组中的拟杆菌、毛螺旋菌和梭菌XIVa富集(图E)。当进一步分析HCC组中分层的其他临床特征时,拟杆菌、毛螺旋菌、梭菌XIV和副拟杆菌在非小HCC亚组中与小HCC亚组相比显著富集(图F,G);为了发现高维生物标志物,应用LEfSe鉴定与不同临床特征相关的主要细菌分类群。拟杆菌、毛螺旋菌和梭菌XIVa在非小HCC亚组患者粪便中显著过度表达,进一步对这3个属的相对丰度进行聚类分析,结果表明这3个属在非小HCC亚组中含量丰富(图H)。桑基图显示了健康对照组和小HCC和非小HCC患者中分类群(门和属)的主要比例。在高肿瘤负荷的参与者中,这三个菌属的比例逐渐增加并成为主要菌属,伴随着其他细菌的变化(图I)。
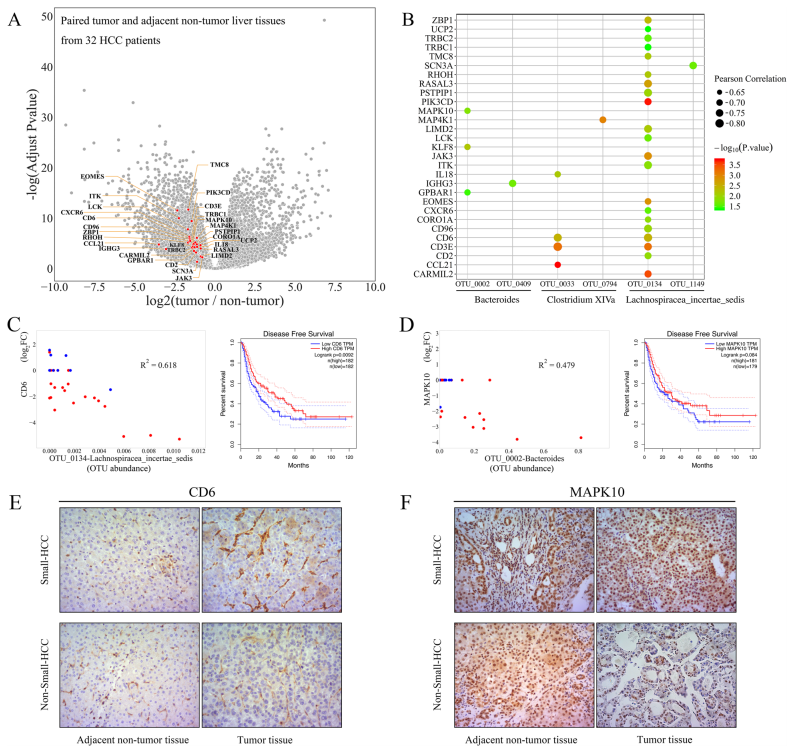
3. 肝脏肿瘤转录组概况
由于HCC患者证明了微生物群与临床特征(肿瘤负荷)的显著相关性,作者假设肝脏肿瘤发生转录组的变化可能与肠道菌群相关。113例患者中,根据测序的严格标准,最终收集32例HCC患者的配对肿瘤和癌旁非肿瘤肝组织。在这32例患者中,23例患有非小HCC。通过edgeR在32对肿瘤和癌旁非肿瘤肝组织中共鉴定出8101个差异表达基因(图A)。基于初步的基因注释和通路分析,29个差异表达基因被鉴定为与6个OTU(拟杆菌、毛螺旋菌和梭菌XIVa的成员)呈负相关,形成31个OTU基因对。图C和D显示了两个典型的OTU基因对(OTU_0134-CD6和OTU_0002-MAPK10)。在32例患者中,OTU_0134丰度的增加伴随着HCC组织中CD6表达的降低,很明显这种类型的下调在非小HCC患者中尤为明显。小HCC通常意味着更好的临床结果,基于GEPIA的Cox风险模型表明CD6和MAPK10是与良好临床预后相关的肿瘤抑制因子。两组之间蛋白水平的不同表达水平也显示出与转录组学相同的结果(图E,F)
作者对非小肝癌亚组与小肝癌亚组中差异表达的29个基因进行功能注释,通路分析显示,这29个基因聚集在免疫相关通路上(T细胞受体信号传导、T细胞增殖的正调控、自然杀伤细胞活化和NOD样受体信号传导、对细菌来源分子的反应等),这些通路是肿瘤免疫微环境的组成部分(图B,C)。为了阐明这些基因在肿瘤免疫微环境中的定位和作用,作者在HCC的独立单细胞图谱数据库中发现22个基因在CD4+ T细胞中高表达,23个基因在CD8+ T细胞中高表达,23个基因在NK细胞中高表达,18个基因在巨噬细胞中高表达,17个基因在B细胞中高表达。根据GEPIA,这些基因也具有相互依赖的关系,表明肠道菌群可能通过一个共同因素影响HCC的转录组(图D)。
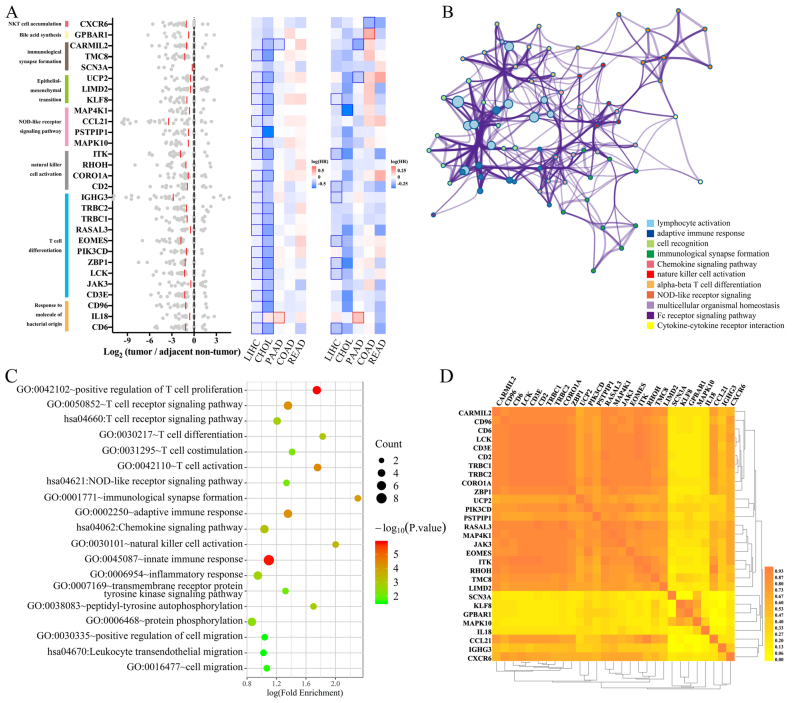
4. HCC肠道菌群和转录组之间的重要通讯介质
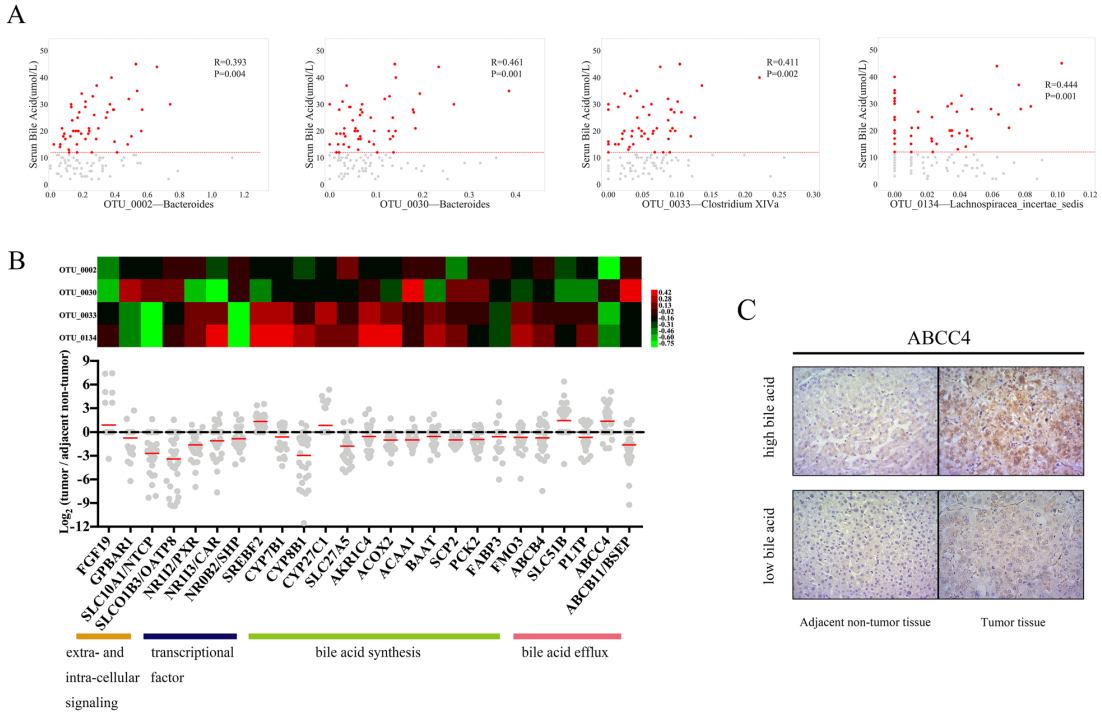
对于个体内相关性分析,作者重点关注临床特征(如BMI、AST和甘油三酯的所有值或异常值)和肠道菌群(75个OTU与拟杆菌、毛螺旋菌和梭菌XIVa匹配)之间的相关性。基于Pearson相关性的分析显示4个胆汁酸相关OTU,而其他临床特征未发现阳性和有意义的结果(图A),且在32对肝组织样本中鉴定出与这4种OTU相关的25个基因,这些基因影响肝脏胆汁酸代谢(细胞外和细胞内信号传导、转录因子以及胆汁酸合成和外排)(B)。免疫组织化学证实,ATP结合盒亚家族C成员4(ABCC4)蛋白在高水平胆汁酸患者的肿瘤和癌旁非肿瘤肝组织中均高表达,提示胆汁酸可能是HCC肠道菌群与宿主转录组交流的重要介质(图C)。
5. 临床预后微生物标志物的鉴定
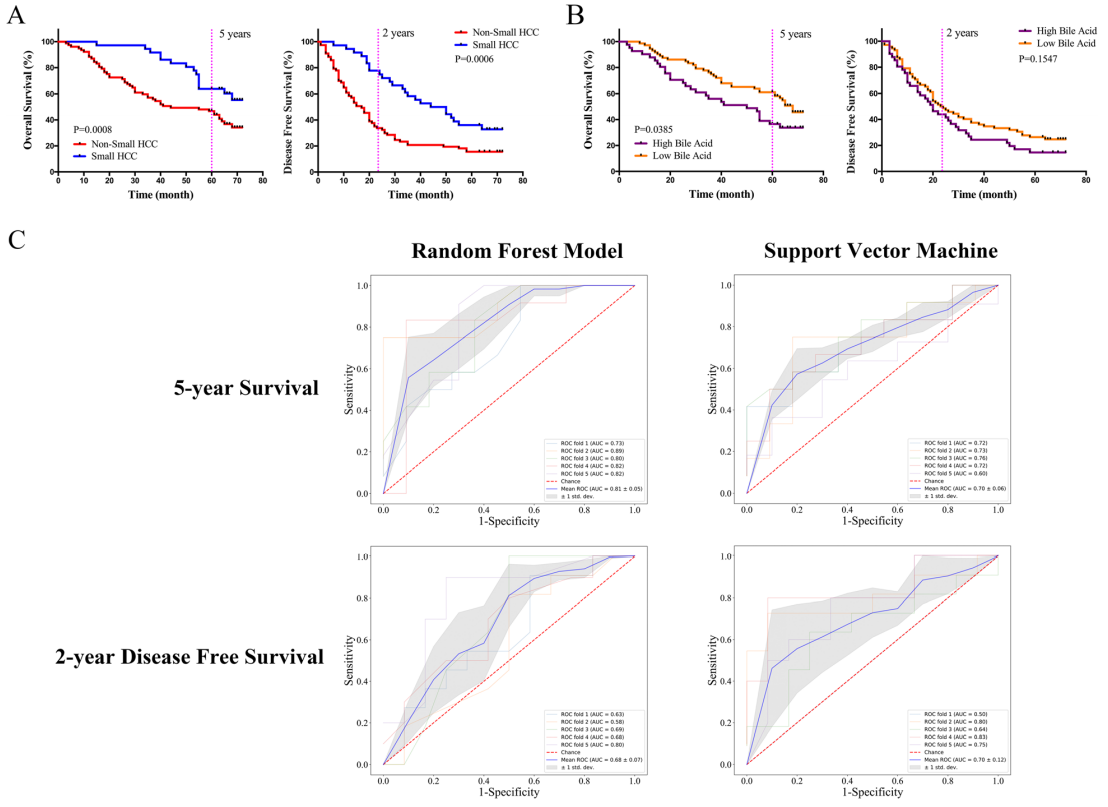
在113例患者中,高肿瘤负荷(非小HCC)和较高的胆汁酸水平表明临床结局较差(图A,B),通过评估以下OTU来评估肠道菌群预测临床预后的能力:OTU_0002、OTU_0033和OTU_0134(与肿瘤免疫微环境和胆汁酸代谢均相关)、OTU_0794(与肿瘤免疫微环境相关)和OTU_0030(与胆汁酸代谢相关),并构建了随机森林和支持向量机分类器模型,以预测113例患者的临床预后(图C)。这些OTU对于区分5年生存率具有良好的分类性能,数据表明这些与HCC肿瘤免疫微环境和胆汁酸代谢有关的OTU标志物有可能预测临床预后。
结论:
1、拟杆菌、毛螺旋菌和梭菌XIVa在高肿瘤负荷的HCC患者中富集,血清胆汁酸可能是这3个属与宿主转录组之间的重要通讯介质;在这3个属中,与肿瘤免疫微环境或胆汁酸代谢相关的6个重要微生物标志物显示出预测临床结局的潜力。
2、总之,肠道菌群通过血清胆汁酸引起的肿瘤免疫微环境变化可能是与肿瘤负荷和不良临床结局相关的重要因素。肠道微生物可以作为临床特征和结果的生物标志物,宿主肿瘤的微生物相关转录本可以部分解释肠道菌群如何促进HCC发病。
参考文献:
Huang HC, Ren ZG, Gao XX, et al. Integrated analysis of microbiome and host transcriptome reveals correlations between gut microbiota and clinical outcomes in HBV-related hepatocellular carcinoma. Genome Med. 2020.






