热敏感性外泌体-脂质体混合纳米颗粒介导的化疗免疫治疗改善转移性腹膜癌的治疗
转移性腹膜癌(MPC)是一种未经有效治疗的致命性疾病。为了改善这种疾病的治疗,最近发展起来的热疗腹腔化疗(HIPEC)已经成为治疗的标准。然而,这种方法的疗效受到药物渗透效率低和快速发展的耐药性的限制。有鉴于此,中山大学的Jie Liu、中山大学第三附属医院的Bo Liu和美国耶鲁大学的Jiangbing Zhou等研究人员,报告了一种纳米技术方法,旨在改善对MPC的药物输送,并通过提供化学免疫治疗来增强HIPEC的疗效。
转移性腹膜癌(mPC)是一种没有有效治疗的致命疾病。在目前的治疗标准下,mPC患者通常会在几个月内死于该病。为了改善这种疾病的治疗,一种新的方法被开发出来,称为高温腹腔化疗(HIPEC),它涉及加热的腹腔内药物填充。不幸的是,越来越多的证据表明,HIPEC的治疗效益受到药物渗透效率低和快速产生耐药性的限制。不幸的是,越来越多的证据表明,HIPEC的治疗效益受到药物渗透效率低和快速产生耐药性的限制。研究表明,腹腔内化疗对直径大于1cm的腹腔肿瘤患者疗效不佳。因此,进一步提高mPC的治疗水平,需要开发具有组织相容性的药物传递系统,增强药物向肿瘤的传递,使多模态联合治疗克服耐药成为可能。
本文报道了一种纳米技术方法,旨在通过化疗免疫治疗来改善药物给药到MPC和增强HIPEC的疗效。首先,确定HIPEC的药物传递效率,发现化疗药物不能有效地传递给大肿瘤结节。为了克服递送障碍,随后合成了基因工程外泌体-热敏脂质体杂交NPs,或gETL NPs,并证明NPs在静脉注射后能有效地进入mPC肿瘤,并在HIPEC低温条件下释放有效载荷。最后,研究表明,granulocyte-macrophage集落刺激因子(GM-CSF)与多西他赛共送时,gETL NPs能有效抑制肿瘤的发生,而HIPEC共送时疗效增强。本研究提供了一种改善药物给mPCs的策略,并通过联合局部HIPEC和gETL NPs的全身化疗免疫治疗,提供了一种有前景的方法来改善疾病的治疗。
本文要点
1)首先,测定了HIPEC的药物输送效率,发现化疗药物不能有效地输送到大的肿瘤结节。
2)为了克服递送障碍,随后合成了基因工程外泌体‐热敏脂质体杂交NPs,或gETL NPs,并证明NPs在静脉注射后能有效地渗透到mPC肿瘤中,并在HIPEC低温条件下释放有效载荷。
3)结果表明,粒细胞-巨噬细胞集落刺激因子(GM-CSF)与多西紫杉醇联合应用时,gETL NPs可有效抑制肿瘤生长,HIPEC联合应用可增强gETL NPs对肿瘤生长的抑制作用。
本研究提供了一种改善mPCs药物传递的策略,并通过联合局部HIPEC和gETL NPs的全身化疗免疫治疗,为改善该病的治疗提供了一种有前途的方法。
技术路线:
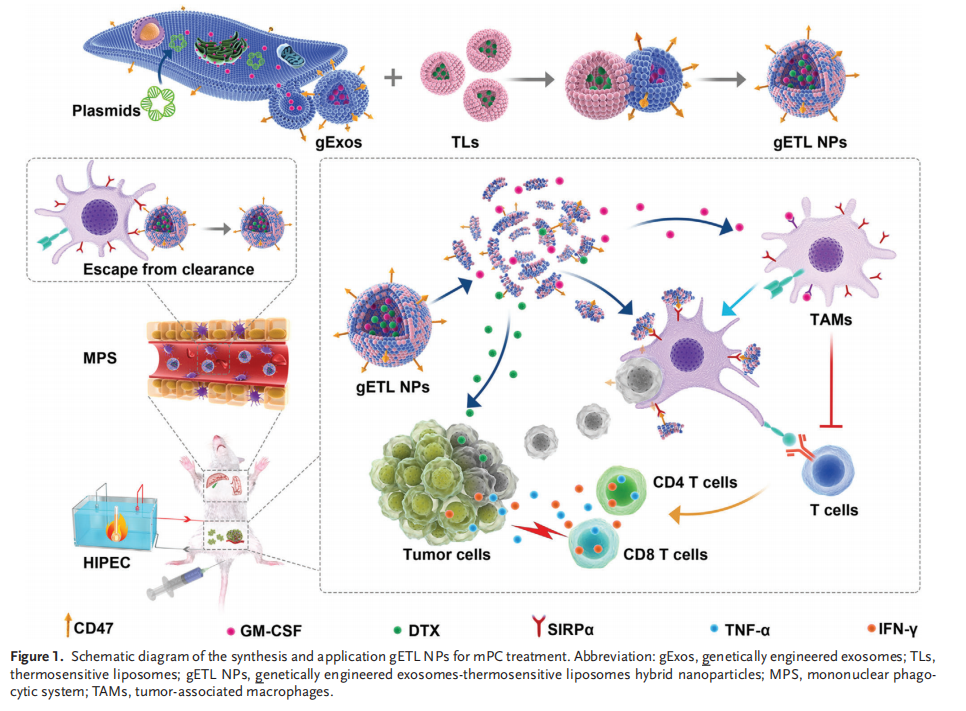
一、HIPEC在给药过程中局限性的特征
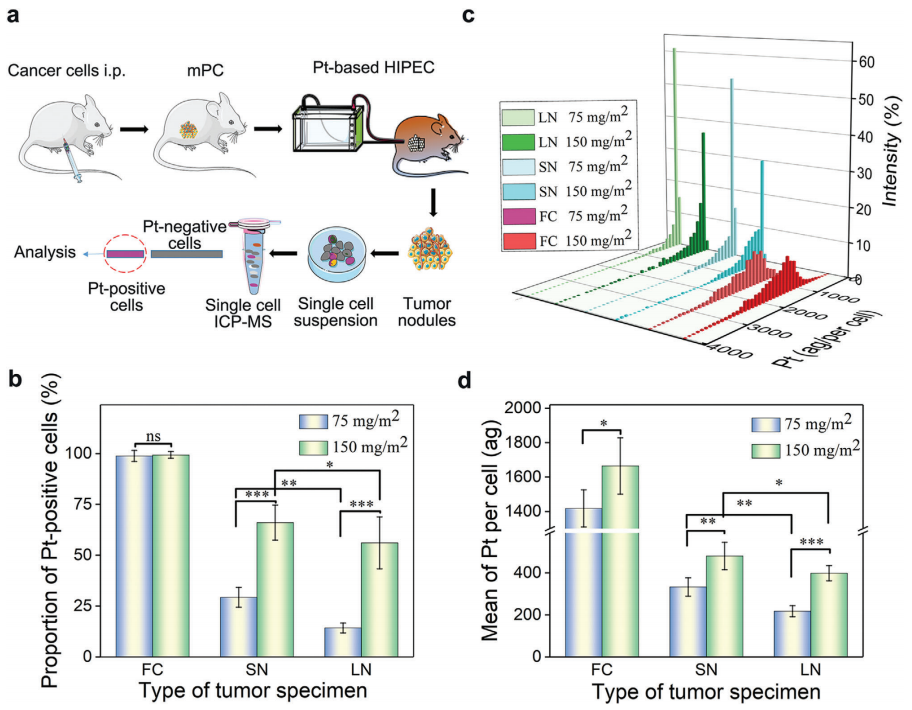
A. 利用小鼠结直肠癌CT26细胞来源的mPC模型,研究HIPEC给药的效率。奥沙利铂(Pt)是HIPEC中常用的一种化疗药物,给予荷瘤小鼠150或75 mg m-2.
B. 30 min后处死小鼠,分离肿瘤并在单细胞水平上进行电感耦合等离子体质谱(ICP-MS)分析。在75 mg m-2剂量下,游离瘤细胞(FC)、小瘤结节(SN、体积小于10 mm3)和大结节(LN,体积大于等于10 mm3)。
C. 在两种剂量下,与大剂量相比,SN具有更大的药物穿透和吸收能力。
D. 例如,在75 mg m2的剂量下,FC、SN和LN中铂的平均重量分别为1417.8、313.1和217.8 ag,而在150 mg m2 Pt时,FC、SN和LN细胞的平均重量分别为1664.8、480.4和398.5 ag。
总之,这些结果表明,HIPEC释放肿瘤细胞的药物递送效率足以杀死细胞,mPC肿瘤结节的给药效率取决于肿瘤大小和给药浓度,需要进一步改善药物递送到肿瘤结节的效果,特别是对于那些较大的结节。
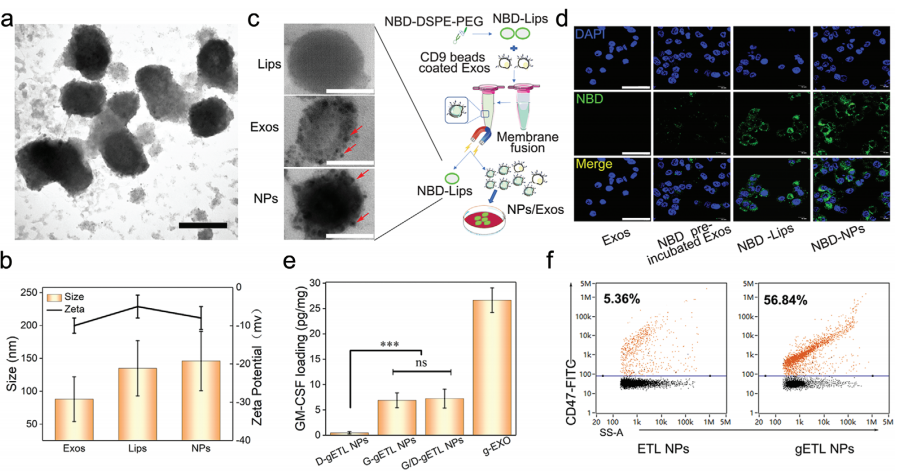
A-B.透射电镜分析显示,gETL NPs与脂质体形态相似,平均直径为135.7 nm, Zeta电位为−8.2 mV。
C. 透射电镜证实外泌体或gETL NPs表面存在CD9珠.
D. gETL NPs处理组的荧光强度强于脂质体处理组,提示外泌体成分的包含促进了细胞摄取.
E. G/D-gETL NPs中GM-CSF和DTX的含量分别为7.2 pg µg -1和4.3%,低于转基因外泌体中GM-CSF的含量(26.65 pg µg -1)。
F. 与基因工程细胞和外泌体类似,56.8%的gETL NPs呈 CD47阳性,而5%的ETL NPs是由野生型外泌体产生的
三、gETL NPs与HIPEC在体外协同抑制肿瘤细胞增殖
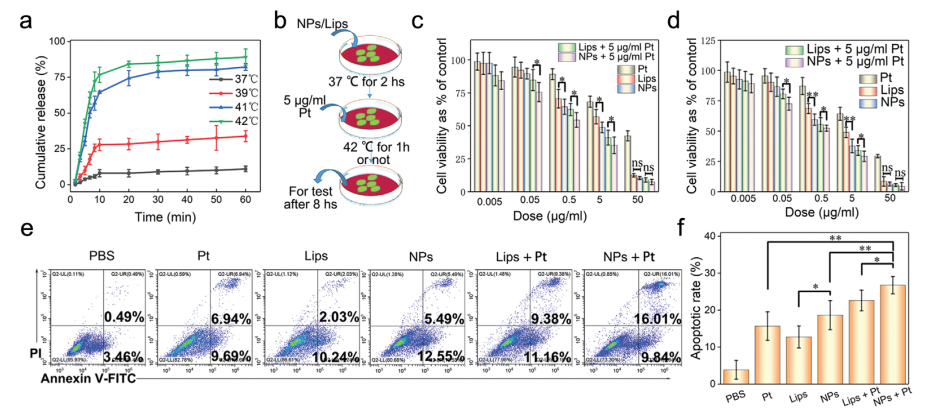
A.在37℃和39℃时,DTX在前60分钟内的释放分别被限制为11%和34%。
B.相比之下,77%的DTX在42℃的前10 min内释放。
C-D.gETL NPs对于临床应用具有潜在的安全性。相反,载药NPs在42℃时的细胞毒性比37℃时更大.
E. G/D-gETL NPs诱导细胞凋亡的速率明显大于装载DTX脂质体和游离DTX,且联合Pt处理时凋亡速率增加.
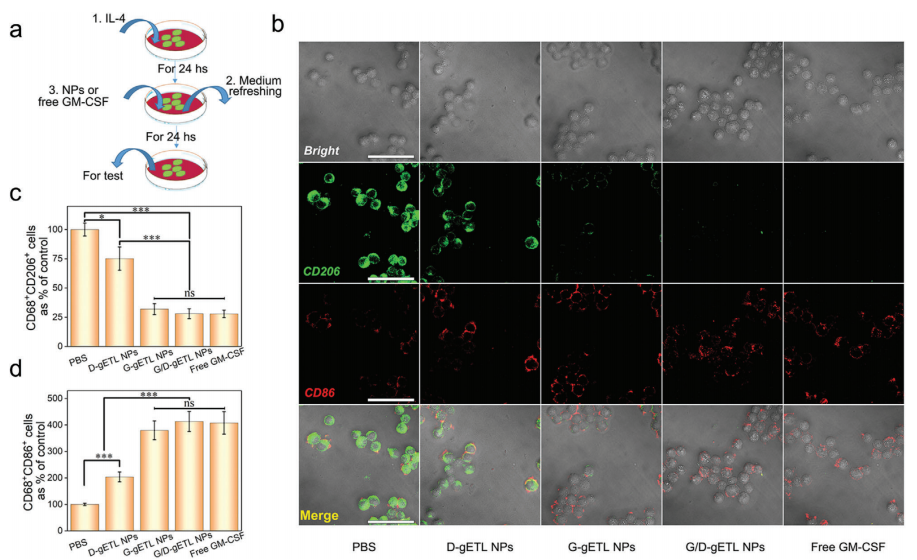
G/D-gETL NPs是否使M2表型巨噬细胞重新极化为M1表型。通过IL-4诱导RAW264.7巨噬细胞形成M2表型,然后与G/D-gETL NPs或游离GM-CSF孵育.
24 h后,分别对M1表型表面标记物CD86和M2表型表面标记物CD206进行免疫染色,CLSM分析。与游离GM-CSF相似,G- getl和G/D-gETL NPs有效地将巨噬细胞从M2表型转化为M1表型.
C-D. G/D-gETL NPs转换巨噬细胞表型的效率可与游离GM-CSF相比,并且转换活动是独立于封装的DTX.
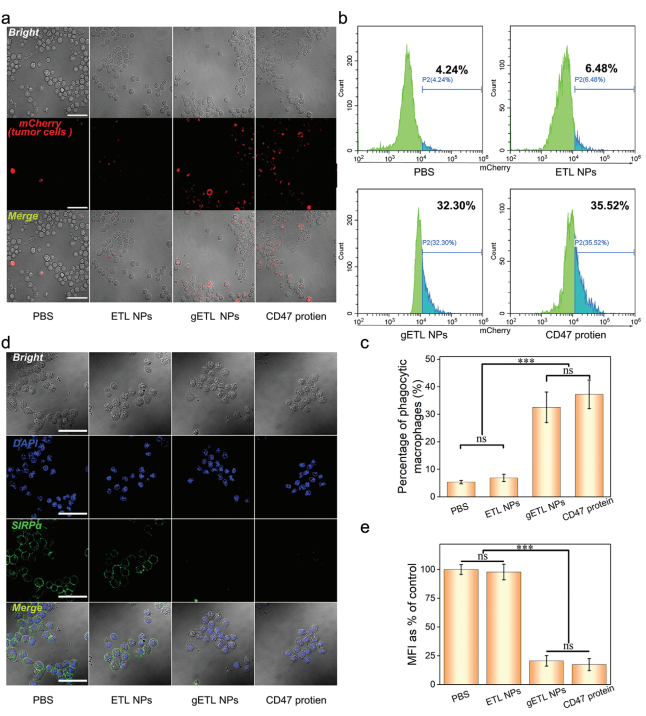
A-B. 孵育6h后,CLSM和流式细胞仪检测肿瘤细胞的吞噬能力。
C. 经gETL NP处理的巨噬细胞吞噬效率为32.5%,与CD47蛋白处理的巨噬细胞(37.2%)相当,约为PBS(5.4%)和ETL NPs(6.9%)巨噬细胞吞噬效率的6倍。
D. CLSM分析发现,与PBS或ETL NPs处理巨噬细胞表面荧光较强不同,gETL NPs或CD47蛋白处理巨噬细胞表面荧光可忽略不计.
E. FITC荧光半定量分析发现,经gETL NPs处理和CD47蛋白处理的巨噬细胞的相对平均荧光强度(MFI)分别为20.6%和17.4%;相比之下,PBS或ETL NPs处理巨噬细胞的值为97.8.
总之,gETL NPs通过与巨噬细胞表面SIRP的竞争性相互作用促进巨噬细胞的吞噬。
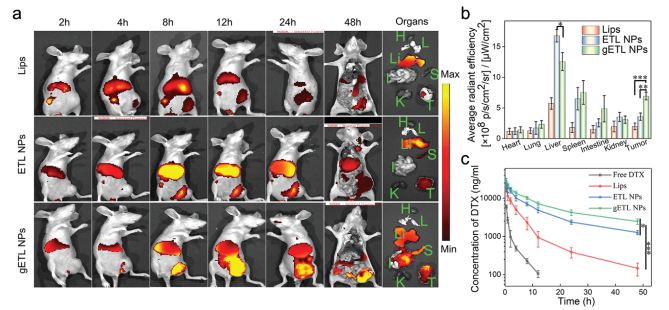
A. 肝脏中脂质体的积累明显多于肿瘤,48 h后大部分脂质体被清除.
B. 基于荧光强度的半定量分析显示,在注射48 h后,肿瘤组织中gETL NPs的积累量分别是脂质体组和ETL np组小鼠的3.3倍和2.1倍.
C. 48 h时,肝内gETL NPs的高积累可能与其血液循环时间长有关。然后我们进一步测定了包裹DTX合成的NPs的血液循环。使用游离DTX、DTX加载脂质体或DTX加载ETL NPs处理的小鼠作为对照组。与对照组相比,gETL NPs显著延长了血液循环时间。
D. 间隙一半时间(t1/2β)ETL NPs和gETL NPs分别为0.5、3.5、6.2和8.1 h.
E. 与Lips组相比,ETL NPs组体内循环延长可能与5%的CD47表达有关.
总之,CD47的表面显示延长了NPs的血液循环,增强了NPs在肿瘤中的积累。
七、用于mPC处理的G/D-gETL NPs的表征CT26-Derived mPC异种移植
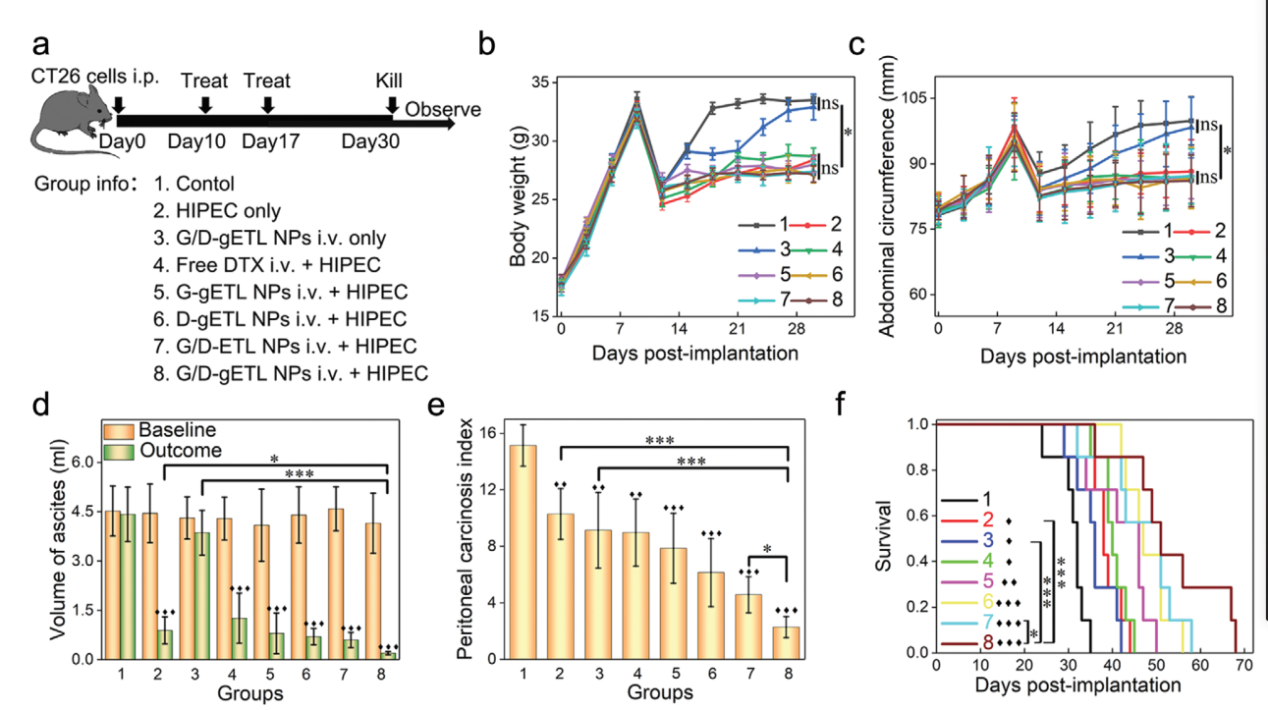
G/D-gETL NPs联合HIPEC对ct26小鼠mPC模型的抗肿瘤作用瘤细胞接种后10 d,随机分组(每组12只),给予免费药物或载药NPs治疗.腹腔穿刺取腹水后静脉给予治疗。对于参与HIPEC治疗的组,在初始治疗12小时后进行基于pt的HIPEC治疗(图8a)。第17天,小鼠按照同样的程序接受第二周期治疗,但不去除腹水。然后每3天监测小鼠体重和腹围的变化。到第30天,每个队列中有5只小鼠被安乐死。采集血样进行生化分析。收集腹水并测量。采用实验性腹膜癌病指数(PCI)系统评估肿瘤负荷。其余的小鼠则继续观察存活情况
经过两个周期的治疗,所有hipectreated组小鼠的体重和腹围都稳定。
HIPEC组小鼠腹水明显减少,G/D-gETL NPs + HIPEC组腹水体积最小。相比之下,未加HIPEC的G/D-gETL NPs组腹水体积仍维持在较高水平.其他治疗方案抑制作用明显减弱,且G/D-gETL NPs + HIPEC治疗组抑制率比HIPEC单独治疗组高2.6倍。HIPEC对控制腹水是有效的,而这种效果不能通过静脉化疗实现.
虽然仅封装GM-CSF或DTX在NPs中的治疗效果优于HIPEC,但封装两种药物的配方产生了显著更大的疗效.
G/D-gETL NPs + HIPEC组小鼠中位生存期为53 d,比对照组或单药组延长5 ~ 15 d.






