MGMT基因重排有助于胶质瘤化疗耐药
近月来,一篇名为“ MGMT genomic rearrangementscontribute to chemotherapy resistance in gliomas ”,发表在《Nature Communications》上,由CNIO的Seve Ballesteros基金会脑肿瘤小组负责人MassimoSquatrito博士和北京神经病学研究所的Tao Jiang博士(医学博士)领导。
“ MGMT启动子高甲基化是胶质母细胞瘤患者中唯一已知的TMZ反应生物标记。在这里,我们显示,复发性神经胶质瘤的一个子集携带MGMT基因组重排,导致MGMT过表达,与其启动子甲基化的变化无关。通过利用CRISPR / Cas9技术,我们在神经胶质瘤细胞中产生了一些MGMT重排,并证明MGMT基因组重排在体外和体内均对TMZ产生了抗性。”
研究人员说:“在一组患者中观察到了MGMT基因的移位。” 这些基因组重排涉及MGMT与其他基因的融合,这意味着MGMT现在受到与其融合的启动子的调控,这有助于其过度表达。当这种类型的重排发生时,替莫唑胺诱导的DNA损伤得到了非常有效的修复,并且即使在治疗下,神经胶质瘤也继续增长。
为了揭示神经胶质瘤患者的TMZ耐药情况,研究人员分析了252例经TMZ治疗的复发性神经胶质瘤的RNA测序数据,其中新收集了105例(42%)。然后,该团队整合了临床信息并进行了生物信息学分析,以确定几种关键改变的突变状态。CNIO小组使用CRISPR-Cas9在不同的细胞和动物模型中复制了其中的一些易位,并证实它们可以赋予对替莫唑胺的抗性。研究人员补充说:“似乎在原始肿瘤中不存在易位,仅在复发性肿瘤中存在,即在治疗原始癌症后出现的肿瘤。” “这表明抗药性可能是治疗本身的结果。”
他们的发现可能会导致监测治疗效果的方法发生变化:“目前,胶质瘤中唯一已知的治疗生物标志物是对MGMT启动子状态的分析。甲基化后,MGMT基因沉默,预计患者对替莫唑胺有反应。研究表明,当发生基因易位时,该方法不再有效。该启动子可能仍然被阻断,但是该基因被其他启动子过度激活,因此可能导致肿瘤复发。”
研究人员还发现外泌体中存在MGMT易位。研究人员指出,如果这一发现在患者中得到了验证,那么它将有助于早期发现耐药性。研究人员的下一个目标是为替莫唑胺耐药的患者确定新的治疗手段。
总而言之,替莫唑胺(TMZ)是一种口服烷基化剂,用于治疗胶质母细胞瘤,目前正在成为诊断为高危低级别胶质瘤患者的化疗选择。o -6-甲基鸟嘌呤-DNA甲基转移酶(MGMT)负责直接修复主要tmz诱导的毒性DNA加合物,即o6 -甲基鸟嘌呤病变。MGMT启动子高甲基化是目前已知的胶质母细胞瘤患者TMZ反应的唯一生物标志物。此文章表明复发性胶质瘤的一个子集携带MGMT基因组重排,导致MGMT过表达,独立于其启动子甲基化的变化。通过利用CRISPR/Cas9技术,我们在胶质瘤细胞中产生了一些MGMT重排,并证明MGMT基因组重排在体内和体外都有助于TMZ耐药。最后,证明了这种融合可以在肿瘤来源的外泌体中检测到,并可能代表接受TMZ治疗的患者中肿瘤复发的早期检测标志物。
技术路线:
结果:
一、复发性胶质瘤中MGMT基因融合的鉴定
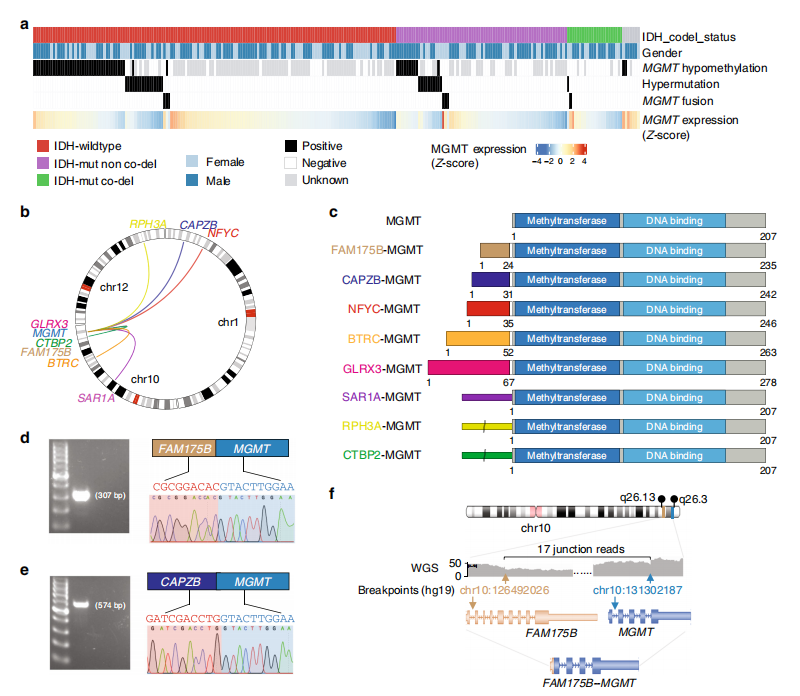
通过分析252例复发性脑胶质瘤的RNA-seq数据,我们在7例患者中确定了8种不同的MGMT融合(约占所有患者的3%,95%可信区间,1.1 5.6%)。值得注意的是,在7例合并MGMT融合的患者中,有6例是女性,这明显高于预期。重要的是,bootstrapping方法显示MGMT低甲基化、DNA高突变和MGMT融合之间存在着显著的相互排他性,表明这些变化在癌症进展中发挥着替代作用.
A. 总的来说,我们发现38.4%(245例)患者存在IDH1突变,9.4%(23例)患者存在1p/19q共缺失,38%(136例)患者存在MGMT启动子低甲基化,10.7%(27例)患者存在DNA高突变.
B. 对8种不同的MGMT重排进行了深入研究:HGG中的BTRC-MGMT、CAPZB-MGMT、GLRX3-MGMT、NFYC-MGMT、RPH3A-MGMT和SAR1A-MGMT, LGG中的CTBP2- MGMT和FAM175B-MGMT. 8个伴侣基因中的5个位于染色体10q上,大部分接近MGMT
C. 尽管MGMT融合的左伴子不同,但MGMT转录组断点始终位于MGMT起始密码子上游12 bp处的MGMT外显子2的边界上。在三种重排(SAR1A-MGMT、RPH3A-MGMT和CTBP2-MGMT)中,MGMT编码序列融合到融合伙伴的5 UTR上。重组嵌合转录本发现所有融合体均在框内,MGMT的甲基转移酶结构域和dna结合结构域均完整,提示MGMT的功能可能保留在融合蛋白中。
D-E我们利用PCR和Sanger测序在有足够标本的样本中验证了基因融合。对于一个患者(CGGA_1729),我们进行了全基因组测序(WGS),该样本的结构重排分析显示,大约4.8 Mb的缺失导致FAM175B-MGMT融合.
二、MGMT基因重排导致MGMT过表达
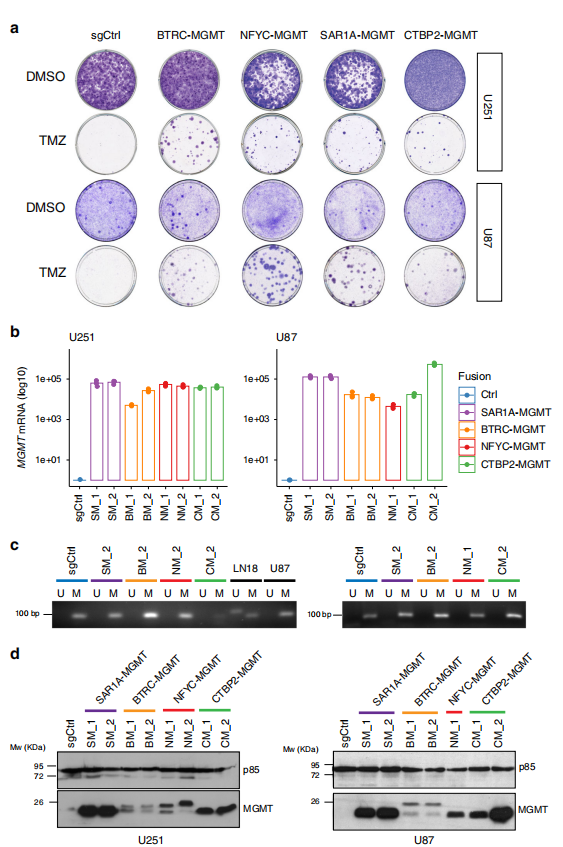
A.为了产生携带MGMT融合的细胞系,我们首先将U251和U87细胞,两种MGMT甲基化的GBM细胞系,与慢病毒载体表达不同的gRNA对组合,指向四种不同的MGMT重排:BTRC-MGMT、NFYC-MGMT、SAR1A-MGMT和CTBP2-MGMT(补充图2a c)。
通过PCR在基因组水平检测到预期的染色体重排,并通过Sanger测序证实。然后将新生成的细胞群暴露于TMZ中。存活的克隆只在携带不同融合事件的细胞群体中观察到,而在对照细胞中没有观察到(sgCtrl,非靶向sgRNA).
B.TMZ耐药可能是由于MGMT表达增加导致的,因为重排将MGMT基因置于一个更活跃的启动子控制之下。实时荧光定量PCR结果显示,MGMT在携带不同融合体的无性系中表达量显著增加。
与对照细胞相比,MGMT启动子甲基化状态没有变化,甲基化特异性PCR (MSP)证实了这一点。这些结果与在患者队列中观察到的结果一致:MGMT重排的患者显示MGMT表达升高,同时MGMT启动子甲基化。
使用抗gmt抗体进行Western blot分析,发现MGMT在蛋白水平上明显过表达,SAR1A-MGMT和CTBP2-MGMT融合克隆尤其明显(图2d)。此外,MGMT表达的不同水平可能由参与融合事件的特定基因s启动子的活性和/或每个特定克隆基因组重排列的拷贝数决定。
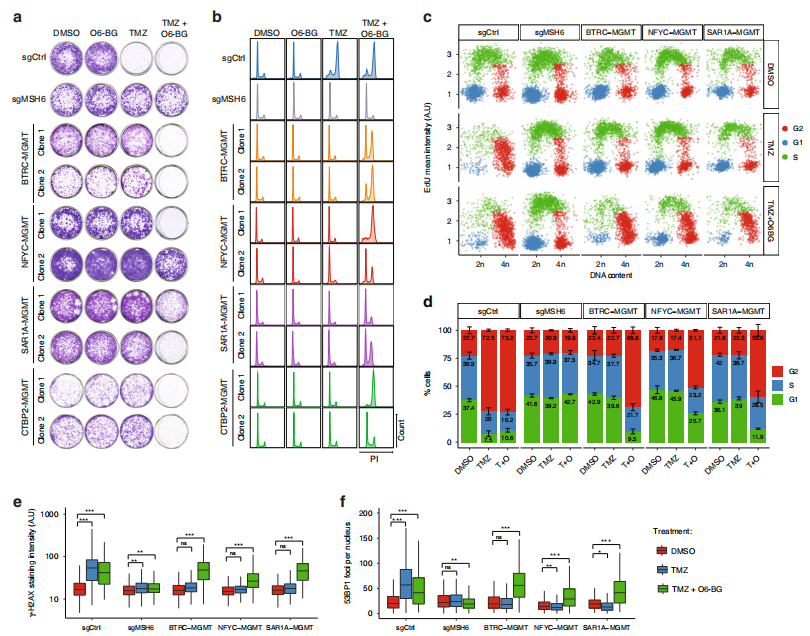
为了确定携带融合基因的克隆对TMZ的抗性是否由一种全功能MGMT蛋白的过表达决定,而不是由TMZ治疗过程中获得的其他突变引起的,我们分析了O6-苄基鸟嘌呤(O6- bg)对TMZ的敏感性,O6- bg是鸟嘌呤的一种合成衍生物,可抑制MGMT活性。
A.对2个独立的U251克隆进行克隆实验,结果表明,与O6-BG共处理后,TMZ的敏感性得以恢复。
B-D.相比之下,错配修复基因MSH6(一种独立于MGMT表达的tmz耐药机制)的细胞敲除在O6-BG存在下也完全耐TMZ。同样,碘化丙啶染色和EdU掺入分析显示融合克隆避开了tmz诱导的G2/M期积累,O6-BG共处理能够重新建立细胞周期停滞。
E-F.高通量显微镜定量分析显示,与sgRNA MSH6细胞相似,TMZ处理未增加γH2AX和53BP1病灶水平,这是DNA双链断裂细胞特有的DNA损伤标志物.
总之,O6-BG抑制MGMT导致TMZ处理后融合克隆中γH2AX和53BP1焦点的积累。MGMT基因重排诱导的TMZ抗性与MGMT活性存在机制方面的联系。
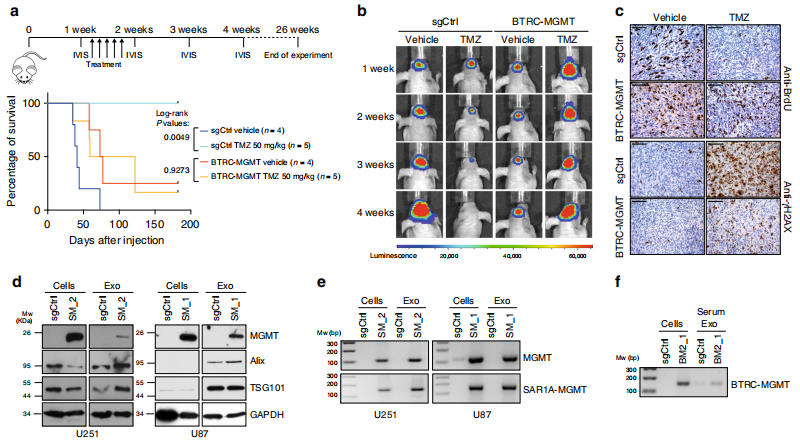
四、MGMT基因融合在体内对TMZ治疗有保护作用
通过U251 BTRC-MGMT和对照细胞建立nu/nu小鼠异种移植模型,体内MGMT融合的TMZ耐药性,之前用表达荧光素酶的构建物转染。颅内移植后1周,小鼠腹腔注射TMZ (50 mg/ Kg)或DMSO(0.3%) 5天,每周用生物荧光成像(BLI)监测肿瘤生长情况,连续4周。
AMGMT带有融合肿瘤的小鼠在TMZ组和DMSO组之间没有显示出显著的寿命延长,并且在接受TMZ治疗时,与对照组小鼠相比,生存率显著下降.
TMZ治疗显著延长了sgCtrl转导h543的小鼠移植后的存活时间,但未能延长表达SAR1A-MGMT重排的小鼠的存活时间(补充图7h)。BLI分析证实TMZ对正常小鼠的抗肿瘤作用有限.
免疫组化显示TMZ给药后,BTRC-MGMT小鼠BrdU掺入增加,γH2AX积累减少.
评估MGMT融合是否可以在EXOs中检测到。用标准的超离心法从含有SAR1A-MGMT和sgCtrl的条件培养基中纯化了EXOs。蛋白质含量的Western blot证实了外泌体特异性标记TSG101和Alix在外泌体中富集. MGMT在表达融合事件的细胞中的存在(图4d)。
RT-PCR检测到MGMT融合的mRNA在EXOs中(图4e)。
原位注射U251 BTRC-MGMT细胞的小鼠血清中分离的外显子是否也表现出融合转录。值得注意的是,RTPCR分析证实了btrc - mgmt衍生的循环血液外显子中存在cDNA融合片段.






