单细胞转录组分析明确了鼻咽癌中肿瘤细胞、病毒感染和微环境之间的相互作用

鼻咽癌(NPC)是最常见的头颈部肿瘤,起源于鼻咽部上皮细胞,在华南及东南亚地区高发。eb病毒(Epstein-Barr virus, EBV)是一种属于γ-疱疹病毒家族的疱疹病毒,被认为是鼻咽癌的致病因子。部分ebv编码基因参与鼻咽癌的发生发展。例如,LMP1可激活宿主NF-κB、PI3K/AKT、ERK/MAPK和JAK/STAT信号通路,促进细胞增殖和抗凋亡。以往对鼻咽癌的发病机制和分子基础的研究主要集中在其易感基因、基因组改变和基因表达模式(在宿主和EBV中)以及宿主病毒相互作用等方面。然而,这些研究很大程度上依赖于仅从整体角度研究肿瘤的方法,限制了它们在解剖肿瘤微环境(TME)中的亚群事件如瘤内异质性(ITH)和多细胞亚型等方面的能力。为了更深入地了解鼻咽癌的多细胞生态系统,此篇文献运用scrna测序技术(single lecell RNA sequencing, scRNA-seq),同时对鼻咽癌中恶性细胞、EBV、基质细胞和免疫细胞的转录组进行测序,并系统地比较肿瘤和非恶性组织的微环境。
2020年9月,来自北京大学生物医学前沿创新中心、生命科学学院白凡研究员团队与中山大学肿瘤防治中心曾木圣/钟茜教授团队合作在Cell Research杂志上发表了文章“Single-cell transcriptomic analysis defines the interplay between tumor cells, virus infection, and the microenvironment in nasopharyngeal carcinoma”。
在这项研究工作中,研究人员首先利用Smart-seq2和10x Genomics两种单细胞转录组技术平台对19个EBV+ NPC患者的肿瘤样本(其中3例有配对转移位组织),以及7例非肿瘤患者的鼻咽组织样本应用scRNA-seq技术,共捕获到大约104,000个单细胞。经过深入的生物信息学分析,研究人员在单细胞水平全面系统的描绘了肿瘤细胞、EBV、间质和免疫细胞等的转录组图谱。同时,研究人员在单细胞水平揭示了NPC肿瘤内部异质性,以及原位和转移位肿瘤组织潜在的播散关系。对EBV基因表达图谱特征分析表明,EBV潜伏期和裂解期基因可在宿主同一肿瘤细胞内共表达。
技术路线:

A.展示了使用两个平台进行样本收集、单细胞分离、分类和scRNA-seq的流程。
b t-SNE图来自10个基因组体的所有单细胞。
c抗cd3 (T细胞)、抗cd19 (B细胞)、抗cd117(肥大细胞)、抗pan - ck(肿瘤细胞)、抗cd68(巨噬细胞)和抗α- sma(成纤维细胞)抗体的多重免疫组化染色。比例尺,100μm。d t-SNE图比较来自肿瘤和非恶性组织的单细胞分布。
e上图显示了基于scRNA-seq数据推断的典型肿瘤(NPC16)中单细胞CNVs的大尺度变化。下图显示了全基因组测序推断出的CNVs。
f来自三种肿瘤的单个细胞中显示ebv衍生测序的总覆盖的Circos图。EBV基因是根据它们的位置和CDS区域绘制的。潜在的共表达基因区域通过宽度与单个细胞中共表达事件的数量成比例的条带连接。
二、破译表达式程序揭示了恶性细胞上皮免疫的双重特征
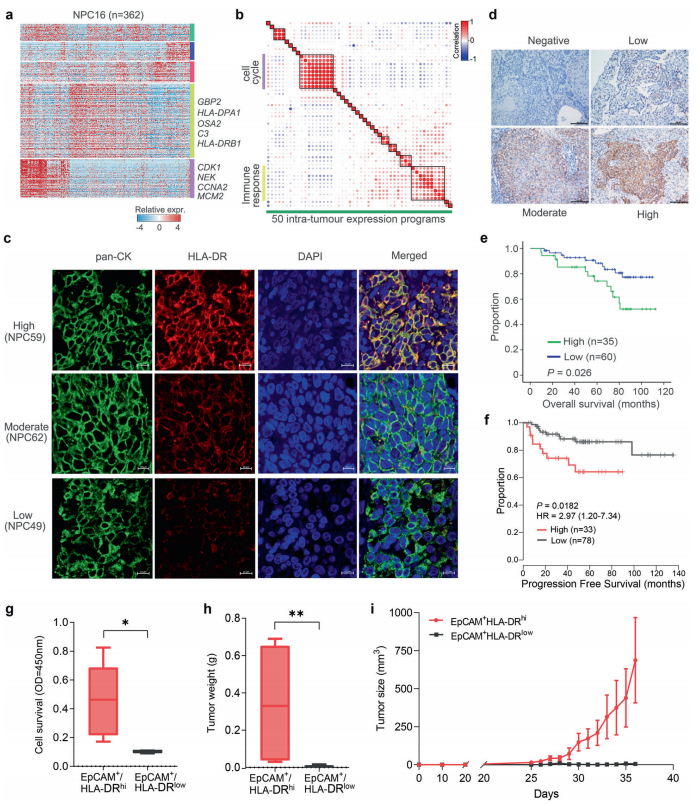
a使用NMF从代表性肿瘤(NPC16)中破译出的基因表达程序的热图。
b 50个肿瘤内表达程序的Pearson相关性聚类。网点大小与相关系数的绝对值成正比。
c鼻咽癌中HLA-DRB1免疫组化染色梯度。Top, HLA-DR在NPC59组织中具有强免疫反应性;中等HLA-DR在NPC62组织中的免疫反应性;下为HLA-DR在NPC49组织中的弱免疫反应性。pan-CK作为鼻咽癌肿瘤细胞的生物标志物,DAPI作细胞核染色。比例尺,10μm。
d抗hla - dr免疫组化染色。比例尺,100μm。
e HLA-DR高表达或低表达患者的总生存期。
f从大量RNA-seq数据推断不同ISs患者的无进展生存期。
g通过CCK-8试验比较C17鼻咽癌异种移植物的is -高和is -低细胞存活率。IS-high, EpCAM+HLA-DRhi; IS-low, EpCAM+HLA-DRlow。h, i在注射C17 NPC异种移植瘤的is -高、is -低群体的裸鼠中肿瘤重量和大小的比较。数据为SEM的平均值。高,EpCAM + HLA-DRhi;低,EpCAM + HLA-DRlow
三、鼻咽癌T细胞聚类及状态分析
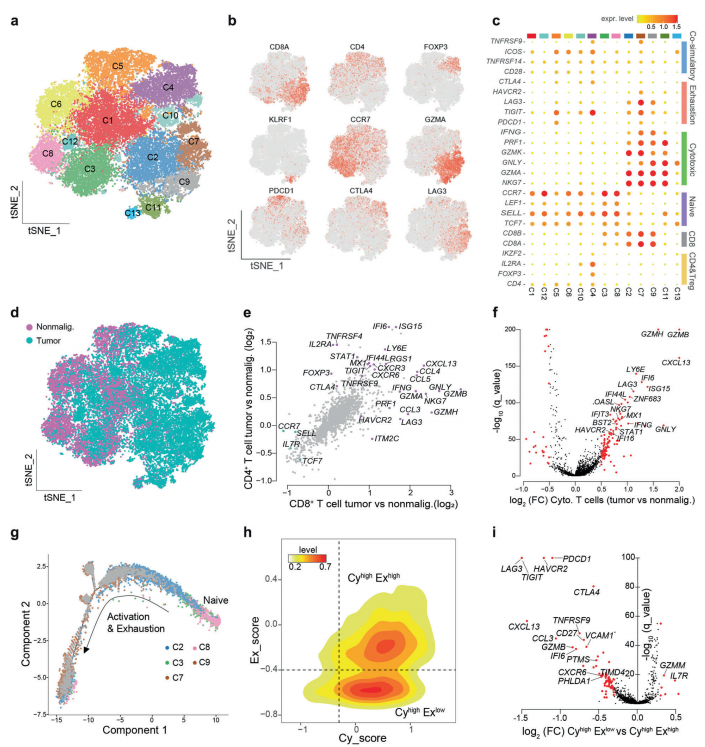
A. 将所有的细胞分为13组,证实了T细胞群的功能异质性.
B-C.调查了13个集群中典型T细胞标记物的表达和分布.C4细胞主要来源于肿瘤(补充信息,图S5c),这表明鼻咽癌的免疫微环境偏向于更耐受性的环境。C5细胞中PDCD1和CXCL13高表达(图3b, c),C4簇代表FOXP3、IL2RA和IKZF2高表达的调节性T细胞(treg).。C2、C7和C9的T细胞显示NKG7和GZMK等细胞毒性标记物高表达(图3c)。
有趣的是,C2、C7和C9的衰竭标志物表达不同
D. 来自肿瘤和非恶性组织的T细胞分布呈二分性(图3d)
E-F.在肿瘤源性CD4+和CD8+ T细胞中,共刺激和共抑制受体(如TNFRSF9和TIGIT)以及趋化因子受体(如CXCR3和CXCR6)均上调(图3e)。比较了肿瘤来源和非恶性组织来源的细胞毒性CD8+ T细胞、treg细胞和自然杀伤细胞(NK)的表达谱(图3f)
G.CD8+ T细胞的发育轨迹,并根据典型标志物的表达计算每个细胞的细胞毒性评分和衰竭评分.
H.虽然大多数CD8+ T细胞遵循激活耦合衰竭的趋势,但仍有一部分细胞表现出较高的细胞毒性但较低的衰竭状态(图3h).
I.在CyhighExhigh组中,众所周知的衰竭标志物,如PDCD1、LAG3、TIGIT和HAVCR2显著上调。值得注意的是,我们还确定了潜在的新衰竭标志物,包括VCAM1、PTMS和TIMD4(图3i).
四、鼻咽癌中髓细胞和间质细胞聚集及状态分析
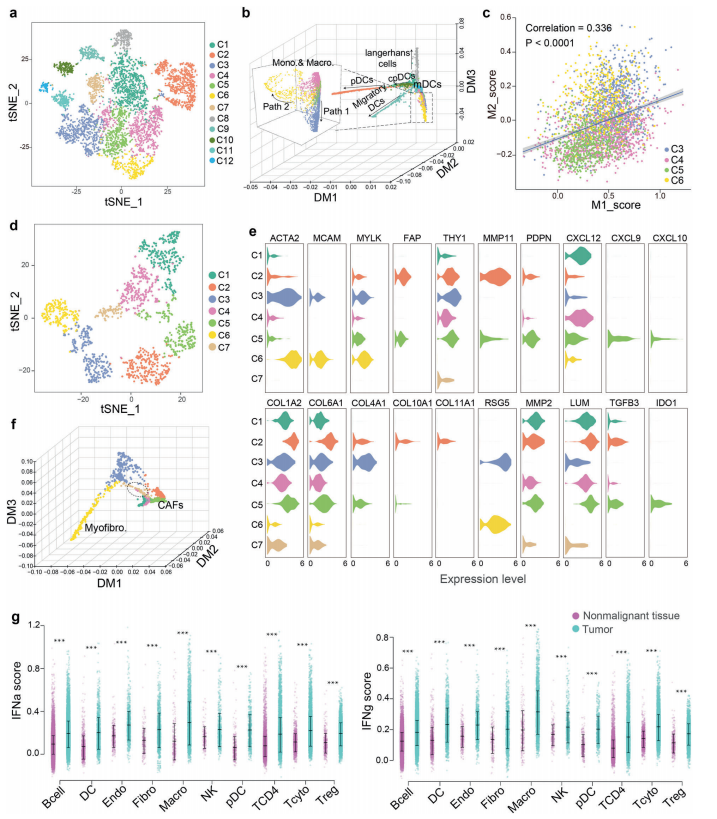
A. 分析了6053个髓系细胞的转录组,包括4646个肿瘤源性细胞和1407个非恶性组织源性细胞。
髓细胞表现出显著的异质性,分为12组.Cluster C2高表达IGJ基因,代表pDCs。C8簇由于其FCER1A的高表达,具有肿瘤特异性,与朗格汉斯细胞相对应。C9集群专门表达CCR7,并代表迁移的DCs.
B. 簇C3、C4、C5和C6代表单核细胞/巨噬细胞,如CD14、CD163和CQ1B等基因构建了一个弥散图来描绘骨髓细胞的发育轨迹.
C. 4个单核/巨噬细胞簇中M1和M2信号呈显著正相关.
D. 捕获了1416个成纤维细胞的转录组,其中1195个来源于肿瘤组织,221个来源于非恶性组织。利用基于图的聚类,我们鉴定出7个成纤维细胞簇。
E. 集群C3和C6显示ACTA2、MCAM和MYLK的高表达水平,从而代表肌成纤维细胞.
F. 纤维细胞的发育轨迹显示肌成纤维细胞和CAFs谱系不同(图4f).
G. 鼻咽癌主要细胞类型IFN-α和IFN-γ评分显著升高,表明鼻咽癌TME中IFN应答整体上调(图4g)。
五、NPC中TME成分和细胞间相互作用

A. 分析了这些标记在RNA-seq中的表达模式。我们分析了140例初治患者鼻咽癌原发肿瘤的基因表达谱,并根据其TME组成的显著差异将其分为5组(G1-G5)(图5a)。G4和G5肿瘤表现出较低的免疫细胞相关特征,而G5肿瘤表现出较高的纤维母细胞相关特征。G1、G2、G3肿瘤免疫细胞丰度较高。特别是,G3肿瘤中含有更多的B细胞,而G2肿瘤中纤维母细胞的比例明显更高(图5a)。
B. 为了验证基于RNA-seq数据的TME分层,我们在额外的鼻咽癌样本中对不同的免疫细胞和基质细胞进行多重免疫组化染色(图5b)。
C. 检查了这些患者的临床记录,发现分成5组的患者表现出不同的无进展生存期(PFS)(图5c)。
D. 大多数肿瘤细胞的传入事件是由成纤维细胞介导的,因为成纤维细胞表达明显更高数量的有效配体,其受体被肿瘤细胞表达(P < 0.01).
E. 鼻咽癌肿瘤细胞通过CXCL10 CXCR3和CXCL16 CXCR6等相互作用对T细胞表现出明显的趋化作用(图5e).
F. 结合单细胞转录组和大量RNA-seq,我们确定了主要在一种细胞类型中表达的基因,但与其他细胞类型的丰度相关。例如,COL6A3、COL14A1和CD248在成纤维细胞中高表达,并与TME中EC丰度呈正相关(图5f).
G. 与黑色素瘤不同,补体基因如C1S、C3、CFH和CFB也在鼻咽癌肿瘤细胞中广泛表达,并与T细胞丰度相关.
H. TME中不同细胞类型与非恶性微环境之间的特异性配体受体相互作用(图5h).

A.与IS-low水平肿瘤细胞相比, IS-high水平肿瘤细胞对T细胞表现出更强的配体受体相互作用,如CXCL11 CXCR3、C3 IFITM1、PDL1 PD1,这说明IS high水平肿瘤细胞具有更大的免疫招募、调节和抑制潜能(图6a)。
B. 在其他鼻咽癌组织上使用荧光激活细胞分选(FACS),检测了TILs上的共抑制受体(如PD-1、lag3、TIM-3、TIM-4和CD276)的表达,并发现CD8+ TILs上的表达与同一鼻咽癌组织中IS-high肿瘤细胞的丰度呈正相关.
C. 肿瘤的双重特征与CD8+ T细胞中共抑制受体的表达相关,如TIM-3/PD-1、lag3 /PD-1和CD276/PD-1,反映了CD8+ TILs更深层次的功能障碍(图6c).
D-E.通过ELISPOT实验检测TILs与IS-high肿瘤细胞共培养产生的IFN-γ较少(图6d, e)。
F.高is肿瘤细胞具有更强的免疫抑制能力。通过将肿瘤细胞与TILs共培养,与is低的肿瘤细胞相比,is高的肿瘤细胞诱导具有共抑制受体表达的CD8+ TILs比例更高(图6f)






