外泌体破坏皮肤的机制

Stevens-Johnson综合征(SJS)和中毒性表皮坏死松解症(TEN)是危及生命的药物不良反应,主要表现为发热、严重红斑、由角化细胞凋亡和坏死松解引起的大面积表皮损伤。SJS/TEN中角质形成细胞的凋亡可能是由细胞毒性细胞或可溶性FasL、穿孔素或颗粒素引起的。然而,对SJS/TEN中表皮细胞凋亡的分子机制了解甚少。
2020年12月17日,第四军医大学西京皮肤医院在 Science 子刊 Science Translational Medicine 杂志在线发表题为Plasma exosomal miR-375-3p regulates mitochondria-dependent keratinocyte apoptosis by targeting XIAP in severe drug-induced skin reactions 的研究论文,报道了SJS/TEN患者血浆外泌体破坏皮肤的机制。
作者假设血浆来源的外泌体通过向皮肤传递miRNA信号诱导SJS/ TEN 患者的角质形成细胞凋亡。为了验证我们的假设,我们从SJS/TEN患者的血浆中纯化和表征了外泌体,并使用下一代测序来比较来自健康对照组和多形红斑(EM)或SJS/TEN患者的血浆衍生外泌体的miRNA谱。我们发现,与其他组相比,miR-375-3p在TEN 个外泌体中显著上调。我们进一步研究了miR-375-3p的潜在靶点,并研究了其对人原代角质形成细胞凋亡的影响。
技术路线:
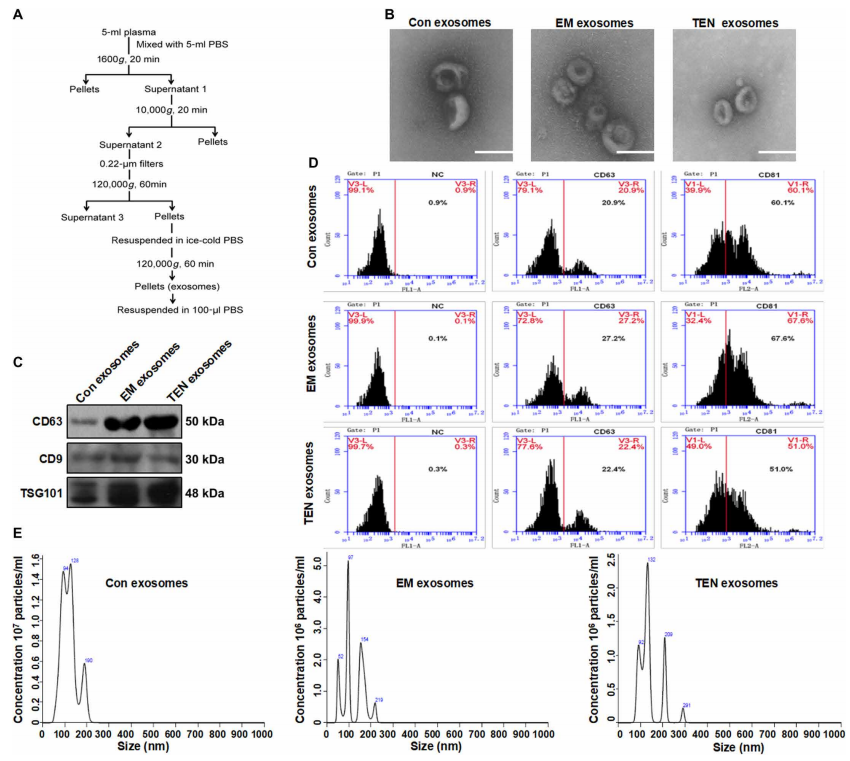
一、血浆外泌体的表征
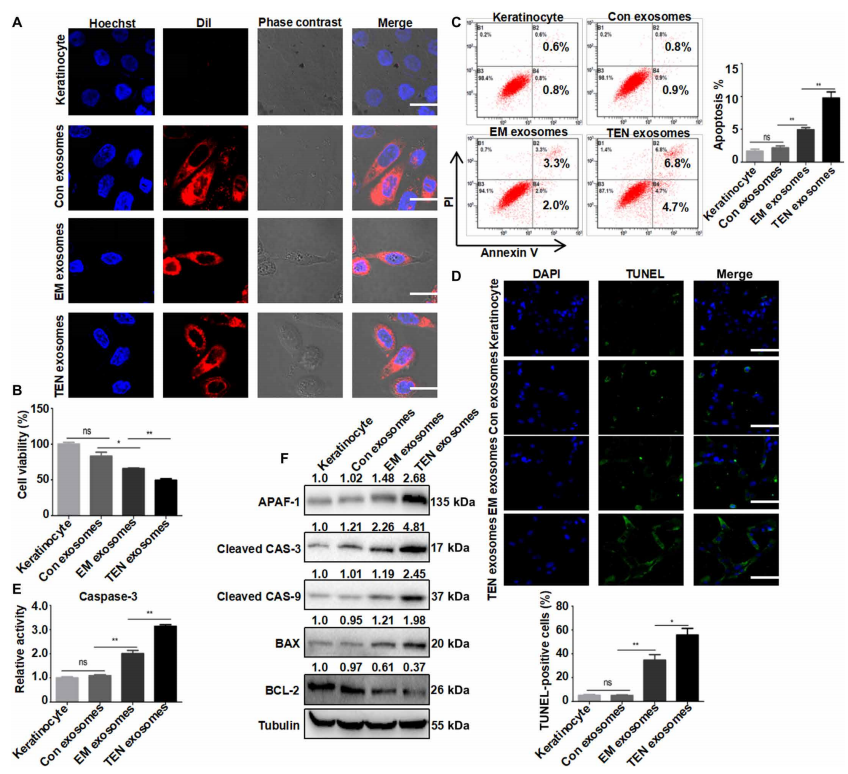
Annexin V和TUNEL分析表明, TEN外泌体处理过的人类原代角质形成细胞的凋亡显著增加(图2、C、D)。
Caspase-3 (CAS-3)活性在 TEN外泌体组中上调,但在对照组中未上调(图2E)。
TEN外泌体也上调cleaved caspase-3 (CAS-3)、cleaved caspase-9 (CAS-9)、BAX和凋亡蛋白酶激活因子1 (APAF-1),但显著下调BCL-2(图2F).
附图: TEN外泌体组中,分离细胞质和线粒体部分,Western blotting结果表明从线粒体释放的CYTO-C显著减少,但细胞质中的CYTO-C显著增加。与EM或健康个体相比,SJS/ 10患者表皮中Cleaved CAS-3、CAS-9和BAX的活性更强。
总之,TEN外泌体被人类原代角质形成细胞内化并促进细胞凋亡。此外,在SJS/ TEN病灶中,焦亡、铁死亡、坏死和自噬的标记物显著增加(图。S4 S8)。
三、药疹中血浆来源的外泌体miRNA表达谱
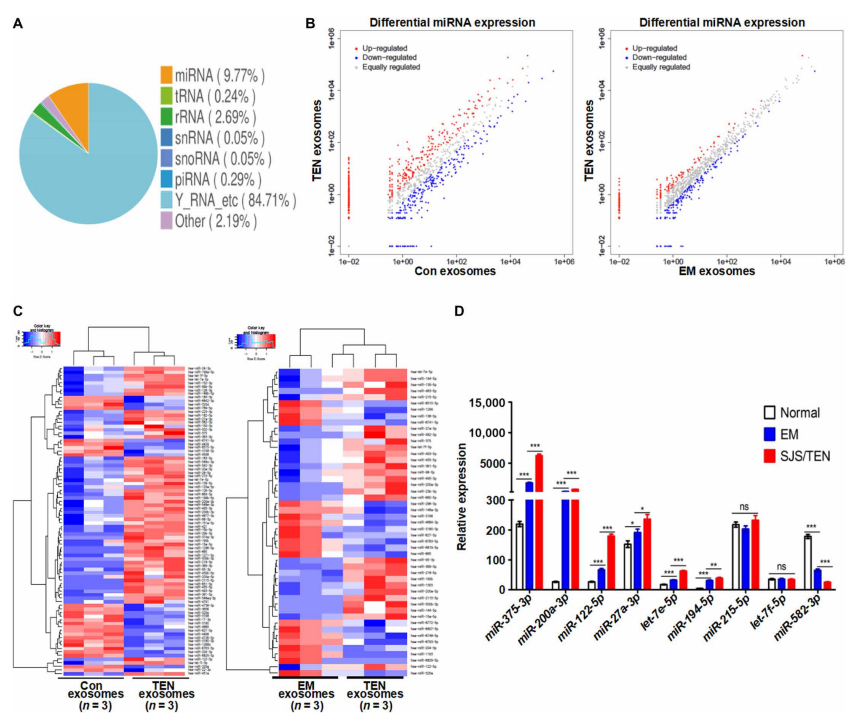
与EM和对照外泌体相比,Hsa-miR-375-3p、hsa-miR-200a-3p、hsa-miR-122-5p、hsa-miR-27a-3p、hsa-miR-582-3p、hsa-let-7e-5p、hsa-miR-194-5p、hsa-miR-215-5p和hsa-let-7f-5p是TEN中最丰富的miRNA类型。与其他组相比,miR-375-3p在TEN外泌体中显著上调,比miR-200a-3p高10倍,比miR-122-5p高30倍(图3D)。因此,后续的研究中使用了miR-375-3p。
四、miR-375-3p通过线粒体依赖途径在体外促进人原代角质形成细胞凋亡
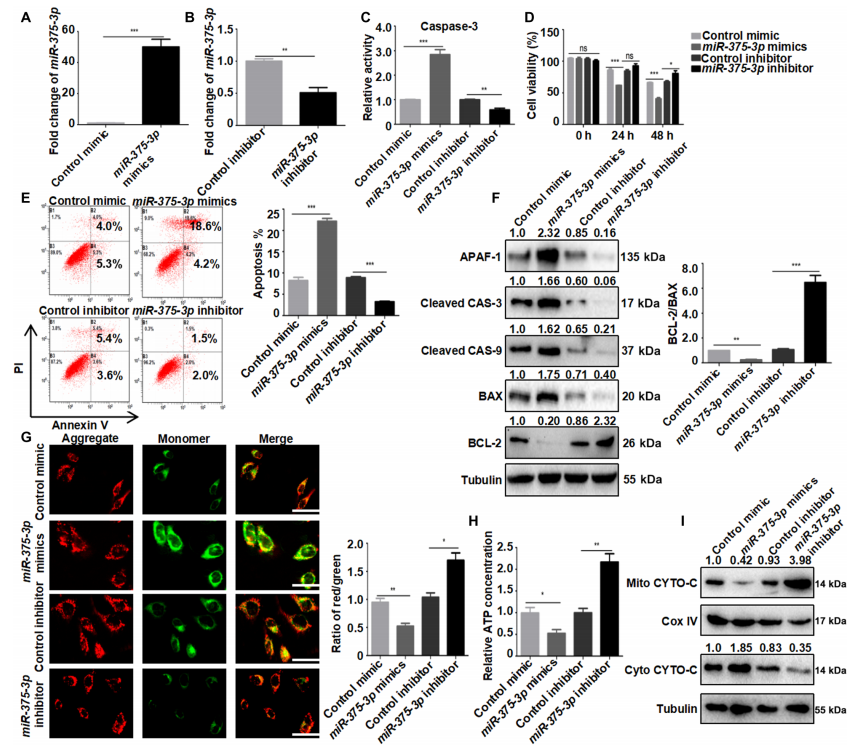
转染miR-375-3p可显著上调CAS-3活性,降低角质形成细胞活力,增加角质形成细胞凋亡,而转染miR-375-3p抑制剂则有相反的效果(图4,C到E)。
角质形成细胞中miR-375-3p过表达上调BAX、cleaved CAS-3、cleaved CAS-9和APAF-1;降低BCL-2;降低BCL-2/BAX比值(图4F和S9A)。
原位杂交结果显示,与TEM患者或健康个体相比,SJS/TEN 患者的表皮组织中miR-375-3p更为显著(图S10A)。miR-375-3p信号在SJS/TEN患者下/中表皮凋亡细胞中最为明显,提示miR-375-3p可能促进角质形成细胞凋亡。线粒体缺陷与凋亡密切相关,BCL-2与BAX表达失衡可能与线粒体功能障碍相关(16)。TEM显示SJS/TEN 患者线粒体肿胀、嵴缺失,而对照组线粒体显示典型管状模式(图S10B)。
miR-375-3p过表达促进了线粒体膜电位(MMP)崩溃,降低了三磷酸腺苷(ATP)的产生,这两者都表明线粒体功能障碍(图4,G和H)。
过表达miR-375-3p后,从线粒体到细胞质的细胞色素易位增加,并被miR-375-3p抑制所阻断(图4I和图S9B)。
这些数据表明,miR-375-3p通过线粒体依赖途径促进角质形成细胞凋亡。
五、XIAP是miR-375-3p在人原代角质形成细胞中的直接靶点
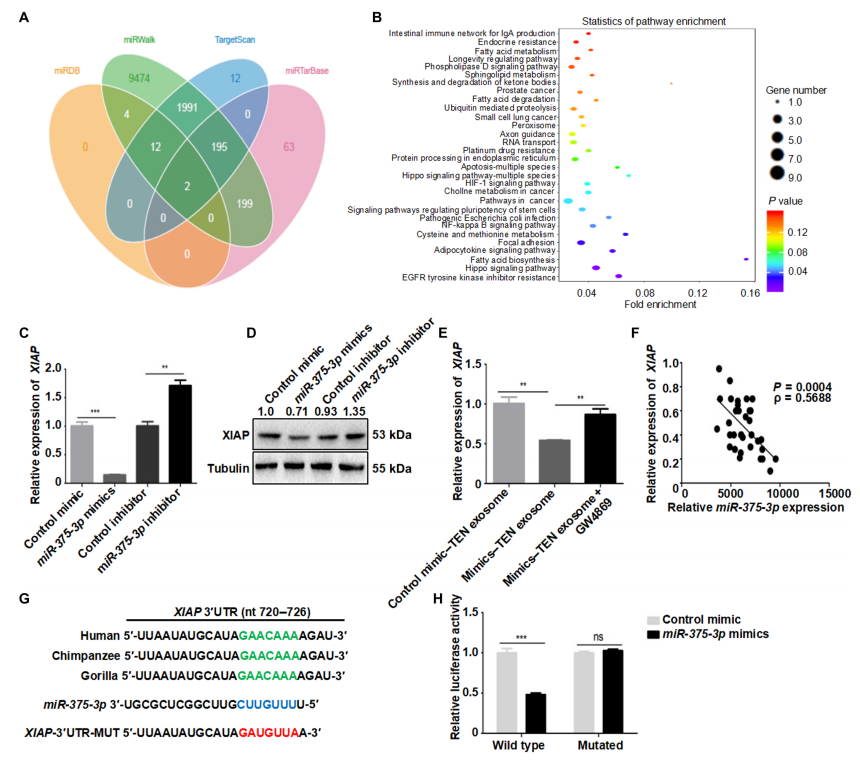
应用TargetScan、miRDB、miRWalk、miRTarBase和KEGG通路分析预测miR-375-3p的靶基因(图5,A和B)。根据KEGG通路预测,miR-375-3p促进凋亡的候选靶基因如下:真核翻译起始因子2,亚单位α(EIF2S1/EIF2),杆状病毒凋亡抑制蛋白(IAP)重复包含3 (BIRC3)和x -连锁凋亡抑制蛋白(XIAP)。EIF2S1 3’ UTR中的miR-375-3p结合位点在灵长类动物中是保守的(图S13A),并且miR-375-3p mimics在野生型中降低了荧光素酶活性,而在突变型中却没有(图S13B)。然而,SJS/ TEM患者中EIF2S1的表达增加,以及已知EIF2S1在促进内质网应激诱导的凋亡方面的积极作用,表明EIF2S1不可能是miR-375-3p的靶基因(图S13C)。接下来,我们研究了BIRC3的表达,它也被称为细胞凋亡抑制剂(cellular inhibitor of apoptosis, cIAP2),是一种IAP。BIRC3在来自健康表皮的角质形成细胞中表达,但在SJS/ 10表皮中仅微弱表达(图S14A)。然而,无论是野生型还是突变型,miR-375-3p mimics都未能降低荧光素酶活性(图S14, B和C),这表明BIRC3不是miR-375-3p的靶标.XIAP作为miR-375-3p的中心靶点,以及SJS/TEN中角质形成细胞死亡的潜在调控因子。
六、过表达miR-375-3p导致XIAP表达下调,促进角质形成细胞凋亡
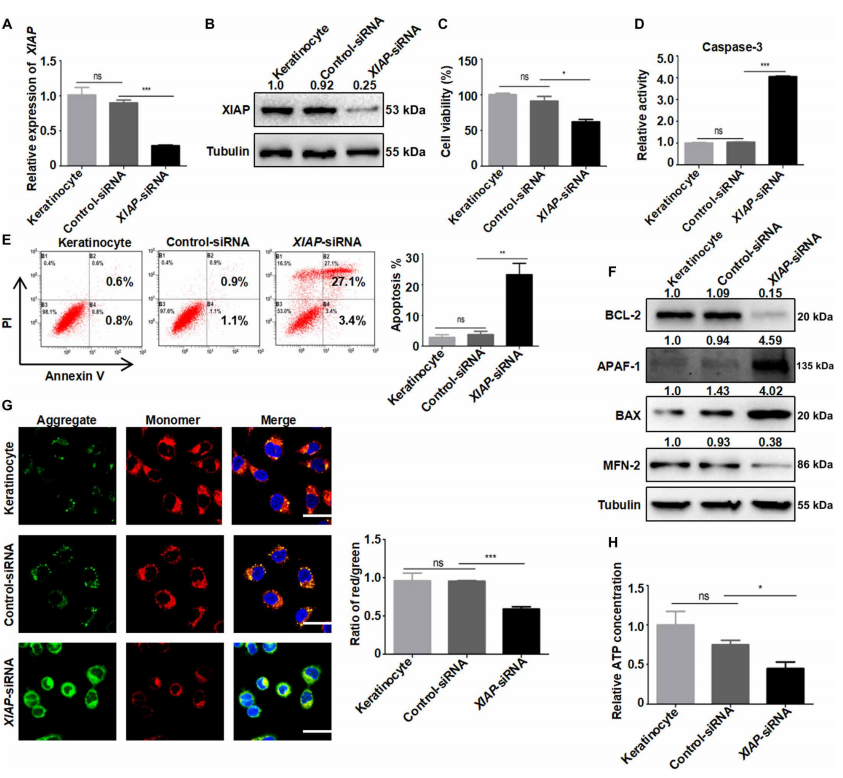
为了确定XIAP是否也促进角质形成细胞凋亡,我们使用小干扰RNA (small interfering RNA, siRNA)敲低XIAP表达(图6,A和B,以及图S17A),导致角质形成细胞活力显著降低图6)。当XIAP被下调时,CAS-3活性和凋亡率也升高(图6、D和E), APAF-1、BAX和BAK的丰度显著升高(图6F和图S17、B和C)。
XIAP的下调促进了MMP的破坏,降低了ATP的产生(图6,G和H)。我们进一步表明,XIAP下调后,BCL-2和MFN-2下调,而XIAP过表达则产生相反的作用(图S18, A和B)。BCL-2和MFN-2的蛋白丰度比mRNA丰度受影响更显著(图S18C)。在用蛋白酶体抑制剂MG132处理后,即使在初级角质形成细胞中XIAP被下调,BCL-2和MFN-2的表达也没有改变,这表明XIAP在翻译后水平上并没有调控BCL-2和MFN-2(图S19)。然后,我们探讨了XIAP是否可以通过环己酰亚胺(CHX)阻断蛋白合成来调节BCL-2和MFN-2的稳定性。结果表明,BCL-2的半衰期为6 ~ 9 h;然而,在过表达XIAP的组中,BCL-2的半衰期增加到9 ~ 12小时,表明XIAP诱导的BCL-2的稳定性增强(图1)。S20和S21)。在过表达XIAP的细胞中,MFN-2的半衰期由对照组的6 ~ 9小时延长至9 ~ 12小时。同样,XIAP敲除降低了MFN-2和BCL-2的稳定性(图。S20和S21)。鉴于XIAP可通过调节miRNA表达促进表皮生长因子受体(epidergrowth factor receptor, EGFR)的翻译(18),XIAP可能通过间接机制在翻译水平上调控BCL-2和MFN-2的稳定性。
七.SJS/ TEN患者血浆外泌体中miR-375-3p的表达与临床特征相关
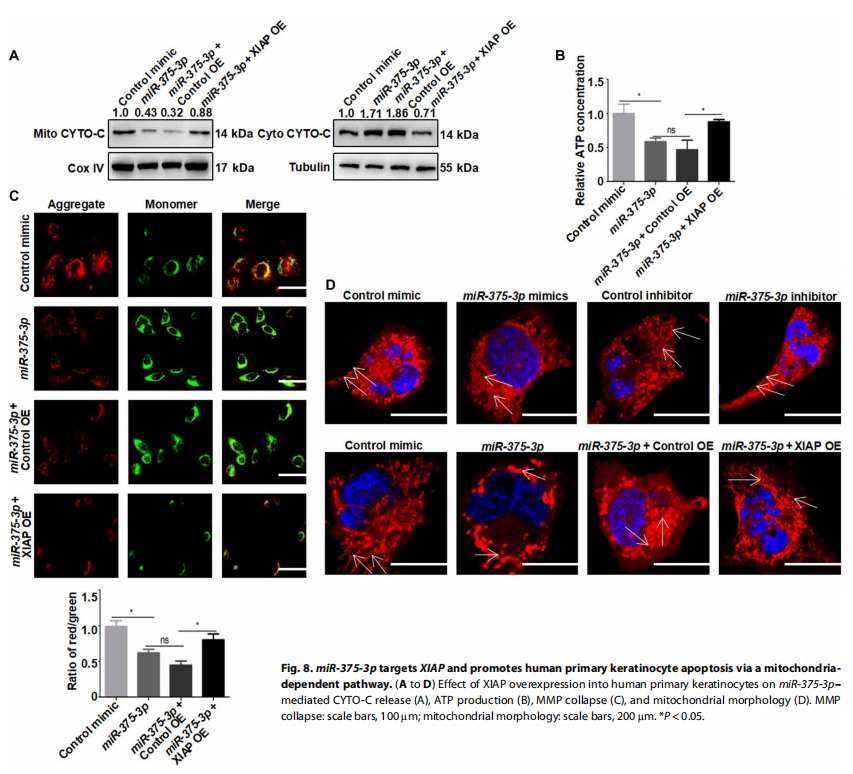
在SJS/TEN患者中,外泌体miR-375-3p与葡萄糖呈弱正相关,而与c -肽和胰岛素呈负相关(图S28, D至F)。在高糖条件下胰腺是否会增加血浆外泌体miR-375-3p。我们比较了SJS/TEN患者在治疗前和治疗后的循环外泌体miR-375-3p,发现在发病后糖皮质激素治疗2周后miR-375-3p下降(52.5%)(图S28G)。






