开发出治疗帕金森病新策略!包覆基因-化学纳米复合物的外泌体可以清除α突触核蛋白和激活帕金森病免疫

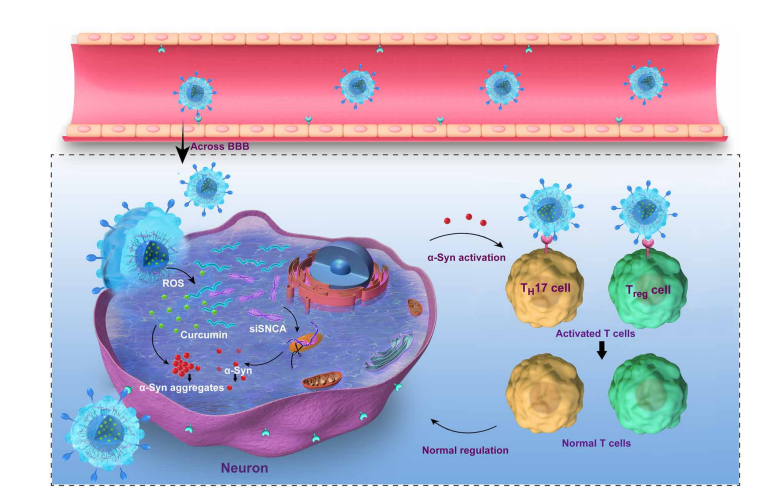
2020年12月,来自中国科学院过程工程研究所生化工程国家重点实验室、中国科学院大学与北京理工大学生物工程学院团队合作在Science advance杂志上发表了文章“Targeted exosome coating gene-chem nanocomplex as "nanoscavenger" for clearing α-synuclein and immune activation of Parkinson's disease.”。此文献描述了一个工程核-壳杂交系统,名为狂犬病毒糖蛋白(RVG)肽修饰的外泌体(EXO) curcumin/苯基硼酸-聚(2-(二甲氨基)丙烯酸乙酯)纳米粒子/靶向SNCA (REXO-C/ANP/S)的小干扰RNA。它是一种清除-突触核蛋白聚集物并降低其在帕金森病神经元中的细胞毒性的纳米清除剂。经REXO-C/ANP/ s治疗后,帕金森病小鼠的运动行为得到显著改善。团队也证明REXO-C/ANP/S是一种清除免疫激活的纳米清除剂,因为其天然不成熟的树突状细胞外膜。总之,REXO-C/ANP/S可作为神经退行性疾病的治疗平台。
对于神经退行性疾病,可以利用基因和小分子药物协同清除引起神经元变性的病理物质。
在帕金森病(Parkinson s disease, PD)中,α突触核蛋白 (α-syn)聚集物被认为是主要的病理物质。siRNA在罕见疾病或没有良好药物选择的疾病中表现出潜力,但与基因相关。例如,针对SNCA的siRNA (siSNCA)可以通过下调α-syn蛋白的合成来抑制α-syn聚集物的形成。神经保护小分子药物姜黄素对已有的α-syn聚集物具有降低作用。因此,siSNCA与姜黄素联合可以协同降低α-syn聚集物对PD治疗多巴胺能神经元的细胞毒性。然而,因为它们的吸收能力差,新陈代谢快,这些生物利用度较差的药物难以在靶神经元的作用部位聚集。此外,脑输送问题主要表现为输送系统难以通过血脑屏障(BBB),不能准确识别靶细胞。
合成基因和化学药物(gene-chem)纳米复合物,包括脂质体和聚合物颗粒,已被修饰为细胞穿透多肽或细胞靶向分子,以增强药物输送在脑疾病或其他疾病的治疗。然而,合成的纳米复合物容易被识别为外来物,导致自然免疫激活、细胞凋亡、血液循环时间短,不安全且效率低。此外,当这些合成载体被内化时,会经历一个内溶酶体途径,这往往导致药物降解和胞外作用,并导致炎性小体激活。此外,有必要控制药物在病变区域的释放,以减少非特异性毒性。因此,为了有效地将基因化学药物递送到靶细胞的作用部位以实现PD的安全治疗,有必要开发一种能够克服这些递送瓶颈的递送系统,包括低血脑屏障通透性、神经元靶向性差、胞浆内吞效率低下和药物释放不可控等。
为了实现上述目标,作者设计了一种靶向外泌体涂层基因-化学纳米复合物,作为神经元α-syn聚集物和PD免疫激活的工程纳米清除剂。外泌体是一种经过充分研究的siRNA和化学药物的天然源载体,直径为30至100纳米。它具有一种膜结构,其表面特异性蛋白四asppanin CD9促进直接膜融合,并帮助内部物质直接运输到受体细胞的细胞质中,避免了溶酶体诱捕。
进一步有效地提供药物通过BBB和多巴胺能神经元,第一个过程的工程是构建壳,REXO一种靶向的未成熟树突状细胞(imDC)衍生的外泌体,该外泌体由狂犬病毒糖蛋白(RVG)肽修饰而成,具有29个氨基酸,能特异性结合神经元细胞和BBB表达的乙酰胆碱受体。由于外泌体很难同时装载亲水基因和疏水小分子药物,工程的第二个过程是作为一个基因-化学包覆核心的产品实现的,这是一个响应活性氧(ROS)的基因化学药物纳米复合物装载这两种不同特性的药物。第三种工艺是REXO-C/ANP/S纳米清除剂的制备。REXO被涂在纳米复合物上形成纳米清除剂。因此,该工程传递系统能够有效穿过血脑屏障,靶向神经元,并在多巴胺能神经元病变的高ROS环境中释放药物。富集的siSNCA和姜黄素对α-syn蛋白下调和α-syn聚集抑制具有协同作用。
技术路线:
一、REXO-C/ANP/S的制备方法及表征
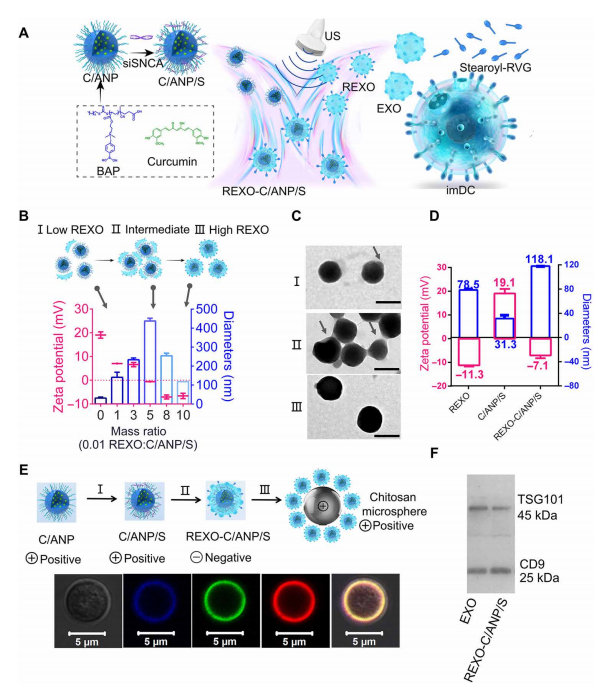
杂化纳米粒子(NP) REXO-C/ANP/S的制备由两部分组成(图1A):基因化学核心C/ANP/S的制备和REXO的获取。核心C/ANP/S是通过两步法得到的。首先,我们合成了聚合物ba -聚(2-(二甲氨基)丙烯酸乙酯)(BAP)和bb -聚(2-(二甲氨基)丙烯酸乙酯)(BBP)(图S1A)。
核磁共振H表明BAP和BBP合成成功(图S1, B到D)。两亲性聚合物BAP可自组装并包封疏水性药物姜黄素,形成姜黄素/BAP NP (C/ANP)。采用Multiskan光谱法计算姜黄素在NP中的加载率,加载率为70%。接下来,通过静电相互作用形成最终的C/ANP/siSNCA (C/ANP/S)和C/BNP/siSNCA (C/BNP/S)纳米配合物(图1A)。随后运用gel retardation assay,现siSNCA完全附着在5的N/P(聚合物的氮部分/ siRNA的磷部分)C/ANP(图S2A)。
第二部分是rvg修饰外泌体的制备REXO,使用频率为40 kHz、功率为100 W的bath超声器,通过超声波方法组装内芯和外部REXO(图1A)。。
分离并收集含有外泌体的指定编号7,8,9的片段。通过透射电子显微镜(TEM)确定imDC外泌体为囊泡结构,水动力直径约为70 nm, zeta电位为12.7 mV(图2E)。
DiD外泌体与硬脂酰rvgfitc的共定位系数为0.95(图S3E),表明RVG成功修饰外泌体。
组装过程假设如图1B所示,并通过TEM、尺寸和zeta电位测量进行验证(图1C)。
在REXO和C/ANP/S复合物中,在REXO-to-C/ANP/S质量比0.05以下,REXO吸附到C/ANP/S部分表面(图1C, I)。
当NPs的质量比为0.01时,NPs的粒径增加到141.0 nm, zeta电位下降到7.05 mV。当比值为0.05时,存在一个中间态。尺寸增大到437.5 nm, TEM显示C/ANP/S通过REXO交联(图1C, II)。最后,负电荷占主导地位的NPs趋于稳定。
当质量比为0.1时,最终的核-壳单分散组装形成如图1C (III)所示,这表明REXO被涂覆在核纳米配合物的表面。最终的NP REXO-C/ANP/S带负电荷7.1 mV,流体动力直径为118.1 nm(图1D)。
接下来,为了便于直观观察组装组分,制备了带正电的聚壳聚糖微球,允许带负电的组装体在表面吸附(图1E)。
外泌体用亲脂性染料DiI标记。结果清楚地显示了DiI外泌体、Cy5-siRNA和姜黄素的共定位(图1E和图S3F)。
此外,组装后得到的REXO-C/ANP/S含有EXO的TSG101和CD9蛋白(图1F),进一步表明包衣成功。
二、通过REXO涂层增强REXO- c /ANP/S的药物传递
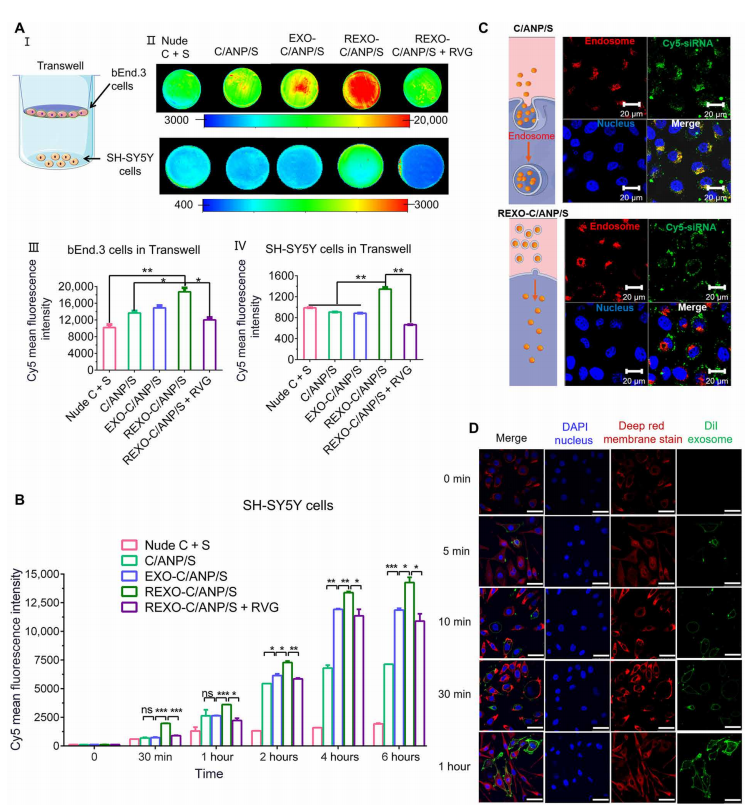
模拟REXO-C/ANP/S和C/ANP/S的体外给药过程。我们使用Transwell培养法模拟血脑屏障(图2A, I)。
bEnd.3细胞在Transwell插入物中培养7天(6孔中插入1x105个细胞,孔径0.4 m, 4.67 cm2),形成单层细胞,经上皮电阻至少200欧姆·cm2。
加入NPs后,利用柯达体内成像系统FX Pro进行生物发光成像,检测Cy5平均荧光强度。REXO涂层显著增强了C/ANP/S中siRNA药物进入bEnd.3细胞。然后通过上皮细胞分化为SH-SY5Y细胞(图2A, II至IV)。作为比较,增加免费RVG肽抑制促进效应(图2,II IV)。通过比较的siRNA SH-SY5Y细胞在不同时间点(图2 b),发现REXO涂层显著提高药物的吸收在C / ANP / S。2小时后,EXO和REXO包衣组EXO-C/ANP/S和REXO-C/ANP/S显著优于裸姜黄素和siRNA(裸C + S)以及内核C/ANP/S。这是因为C/ANP/S中的季胺类化合物通过核内体-溶酶体途径将C/ANP/S内吞,造成NP外排和药物损失,因此药物积累随着时间的增加并不明显(图2B)。
共聚焦激光扫描显微镜(CLSM)实验结果比较了两种体系的内吞机制(图2C)。
随着时间的延长,DiI的荧光增强,从5分钟到1小时,明显与深红色膜染色的荧光共定位(图2D和图S4B)。
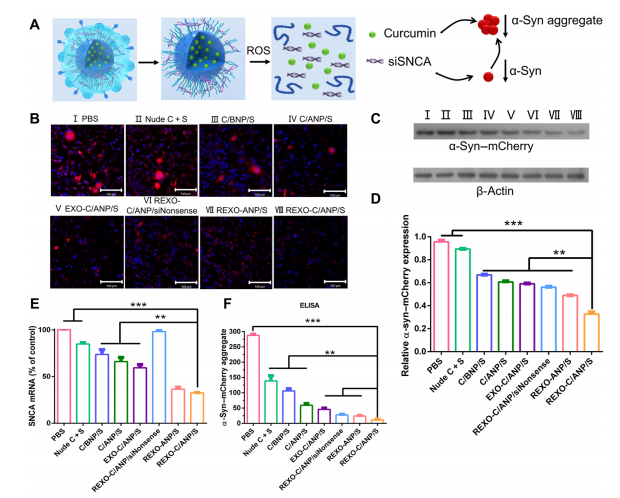
α-syn聚集物是PD神经元的主要病理物质。因此,清除PD处理中的α-syn聚集物和多余的-syn非常重要(图3A)。
裸药和不同NPs与SNCA mCherry SH-SY5Y细胞共培养2天。 CLSM观察到-α-syn mCherry过表达细胞系中的α-syn聚集物,其中mCherry为α-syn的红色报告因子(图3B)。
Western blot也验证了总α-syn表达[图。3、C和D;47 kDa (α-syn为18 kDa, mCherry为29 kDa)]。
与无姜黄素的NP REXO-ANP/S和siNonsense NP REXO-C/ANP/siNonsense相比,REXO-C/ANP/S具有下调优势。
此外,除REXO-C/ANP/ siNonsense处理的细胞外,np处理的细胞SNCA mRNA表达低于pbs处理的细胞。REXO-C/ANP/S处理后的细胞SNCA mRNA表达下降64%(图3E)。此外,酶联免疫吸附试验(ELISA)显示,NP用药组处理的细胞中-syn聚集物显著减少(图3F)。
四、增强体内神经元恢复
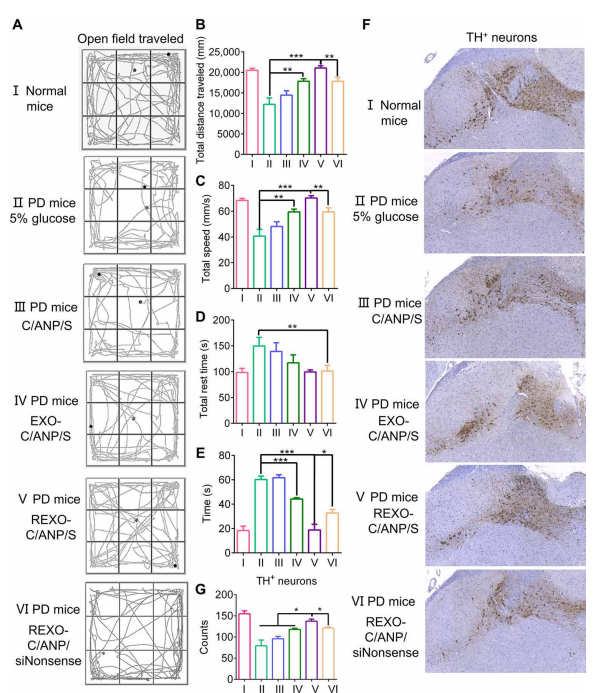
给药10次后记录行为。PD小鼠在开阔区域表现出运动迟缓,并且在中间区域行走较少(图4A, II)。
在开阔场地进行30分钟的定量数据显示,它们的总距离减小,移动速度减慢,所需的休息时间变长[图2]。4、B to D (II)。
NP组小鼠的运动能力有改善的趋势,尤其是REXO-C/ANP/S组[图4]。4、B到D (III到VI)]。
在极点实验中,经过REXO-C/ANP/S处理后,到达杆尖的时间明显缩短(图4E)。
这种优势在小鼠解剖后的大脑切片中也得到了体现。注射REXO-C/ANP/S的PD小鼠神经元修复效果优于其他各组(图4,F和G)。
此外,苏木精对np处理过的小鼠脏器载玻片染色表明其安全性,不会对小鼠肝脏或其他脏器造成负担(图S7)。
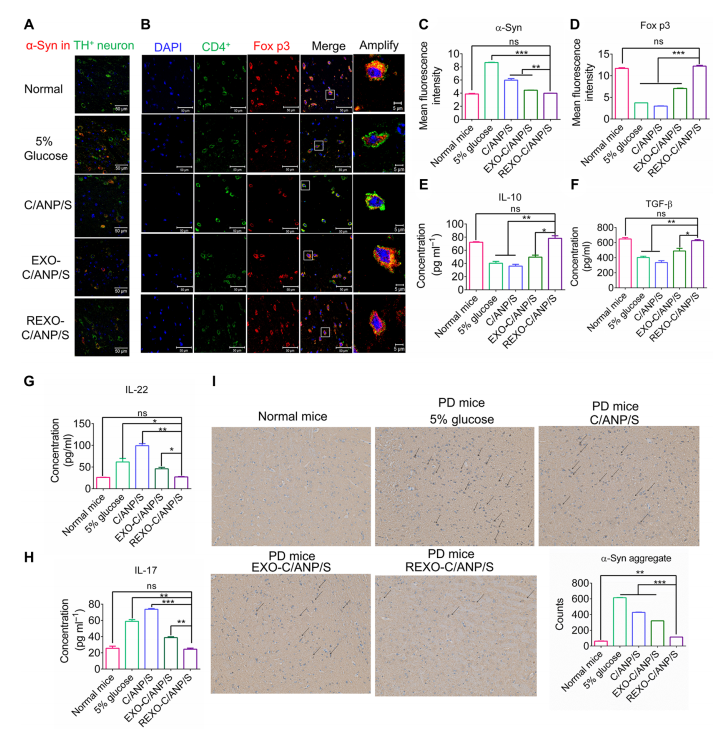
通过对处理小鼠SN区进行染色,我们得出协同载药C/ANP/S纳米复合物对TH+神经元α-syn有清除作用,但EXO-C/ANP/S和REXO-C/ANP/S的清除作用更明显,特别是靶向NP REXO-C/ANP/S(图5,a和C)。这是由于靶向外泌体优越的递送优势。此外,我们还探索了小鼠免疫微环境的改善。结果表明,imDC外泌体的作用可以清除PD小鼠的T细胞激活。在小鼠经NPs处理后,我们发现EXO-C/ANP/S,特别是REXO-C/ANP/S可以显著增加CD4阳性(CD4+) T细胞中Fox p3的表达(图5,B和D)。
此外,REXO-C/ANP/S可显著增加PD中TGF-和IL-10(图5,E, F)。已有研究证实TGF-信号具有抗炎作用,主要是神经保护作用。此外,IL-22和IL-17与自身免疫性疾病相关,并以免疫细胞因子的形式高表达。激活的TH17细胞分泌并产生IL-22和IL-17免疫细胞因子。结果表明,REXO-C/ANP/S可显著降低PD中IL-22和IL-17因子(图5,G和H)。






