间充质干细胞诱导的lncRNA 与肿瘤耐药
导语:曲妥珠单抗耐药已成为乳腺癌治疗的主要障碍,间充质干细胞(MSCs)在耐药性的形成过程中发挥关键作用,然而,其潜在机制尚不清楚。长链非编码RNAs(lncRNAs)参与肿瘤进展,参与调节曲妥珠单抗耐药性。MSCs与lncRNAs产生哪些调控效应,这里告诉你。
参考文献:IF=7.971

技术路线:

结果:
1. MSC引起乳腺癌(BC)细胞干性和曲妥珠单抗耐药
为分析MSCs对干性和曲妥珠单抗耐药的影响,将SKBR-3和BT474两种HER-2 + BC细胞系与MSCs共培养,发现细胞的球形形成能力显著提高,干性基因均显著上调,CD4阳性细胞的比例增加。CCK8检测结果显示骨髓间充质干细胞培养降低了曲妥珠单抗介导的细胞毒性,表明骨髓间充质干细胞在体外诱导曲妥珠单抗耐药。
在异种移植模型中证实MSC的作用。将SKBR-3细胞注射到裸鼠体内,或与骨髓间充质干细胞混合注射,各组腹腔内给予曲妥珠单抗治疗。结果发现SKBR-3细胞单独作用未能生成异种移植物,然而,与骨髓间充质干细胞的细胞混合物成功建立了异种移植物,增加了SKBR-3细胞移植的肿瘤重量。IHC检测曲妥珠单抗耐药组织和BC患者曲妥珠单抗应答组织中MSC表面抗原CD29和CD90的表达,发现耐药组CD29 +/CD90 + 患者的比例显著增高,较高的CD29 +/CD90 + 组织与临床分期呈正相关。以上结果提示骨髓间充质干细胞共培养可诱导干性和曲妥珠单抗耐药。

2. MSC诱导的lncRNA AGAP2-AS1介导干性和曲妥珠单抗耐药
为鉴定AGAP2-AS1是否由骨髓间充质干细胞诱导,检测其在与骨髓间充质干细胞共培养的SKBR-3和BT474细胞中的表达,发现与MSCs共培养的细胞中AGAP2-AS1显著上调。AGAP2-AS1在CD29 + CD90 + 患者BC组织中上调。研究AGAP2-AS1对干性的影响,过表达AGAP2-AS1后BC细胞中AGAP2-AS1和干性基因上调,CD44 + BC细胞比例增加,诱导BC细胞球体形成和曲妥珠单抗耐药。沉默AGAP2-AS1效果相反。这些表明MSC通过诱导AGAP2-AS1引起干性和曲妥珠单抗耐药。
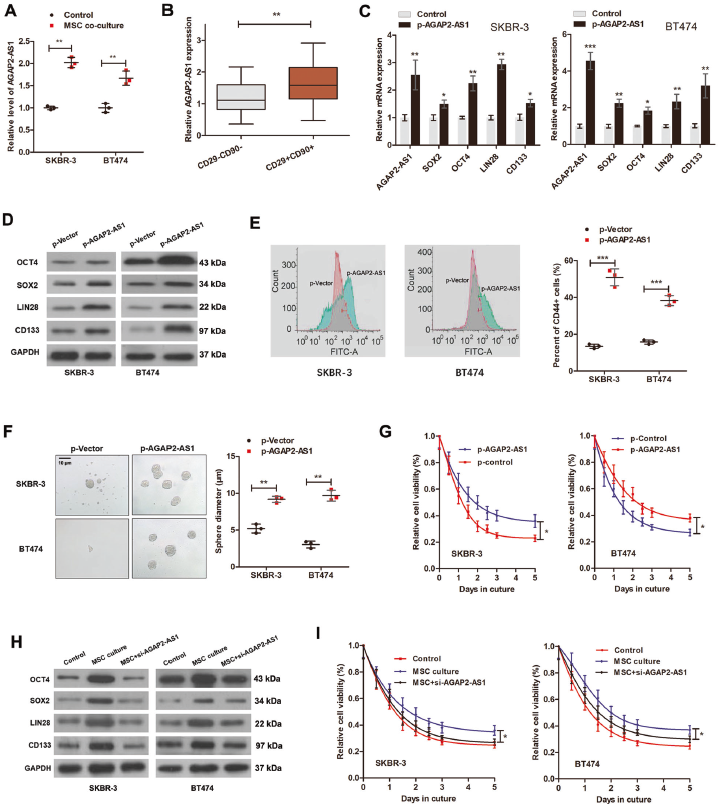
3. AGAP2-AS1对干性和曲妥珠单抗耐药性的作用依赖于FAO
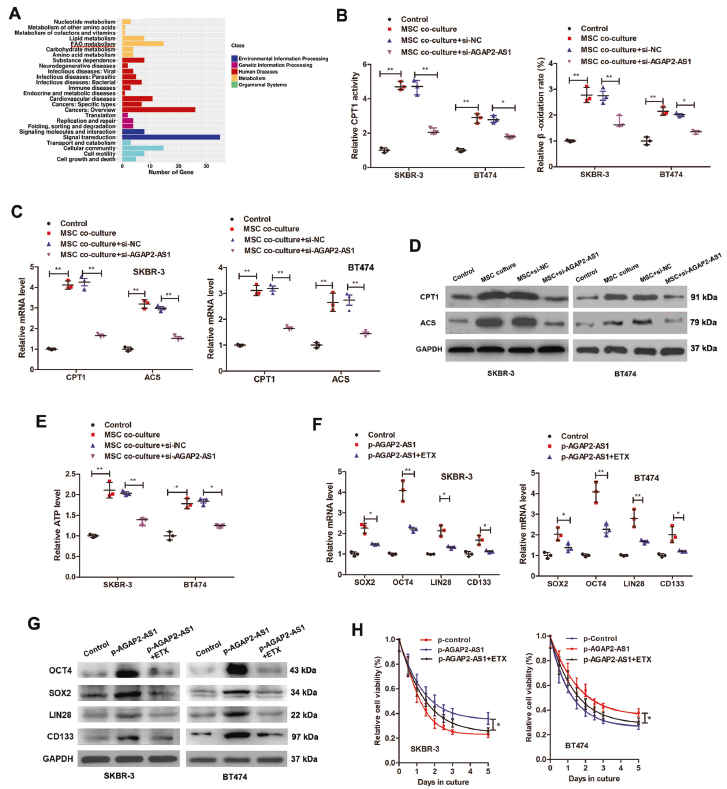
使用starBase3.0获得AGAP2-AS1的靶基因,并通过DAVID6.8进行KEGG通路分析。发现AGAP2-AS1靶基因在代谢中显著富集,如FAO代谢。MSC共培养诱导了CPT1的活性和β-氧化率的增强,这种效应被敲除AGAP2-AS1所抵消。AGAP2-AS1的沉默也可逆转MSC引起的CPT1、乙酰辅酶A合成酶(ACS)和ATP水平的上调。为证实FAO对于MSC-AGAP2-AS1诱导的干性和曲妥珠单抗耐药性至关重要,使用FAO抑制剂依托莫西韦,发现抑制FAO可逆转AGAP2-as1诱导的干性基因,可消除AGAP2-AS1诱导的曲妥珠单抗耐药。表明MSC通过AGAP2-as1介导FAO诱导干性和曲妥珠单抗耐药。
4. AGAP2-AS1与HuR相互作用
进一步探索AGAP2AS1的调控机制,利用RNA FISH和细胞核-细胞质分离qPCR鉴定亚细胞位置。结果提示,AGAP2-AS1位于细胞质。使用生物素化的AGAP2-AS1进行了RNA pull down实验,质谱分析和western blotting鉴定出AGAP2-AS1的RNA结合蛋白-ELAV家族成员HuR。RIP试验进一步证实AGAP2-AS1和HuR之间的直接相互作用RNA-FISH验证AGAP2-AS1和HuR共定位在SKBR-3细胞的细胞质中,系列缺失分析发现AGAP2-AS1的900-1531nt区域对与HuR结合至关重要。POSTAR2预测在AGAP2-AS1的937-957nt区域显示HuR的结合基序。而且,敲除HuR可消除干性和曲妥珠单抗耐药性。上述结果证实AGAP2-AS1可能通过与HuR蛋白相互作用,在干性和曲妥珠单抗耐药中发挥重要作用。
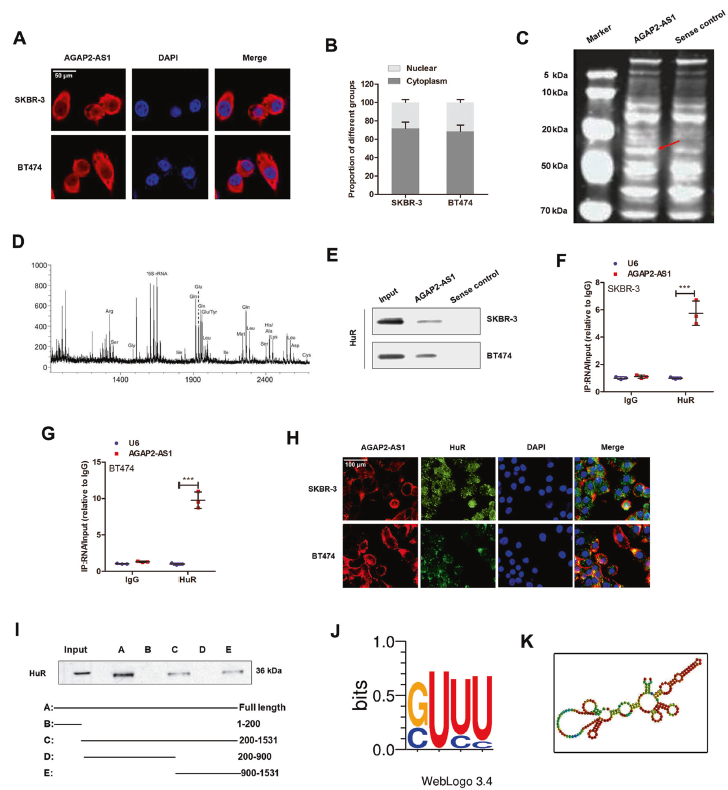
5. AGAP2-AS1-HuR复合物促进CPT1的稳定性
由于CPT1在AGAP2-AS1调节的FAO过程中上调,假设CPT1可能是AGAP2-AS1–HuR复合物的直接靶点。MSCs共培养诱导CPT1的上调,当AGAP2-AS1在骨髓间充质干细胞中沉默时,这种上调被废除,证明MSC来源的AGAP2-AS1诱导CPT1上调。敲低HuR可显著抑制CPT1表达,并在转录和蛋白水平均可消除AGAP2-AS1诱导的CPT1表达。通过CPT1 RNA探针进行RNA pull down,验证HuR和CPT1之间的直接相互作用,HuR抗体进行RIP分析进一步验证。
使用放线菌素D阻断RNA转录时, HuR沉默细胞中CPT1 RNA的稳定性被显著抑制。过表达AGAP2-AS1增加CPT1 mRNA的稳定性,HuR沉默显著逆转此类效应,表明HuR对于AGAP2-AS1诱导的CPT1 mRNA稳定性至关重要。以上结果表明AGAP2-AS1–HuR直接结合CPT1 mRNA并维持其稳定性。
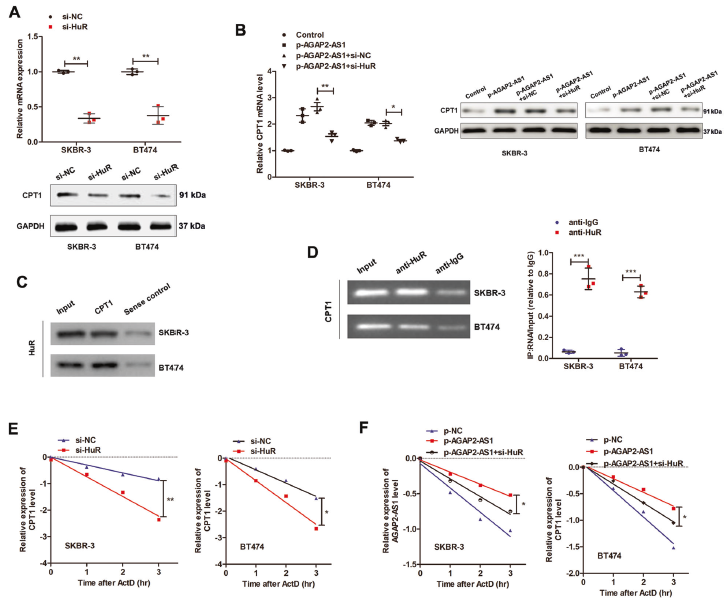
6. AGAP2-AS1海绵miR-15a-5p释放CPT1
HuR部分逆转AGAP2-AS1诱导的效应,假设AGAP2-AS1可能存在其他调节途径,如作为竞争性内源性RNA。在线预测软件鉴定AGAP2-AS1靶向的miRNA,qPCR验证4个miRNA在AGAP2-AS1过表达BC细胞中下调,发现CPT1被预测为评分较高的miR-15a-5p的靶点。双荧光素酶报告基因检测显示,miR-15a-5p可显著抑制AGAP2-AS1和CPT1的荧光素酶活性,pull down试验证实了AGAP2-AS2与miR-15a-5p、miR-15a-5p和CPT1之间的直接相互作用。miR-15a-5p模拟物显著抑制干性,增加曲妥珠单抗介导的细胞毒性,逆转AGAP2-AS1引起的CPT1水平升高。共表达miR15a-5p可消除AGAP2-AS1诱导的干性蛋白和曲妥珠单抗耐药性。以上结果证明AGAP2-AS1/miR-15a-5p/CPT1调节轴在干性和曲妥珠单抗耐药中的重要作用。

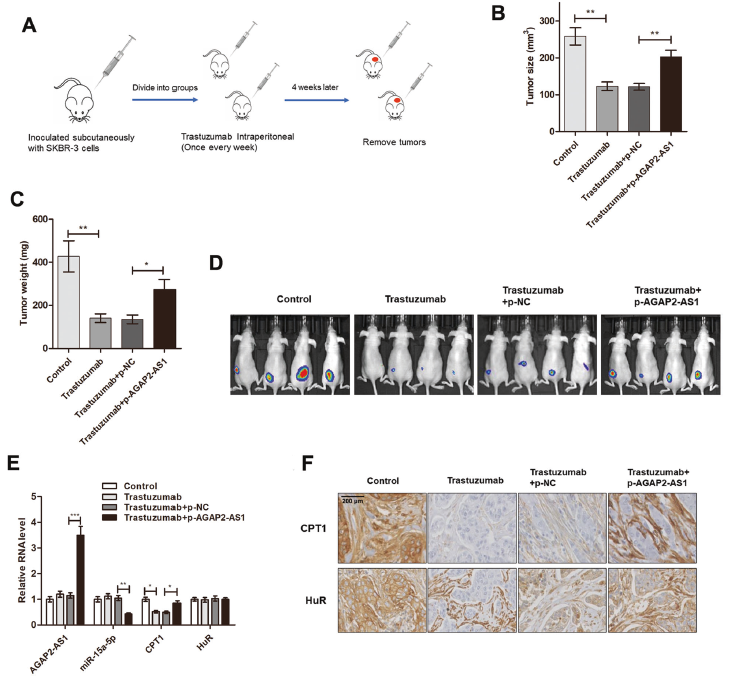
7. AGAP2-AS1促进体内干性和曲妥珠单抗耐药性
为证实AGAP2-AS1在干性和曲妥珠单抗耐药性中的重要作用,在BALB/c裸鼠中建立了异种移植瘤模型。将转染pcDNA-AGAP2-AS1的SKBR-3细胞与骨髓间充质干细胞混合后接种于小鼠皮下,小鼠接受曲妥珠单抗治疗。发现曲妥珠单抗治疗显著抑制了肿瘤生长,然而,当细胞与AGAP2-AS1过表达时,这种效应被急剧逆转,过表达AGAP2-AS1的SKBR-3细胞生成的肿瘤表现出较高的AGAP2AS1和较低的miR-15a-5p表达。曲妥珠单抗在异种移植物中减少的CPT1的表达可通过AGAP2-AS1过表达来挽救。IHC分析显示,在过表达AGAP2-AS1的异种移植物中,CPT1染色较高,而AGAP2-AS1未改变HuR染色。表明AGAP2-AS通过靶向体内CPT1介导干性和曲妥珠单抗耐药性。
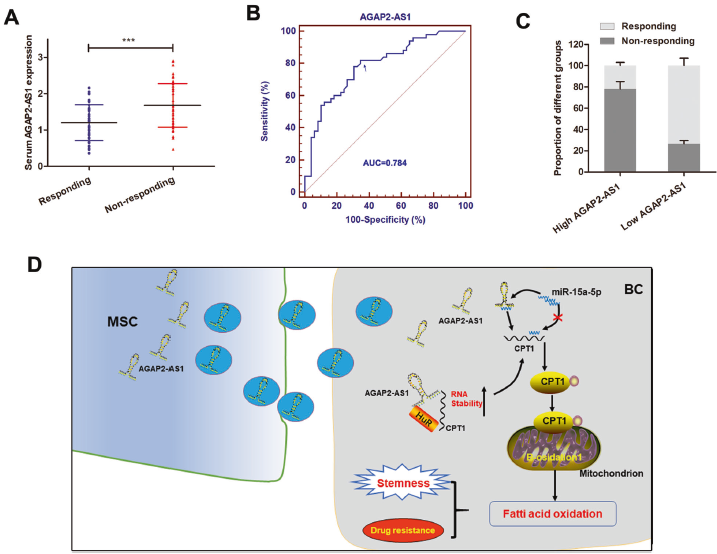
8. AGAP2-AS1预测BC患者对曲妥珠单抗的治疗反应
分析接受曲妥珠单抗治疗的患者血清样本,发现无应答患者中AGAP2-AS1上调。受试者工作特征(ROC)曲线显示AGAP2-AS1在区分有反应和无反应患者方面具有相对较高的预测价值,ROC曲线将患者分为AGAP2-AS1高表达或低表达组,AGAP2-AS1高表达组对曲妥珠单抗治疗表现出反应的患者百分比远低于AGAP2AS1低表达组。