NLRP3上调PD-L1参与淋巴瘤的免疫抑制
研究背景:肿瘤微环境(TME)中的慢性炎症使恶性细胞逃避宿主免疫监测,从而促进了肿瘤的发生。炎性小体在恶性细胞与TME的相互作用中发挥重要作用。NLRP3炎性小体在多种恶性肿瘤中起促瘤作用。然而,它在淋巴发育中的潜在作用尚不清楚。Fei Lu等人在Cancer Lett(IF= 7.36)这一杂志中发表文章研究NLRP3咋淋巴瘤中的预后作用及作用机制。
技术路线图:

研究结果:
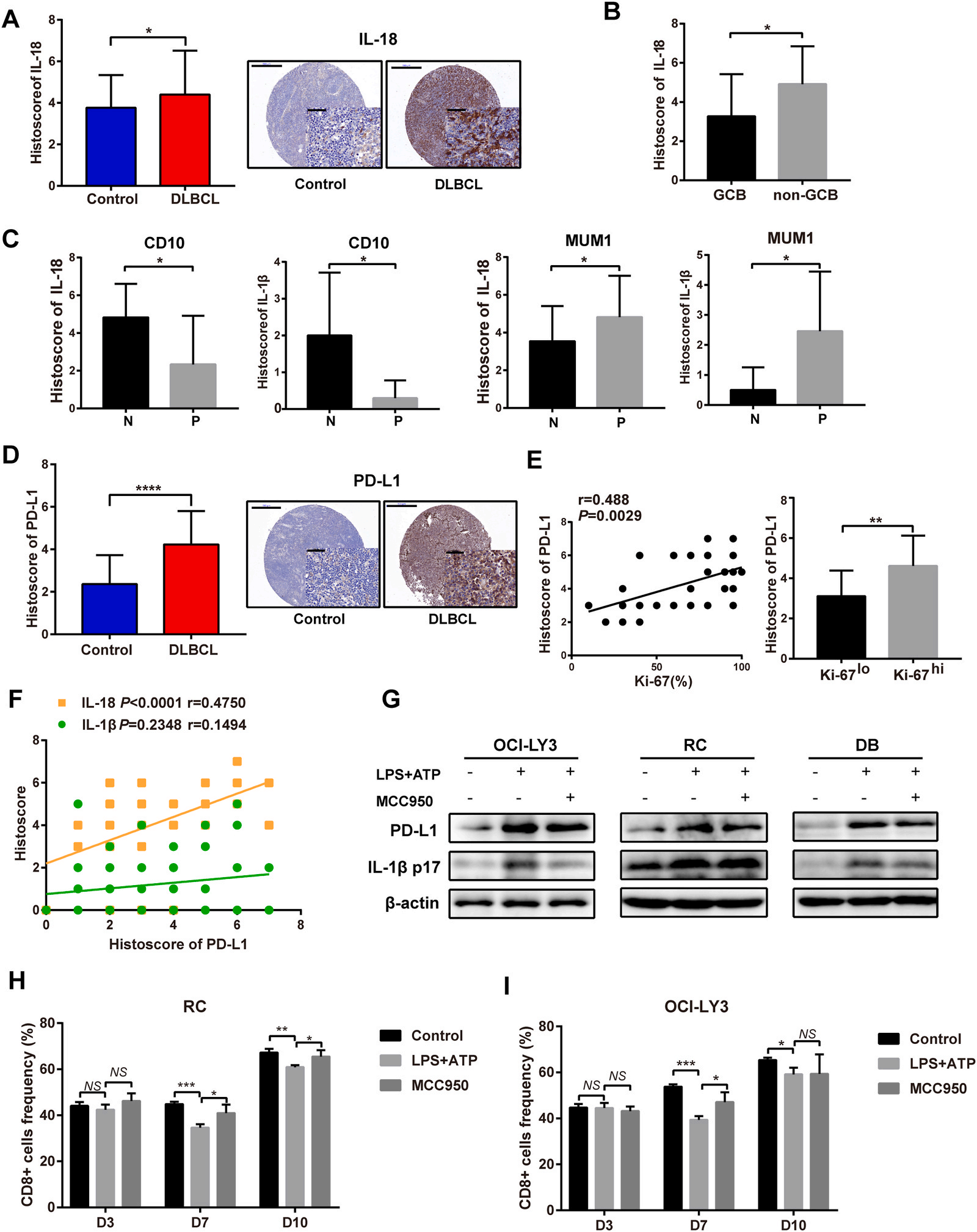
1.淋巴瘤患者IL-18的水平升高,并且与肿瘤微环境中PD-L1的水平相关
应用微阵列分析了淋巴瘤肿瘤(DLBCL)和正常淋巴组织中效应细胞因子的水平,来评估NLRP3炎症小体在淋巴瘤微环境中的作用。在DLBCL中,IL-18水平升高(图1A)。具有非生发中心B细胞的患者中IL-18的水平更高(图1B)。如图1C,在CD10+和MUM1-患者中,IL-18和IL-1β的表达较低。而且,DLBCL组织中,PD-L1的表达更高(图1D),暗示患者不良预后。TME中PD-L1的表达与IL-18水平呈正相关(图1F),这可能归因于NLRP3炎症小体的激活。图1G, OCI-LY3, RC和DB(淋巴瘤细胞系)中NLRP3炎症小体激活。NLRP3 抑制剂MCC950降低IL-1β和抑制PD-L1的表达。人DLBCL细胞系中NLRP3炎症小体激活,与PD-L1的表达相关,我们假设在恶性细胞和细胞毒性T细胞之间的相互作用中,NLRP3炎症小体的激活影响免疫反应。炎症小体NLRP3的激活减少CD8+T细胞的比例,而抑制剂降低这种作用(图1H)。表明NLRP3的激活在体外上调了B细胞淋巴瘤细胞的PD-L1水平,降低了细胞毒性T细胞,特别是在与免疫细胞长期相互作用后。
Fig.1
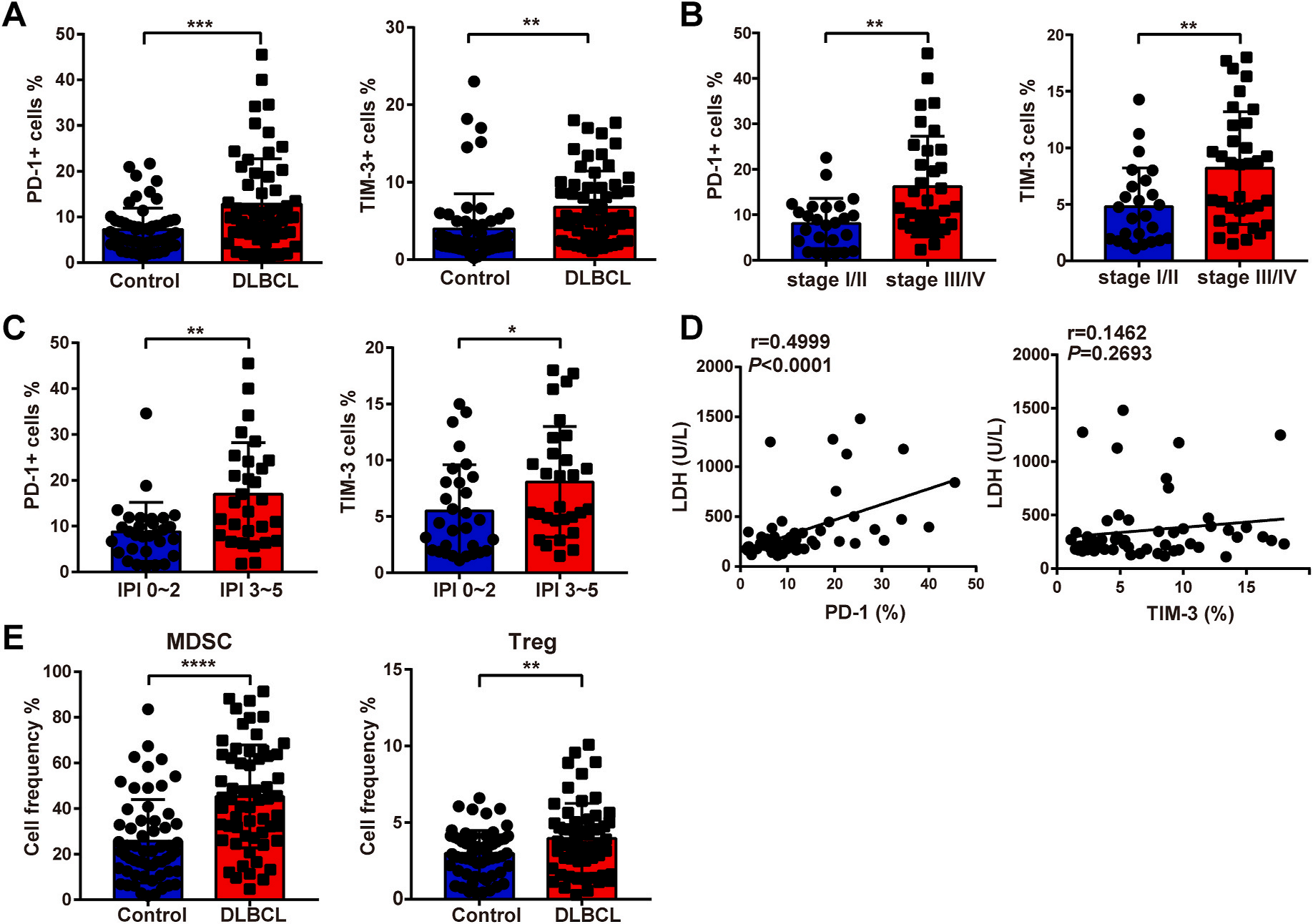
2.DLBCL病人中免疫抑制细胞增加
图2A所示,在DLBCL中,PD-1+,TIM-3+ T细胞水平显著升高。DLBCL病人患病严重时,T细胞中PD-1和TIM-3的水平较高(图2B)。高PD-1+细胞与血清中LDH的水平相关。然而,高表达PD-1+, TIM-3+ T细胞与DLBCL患者不良预后有关。DLBCL患者中循环MDSC和Tregs细胞增加。结果说明,DLBCL患者中的免疫抑制状态,表现为肿瘤中PD-L1高表达,PD-1+/TIM-3+ T细胞,MDSC和Tregs细胞增加。
Fig.2
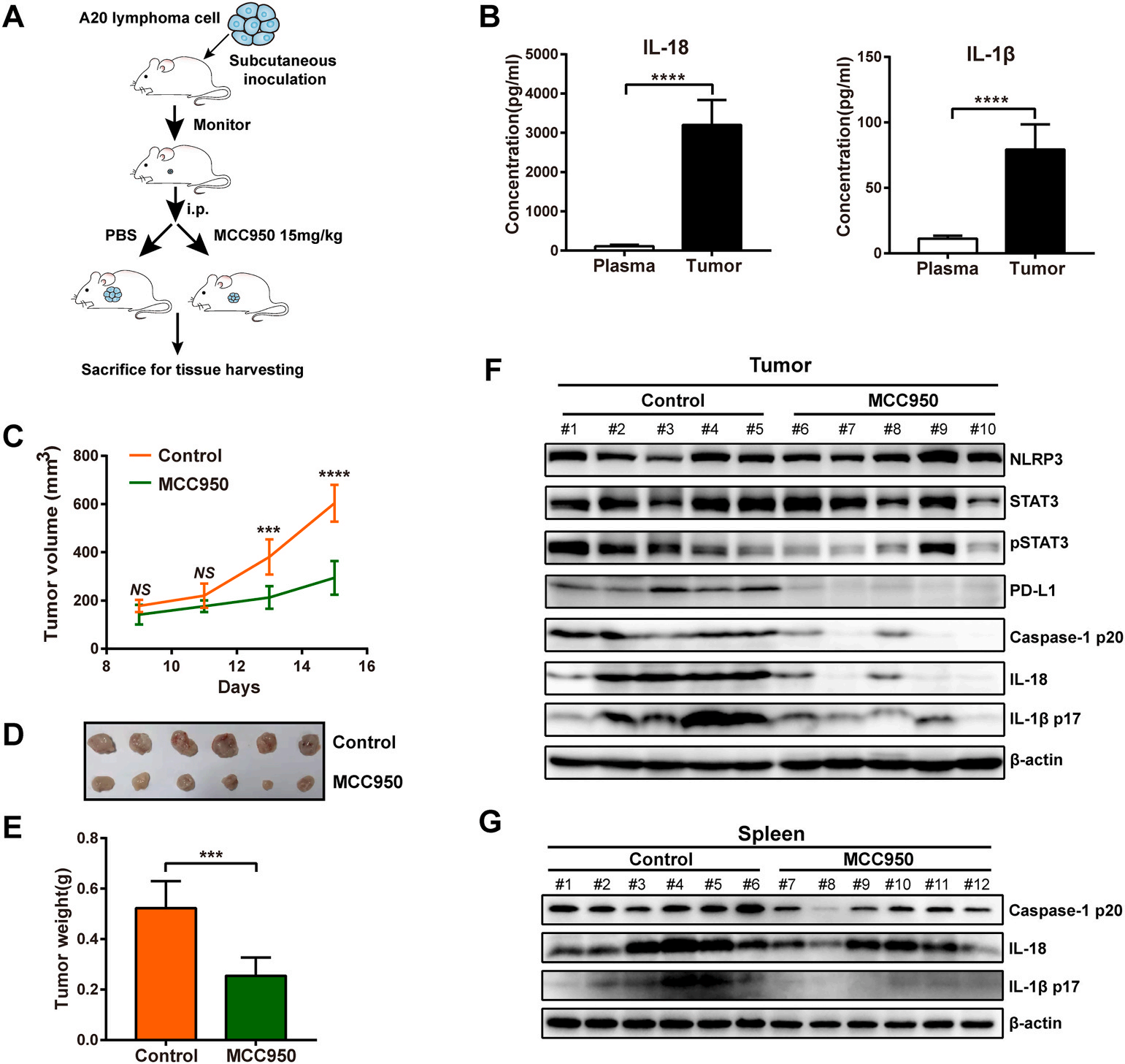
3. NLRP3炎性小体阻断抑制淋巴瘤生长并减少PD-L1表达
在皮下注射同基因A20淋巴瘤细胞的小鼠中观察NLRP3炎性小体在B细胞淋巴瘤进展中的作用,肿瘤组织匀浆中,IL-18和IL-1β的水平升高(图3B)。MCC950显著减少了淋巴瘤的生长和抑制肿瘤发展(图3C-E)。MCC950降低了肿瘤组织和脾脏中活性caspase-1,活性IL-1β和IL-18的水平(图3F-G)。另外,MCC950抑制肿瘤中PD-L1的表达(图3F)。MCC950还降低了肿瘤中磷酸化的STAT3 (pSTAT3)水平,这表明阻断NLRP3炎症小体抑制STAT3激活,可能与PD-L1下调有关(图3F)。
Fig.3
4.NLRP3炎症小体阻断减少免疫抑制细胞的群体
PD-L1和 PD-1的相互作用是肿瘤免疫逃逸的关键。文章分析了荷瘤小鼠中不同免疫细胞群的比例,MCC950处理显著增加了肿瘤浸润性CD8+ T细胞和脾T细胞的比例(图4A),以及TNF引起的CD3+和CD4+ T细胞的比例(图4B)。MCC950处理导致小鼠脾脏IFN诱导的CD3+和CD4+ T细胞显著减少(图4B);这可能是导致PD-L1下调的部分原因。此外,MCC950显著降低了脾脏和淋巴结中CD3+和CD4+ T细胞中PD-1的表达(图4C)。此外,MCC950治疗也减少了脾T细胞和CD4 + T淋巴细胞中TIM-3 (图未展示),MDSCs,TAM表达(图4 D和E),和Tregs在肿瘤组织和脾脏中的表达(图4F)。这些发现表明NLRP3炎症小体激活和免疫抑制之间有很强的相关性,并证明NLRP3炎症小体的阻断可以延缓淋巴瘤的进展。
Fig.4

5.体内阻断IL-18减少免疫抑制细胞的比例
进一步研究NLRP介导免疫抑制的机制。使用IL-1β和IL-18的中和抗体,肿瘤负担减轻(图5A)。IL-18的中和抗体处理的小鼠肿瘤浸润CD8+ T细胞和淋巴及循环CD8+ T细胞的百分比明显升高(图5B)。IL-1β的中和抗体仅提高了淋巴结中CD8+ T细胞的比例 (图5B)。
而且,在淋巴瘤小鼠中抑制IL-18导致淋巴结中PD-1+ CD3+ 和PD-1+ CD8+细胞的水平降低,以及外周血,脾脏,和肿瘤中PD-1 + CD4 +细胞比例减少。而IL- 1β抑制并不影响T细胞中PD-1表达(图5C)。抗IL -18抗体也下调了肿瘤浸润T细胞中TIM-3的表达,而抗IL-1β抗体增强了肿瘤T细胞中TIM-3的表达(图5D)。此外,抗IL -18和抗IL-1β抗体处理的淋巴瘤小鼠外周血中MDSCs和TAMs显著降低(图5E)。此外,IL-18中和作用降低了肿瘤和脾脏中treg的比例(图5F)。与mcc950处理小鼠的数据一致,接受IL-1β蛋白和IL -18处理的荷瘤小鼠肿瘤组织中PD-L1水平下调,pSTAT3水平降低(图5G)。综上所述,NLRP3炎性小体阻断可通过降低效应细胞因子IL-18介导的免疫抑制而至少部分地改善淋巴瘤进展。
Fig.5

6. NLRP3炎性小体阻断联合抗PD-L1治疗具有拮抗作用
使用MCC950或抗PD-L1抗体治疗的小鼠肿瘤负荷显著降低;然而,联合治疗降低了单独使用对肿瘤的抑制效果(图6B)。抗PD-L1治疗恢复了荷瘤小鼠的T细胞活性,表现为肿瘤浸润T细胞,特别是CD8+ T细胞数量的增加 (图6C)。虽然PD-L1阻断后脾脏T细胞的比例没有变化(图6C),但脾脏中IFN-诱导的CD8+ T细胞和TNF诱导的T细胞比例显著增加(图6D)。联合治疗组肿瘤浸润CD8+ T细胞比例明显低于抗PD-L1单药治疗组(图6C)。联合治疗组脾脏CD3+、CD4+和CD8+ T细胞产生的IFN和TNF的水平也降低(图6D)。因此,NLRP3炎性小体的抑制可能破坏PD-L1阻断所导致的T细胞功能增强。PD-L1阻断后脾脏和淋巴T细胞上的PD-1水平显著升高(图6E)。此外,联合治疗组脾脏和淋巴T细胞上的PD-1和TIM-3表达均明显高于MCC950单药治疗组(图6E)。此外, PD-L1阻断和联合治疗均显著增加了肿瘤浸润性MDSCs(图6F)和TAMs(图6G),但不影响肿瘤浸润性treg的比例(图6H)。因此PD-L1阻断部分抑制了MCC950在TME中的免疫刺激功能。
Fig.6







