CCL7是非小细胞肺癌免疫疗法的潜在生物标志物和佐剂
肺癌是最普遍的癌症,也是与癌症相关的死亡的主要原因,每年在全球造成200万以上的新诊断和170万死亡。大约85%的肺癌诊断为非小细胞肺癌(NSCLC),其中50%以上的腺癌和30%的鳞状癌。由于非典型症状,约三分之二的NSCLC患者在诊断时出现晚期疾病。已鉴定出NSCLC肿瘤中的许多体细胞突变,致癌性重排或拷贝数变异,包括EGFR基因19号外显子的缺失,L858R或T790M突变,MET基因14号外显子的跳跃突变,ALK或ROS1重排,MET,EGFR或HER2的拷贝数增加。各种小分子抑制剂和单克隆抗体已经被开发靶向这些基因改变和显著改善NSCLC患者的预后。尽管取得了这些进展,但目前尚无针对KRAS突变的NSCLC患者的具体治疗策略,KRAS突变是10-20%的NSCLC患者中最常见的致癌驱动因素。此外,已在KRAS突变的NSCLC中鉴定出常见的共突变伴侣,包括TP53,LKB1和CDKN2A。这些共突变因子提供了不同的基因表达谱,并可能确定针对KRAS突变的NSCLC的不同治疗策略。近期,武汉大学钟波教授,林丹丹教授及华中科技大学褚倩教授发现CCL7通过募集常规DC1(cDC1)促进KrasLSL-G12D/+Tp53fl/fl(KP)和KrasLSL-G12D/+Lkb1fl/fl(KL)NSCLC小鼠模型的抗PD-1治疗,促进T细胞扩增,相关研究以“CCL7 recruits cDC1 to promote antitumor immunity and facilitate checkpoint immunotherapy to non-small cell lung cancer”为题发表在Nature communications上,杂志影响因子12.121。
技术路线:
结果:
1、 CCL7在NSCLC肿瘤组织中高表达
作者从楔形切除或肺叶切除的18名NSCLC患者中收集了肿瘤和正常肺组织,并通过实时荧光定量PCR(qRT-PCR)分析了CCL7的表达,发现肿瘤组织中CCL7的mRNA水平明显高于正常组织(图a)。随后,作者从NSCLC患者中收集了另一组共44对的肿瘤和正常肺组织,发现CCL7在肿瘤组织中高表达(图b),且免疫组织化学和集成光密度分析的结果证实肿瘤组织中CCL7的蛋白水平高于正常肺组织(图c)。此外,高CCL7蛋白水平与NSCLC患者的总生存(OS)有显著正相关(图d)。以上数据表明,CCL7在NSCLC肿瘤组织中上调,并与NSCLC患者的OS正相关。接下来,作者在获得的KP(KrasLSL-G12D/+小鼠和Tp53fl/fl小鼠杂交)/KP7小鼠(Ccl7-/-小鼠与KP小鼠杂交)中鼻内注射Ad-Cre病毒,十周后进行流式细胞仪分析发现CCL7IRES−ZsGreen在CD11c+CD11b−H-2Kb−CD103−肺泡巨噬细胞(AM)中表达,但在CD11c+CD11b−H-2Kb+CD103+树突细胞(DCs)、CD11b+CD11c−细胞、CD19+ B细胞、CD4+或CD8+ T细胞中不表达(图e-g),且CCL7IRES−ZsGreen在CD45.2−CD31+CD81−CD49d−内皮细胞、CD45.2−CD31−CD81+CD49d−成纤维细胞以及CD45.2−CD31−CD81−CD49d−肿瘤细胞中被发现,而在CD45.2−CD31+CD49d+基质细胞中没有表达。这些数据说明肿瘤诱导后KP小鼠肺部多种细胞中的CCL7被上调。

2、 CCL7缺失促进KP小鼠模型的肿瘤发生
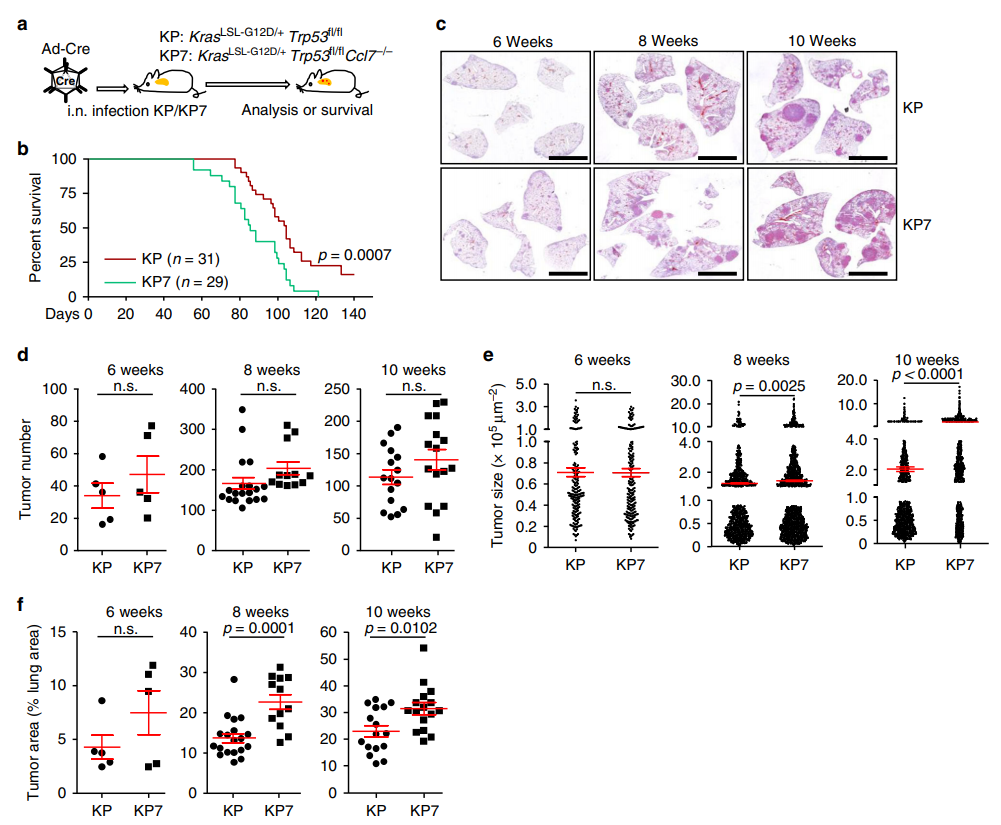
作者通过鼻内注射Ad-Cre病毒诱导KP/KP7小鼠肺肿瘤发生,KP7小鼠的中位OS为82天,而KP小鼠的中位OS则明显更长(105天)(图a,b)。组织学分析表明诱导肿瘤后6-10周,KP小鼠或KP7小鼠肺部的肿瘤数量相当(图c,d)。此外,诱导后第6周的KP小鼠和KP7小鼠的肿瘤大小和面积相当,而诱导后第8或10周的KP7小鼠肺部的肿瘤大小和面积明显更大(图 2e,f),表明CCL7缺失在早期不影响NSCLC肿瘤的发生,但是在晚期抑制肿瘤的进展。这些数据说明在KP小鼠模型中CCL7在NSCLC发育中的抑制作用。
3、 CCL7缺失会削弱cDC1向荷瘤肺的浸润
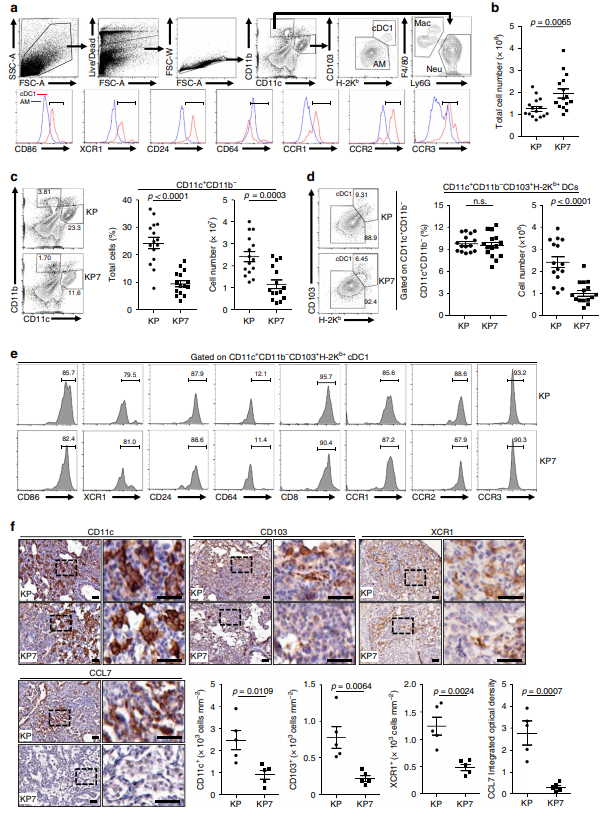
作者制备了来自诱导后10周的KP小鼠和KP7小鼠的肿瘤负担的肺的单细胞悬液,并用各种单核细胞标记物染色,然后进行流式细胞术分析,发现KP7小鼠肺的总细胞数多于KP小鼠,可能是由于KP7小鼠的肿瘤大小大于KP小鼠(图a,b),且KP7小鼠肺中CD11c+CD11b-细胞的百分比和细胞数量比KP小鼠显著减少(c)。作者进一步发现,与KP小鼠相比,KP7小鼠荷瘤肺中表达高水平的CD86、XCR1和CD24以及低水平的CD64的CD11c+CD11b−CD103+H2Kb+ DCs数量显著减少(图d,e)。这些数据表明CCL7主要吸引KP小鼠模型中荷瘤肺中的cDC1。在此背景下,作者发现与CD11c+CD11b−CD103−H-2Kb−肺泡巨噬细胞或CD11c−CD11b+ 细胞相比,CCL7受体CCR1、CCR2和CCR3在cDC1上高表达(图d)。然而有趣的是,KP小鼠或KP7小鼠肺中CD11c+CD11b−细胞上CD103,H-2Kb的百分比相当,来自KP小鼠或KP7小鼠肺的cDC1表达相当的CD86、XCR1、CD24或CCL7受体,表明CCL7缺失不影响cDC1的活化或分化或活化cDC1上CCL7受体的表达,而在肿瘤诱导后10周,与KP小鼠相比,KP7小鼠肺肿瘤中cDC1的数量显著减少,CD11c、CD103和XCR1的强度显著降低(图d-f)。这些数据表明CCL7是cDC1最佳浸润到荷瘤肺所必需的,但不是浸润cDC1活化所必需的。
4、 CCL7缺失会削弱抗肿瘤免疫反应的激活
作者分析了支气管引流淋巴结(dLNs)中的适应性免疫反应,发现来自KP7小鼠的支气管dLNs的总细胞数明显少于来自KP小鼠的支气管dLNs(图a), 尽管在肿瘤诱导后10周,KP小鼠和KP7小鼠支气管dLN中CD8+ T细胞的百分比相当, 而与KP小鼠对比,CD8+IFNγ+ T细胞的数量显著减少,表明在KP小鼠模型中肿瘤诱导后CCL7缺失损害支气管dLN中CD8+ T细胞扩增(图b)。接着,作者通过Percoll介导的梯度离心从KP小鼠和KP7小鼠的荷瘤肺中分离出肺浸润淋巴细胞(LIL),利用各种淋巴细胞标记物进行染色,流式分析发现与诱导肿瘤后10周的KP小鼠肺相比,KP7小鼠肺中LILs的总细胞数明显减少(图c)。与KP小鼠相比,KP7小鼠LILs中CD8+ 或CD8+IFNγ+ T细胞数量显著降低(图d,e)。总的来说,这些数据表明CCL7缺失损害了KP小鼠模型支气管dLN和荷瘤肺中T细胞的扩增和聚集。

5、 CD11c+ DC的消耗可促进KP小鼠模型中NSCLC的发育
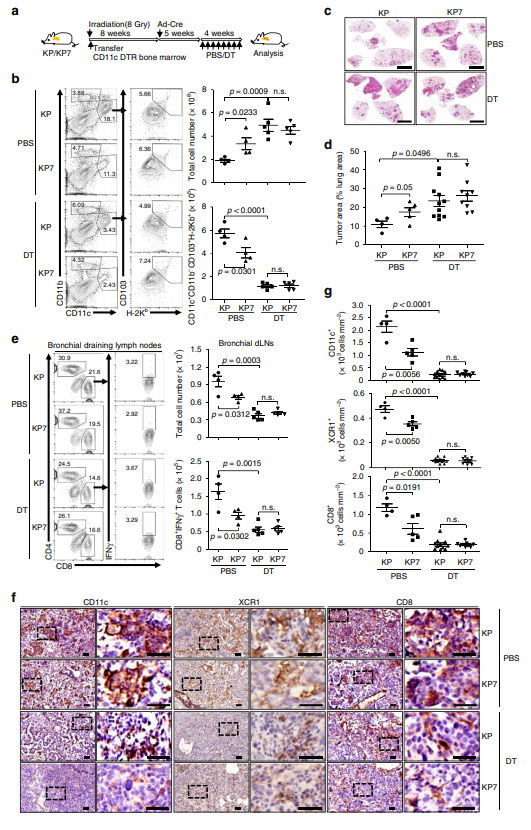
作者将CD11c-白喉毒素受体(DTR)骨髓细胞转移到经辐照的KP小鼠或KP7小鼠体内,然后进行肿瘤诱导和DT介导的CD11c+细胞耗竭(图a)。通过DT处理,有效的消除了KP小鼠或KP7小鼠肺中的CD11c+或CD11c+CD103+H-2Kb+ DC(图b)。在KP小鼠和KP7小鼠中,CD11c+ DCs的耗竭显著促进NSCLC的发展, DT处理的KP小鼠和KP7小鼠的荷瘤肺和生长相当(图c,d), 表明在KP小鼠模型中CCL7介导的CD11c+ DCs募集在抑制肿瘤发生中的重要作用。与此一致,DT处理后,KP小鼠或KP7小鼠支气管dLN和LILs中的CD8+IFNγ+ T细胞以及肿瘤中CD8、XCR1和CD11c染色的强度显著降低(图e-g)。
6、 在KP小鼠模型中,肺中给予CCL7可抑制NSCLC
作者对KP小鼠和KP7小鼠鼻内注射Ad-Cre病毒,6周后分别向这些小鼠鼻内注射Lenti-Vec或Lenti-CCL7,免疫组化分析证实了在注射Lenti-CCL7的KP小鼠或KP7小鼠的肺中CCL7的表达,与相应的对照组相比,注射CCL7可以显着延长KP小鼠或KP7小鼠的生存期并抑制其肿瘤发展(图a-e)。同时发现,与注射对照病毒的小鼠相比,注射了CCL7的KP小鼠或KP7小鼠的肿瘤肺中浸润性cDC1的数量以及CD11c,XCR1和CD8染色的强度显着增加(图f,g)。这些数据表明CCL7在KP小鼠模型中充当NSCLC的治疗剂。

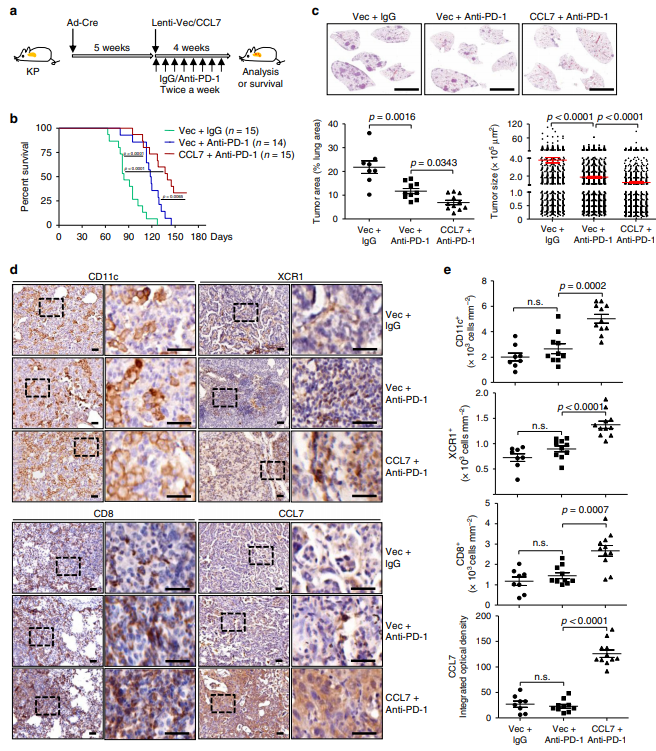
7、 CCL7增强抗PD-1检查点免疫疗法的功效
作者在有或没有腹膜内注射抗PD-1的情况下,每周两次向KP小鼠鼻内注射Ad-Cre,然后进行Lenti-Vec或Lenti-CCL7注射,持续4周,发现抗PD-1治疗显着延长了KP小鼠的存活,与注射空载体相比,通过注射CCL7进一步延长了存活,且抗PD-1治疗显着抑制了KP小鼠的肿瘤发展,与空载体相比,联合注射CCL7进一步抑制了其发展(图a-c)。此外,与单独使用抗PD-1治疗相比,CCL7和抗PD-1的联合治疗显着增加了KP小鼠肺中CD11c+或XCR1+ DC和CD8+ T细胞的浸润(图d-e)。
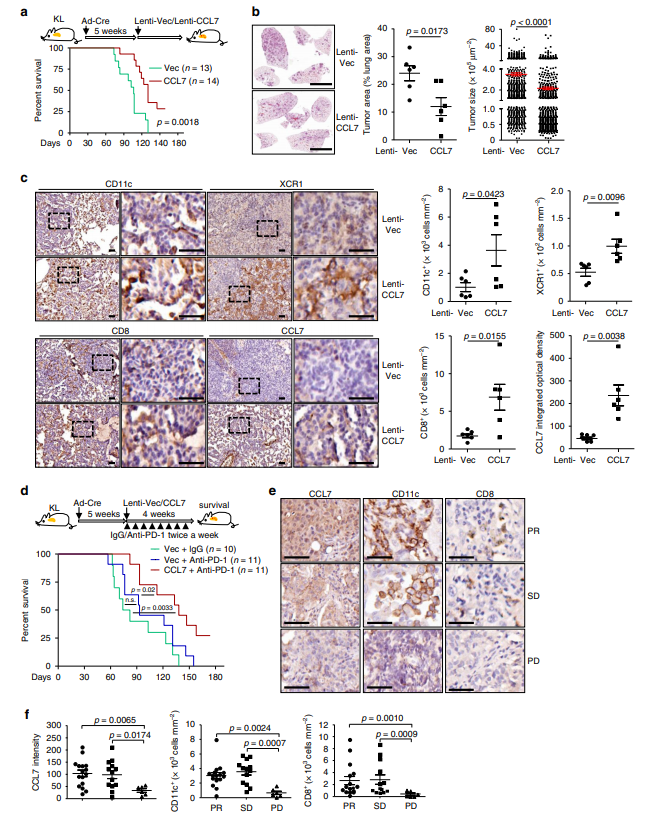
接着,作者检查了CCL7是否可以在KL小鼠模型中促进抗肿瘤免疫,通过KL小鼠经鼻内注射Ad-Cre,5周后感染Lenti-Vec或Lenti-CCL7,然后进行分析或存活观察,发现CCL7显着延长了KL小鼠的存活,并抑制了KL小鼠中的NSCLC发育,且增加了KL小鼠肿瘤中CD11c,XCR1和CD8的染色(图a-c)。同时发现抗PD-1治疗没有明显改善KL小鼠的存活,而与单独使用抗PD-1治疗相比,CCL7和抗PD-1的组合显着延长了KL小鼠的存活(图d)。作者回顾了接受帕博利珠单抗或信迪利单抗治疗的晚期NSCLC患者CT引导下穿刺活检中CCL7的水平和抗PD-1免疫治疗的疗效,结果表明,部分缓解或疾病稳定患者活检组织中CCL7和CD11c+和CD8+细胞的染色显著高于疾病进展患者(图f,e),表明CCL7可作为NSCLC检查点免疫治疗的预后或诊断标志物。
结论:
1. CCL7在NSCLC肿瘤组织中表现出高表达,并且与肿瘤微环境(TME)中cDC1的浸润和NSCLC患者的整体生存呈正相关。
2. CCL7缺失损害了cDC1在TME中的浸润以及随后CD8 +和CD4 + T细胞在支气管引流淋巴结和TME中的扩增,从而促进了KP小鼠模型中的肿瘤发展。
3. CCL7单独或与抗PD-1联合肺内给药可显著抑制KP小鼠和KL小鼠的肿瘤发展并延长其生存期。
参考文献:
Man Zhang, Wei Yang, Peng Wang, et al. CCL7 recruits cDC1 to promote antitumor immunity and facilitate checkpoint immunotherapy to non-small cell lung cancer. Nature communication. 2020.






