单细胞RNA和染色质可及性研究揭示紊乱血流诱导的内皮细胞的重编程

动脉粥样硬化是心肌梗死、缺血性中风和外周动脉疾病(PAD)的主要潜在原因,是世界范围内的主要死亡原因。动脉粥样硬化是一种慢性炎症性疾病,优先发生在暴露于紊乱血流(d-flow)的动脉区域,而暴露于稳定血流(s-flow)的动脉区域则受到保护。血流被内皮细胞(ECs)中的机械传感器识别,进而激活信号通路,导致基因表达、内皮功能和动脉粥样硬化通路的调控。D-flow诱导ec中重要的原动脉粥样硬化通路,包括内皮炎症和功能障碍、渗透性功能障碍、血栓形成和内皮-间充质转化(EndMT)。相反,s-flow保护ec免受这些原动脉粥样硬化途径的影响。
了解流量调节内皮基因的表达在转录和体内外遗传性染色质易访问性水平,我们和其他人使用批量rna或dna从池获得ECs暴露s-flow或维使用鼠标部分颈动脉结扎(PCL)模型或猪动脉。我们建立了PCL模型,并显示在2周内,d-flow快速诱导,而s-flow阻止,高胆固醇小鼠动脉粥样硬化的发展。PCL模型包括结扎左侧颈总动脉(LCA)的4个远端分支中的3个以诱导d-血流,同时使用继续暴露于s-血流的对侧右侧颈总动脉(RCA)作为内部控制。我们进一步开发了一种管腔冲洗方法,使我们能够从PCL后的lca和rca中获得内皮富集的rna和dna。然后用mRNA微阵列、microRNA微阵列和RNA测序(RNA-seq)分析这些聚合的整体RNA,以识别mRNA转录组和受ECs流量调节的microRNAs。这些研究导致了大量的流动敏感基因和microrna的发现,这些基因和microrna在内皮生物学和动脉粥样硬化中的作用已经被详细描述和研究。我们还能够从lca和rca中获得大量DNA样本,并通过减少代表性亚硫酸氢盐测序(RRBS)方法进行分析。本研究表明,d-flow和s-flow差异调控ECs的表观基因组DNA甲基化谱,鉴定了许多受流量调控的基因位点。
虽然这些使用大量RNA和DNA样本的转录组和表观基因组甲基组研究清楚地确定了d-流和s-流对体内ECs的差异影响,但这些研究的解释有一些局限性。虽然我们的大块RNA和DNA制剂中富含来自腔内冲洗的ec,但不可避免的是它们包含了一些存在于内膜中的其他细胞类型,尤其是PCL手术后的lca。例如,我们观察到早在PCL后12小时,LCA样本中与免疫细胞和间充质细胞相关的许多基因的表达增加;然而,我们不能确定这些改变是由于非内皮细胞浸润内膜所致,还是由于内皮细胞的d-流所致。
2020年12月,埃默里大学在Cell Rep(IF=8.087) 杂志上发表了文章“Endothelial Reprogramming by Disturbed Flow Revealed by Single-Cell RNA and Chromatin Accessibility Study”。此报道在PCL后,使用从小鼠颈动脉腔内获得的富含内皮细胞的单细胞和细胞核进行了scRNA-seq和scATAC-seq检测,以确定d-flow和s-flow对基因转录本和染色质可及性谱的基因组和表观基因组调控的差异影响。对scRNA-seq和scATAC-seq数据的单独分析以及对两个数据集的综合分析显示,即使在s-flow下,颈动脉内的ECs也是异质性的。D-flow显著改变了内皮转录组和表观基因组谱,将它们重新编程为炎症细胞、间充质细胞、干细胞/祖细胞样细胞、造血细胞和免疫细胞样表型。此外,我们还发现了一种依赖于d-flow和s-flow的TF结合位点和顺式调节元件的富集。
技术路线:

为了确定s-flow和d-flow在体内单细胞分辨率下对ECs基因转录表达和染色质可及性谱的全基因组影响,我们使用小鼠PCL模型进行了scRNA-seq和scATAC-seq。将C57BL/6小鼠部分结扎,以暴露于血流的对侧RCA作为对照,在LCA中诱导d-血流。部分结扎后2天(2D)和2周(2W), rca (2D- r和2W- r)和lca (2D- l和2W- l)用胶原酶酶解获得单个细胞和单个核,分别用于scRNA-seq和scATAC-seq。
使用小鼠PCL模型进行scRNA-Seq和scATAC-Seq分析
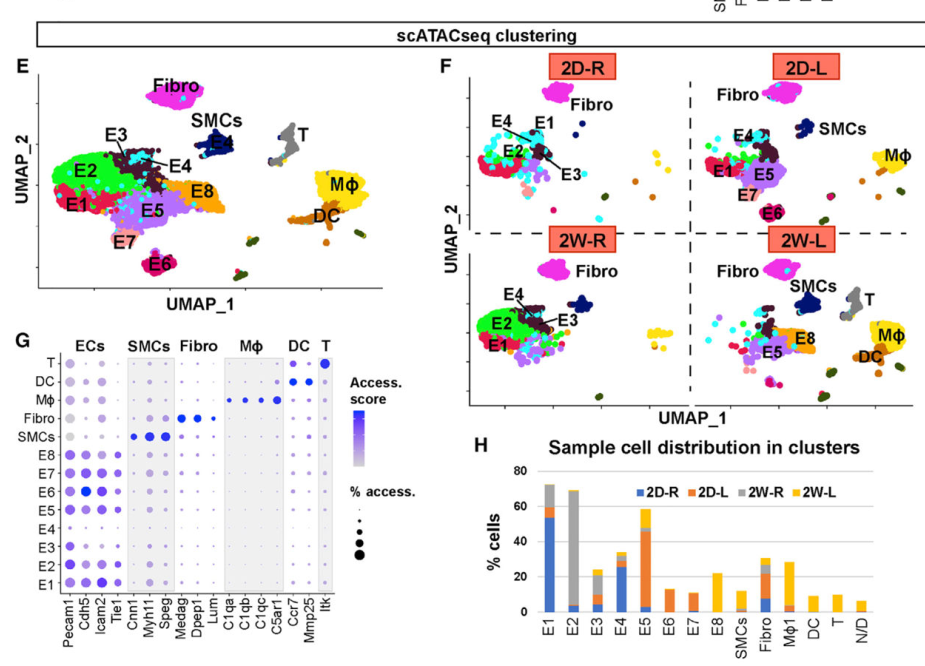
在标准化之后,一个基于无监督图的聚类将细胞划分成组,通过统一流形近似和投影(UMAP)图可视化(图1A)。
我们的UMAP分析确定了16个独特的细胞簇以流和时间依赖的方式分布(图1A和1B)。每个细胞簇都是用确定的标记基因进行鉴定(1C).发现8个EC簇(E1 E8)、血管平滑肌细胞(SMCs)、成纤维细胞(Fibro)、4个单核/巨噬细胞(macrophages 1 4)、树突状细胞(DCs)和T细胞。通过Pecam1、Icam2、Cdh5和Tie1的表达来鉴定EC簇。smc特异性标记为Cnn1、Myl9和Speg。同样,Medag、Dpep1和Lum作为纤维的标记物;巨噬细胞C1qa, C1qb, C1qc, C5ar1;DCs的Ccr7和Mmp25;T细胞的Itk(图1C)。
在整个细胞群中,2D-R和2W-R样本之间没有明显的差异,这表明暴露在s-flow条件下2天或2周的细胞基本没有变化。S-flow条件下(2D-R和2W-R)很少发现SMC,而急性d-flow条件下(2D-L) SMC数量增加至2.3%,慢性d-flow条件下(2W-L) SMC数量进一步增加至18.2%。四种情况下都有成纤维细胞,其中在急性d-flow情况下最多(2D-L时为17%)(图1D)
对2D-R、2D-L、2W-R、2W-L 4个样本的序列reads使用R软件包进行分析。UMAP分析将总核群划分为13个细胞群,它们以流量和时间依赖的方式分布(图1E和1F)。
通过Signac将scATAC-seq数据转换为基因活性指数,并使用上述scRNA-seq研究中描述的相同标记基因确定细胞身份。在13个簇中,8个是内皮簇(E1 E8),其次是SMCs、Fibro、巨噬细胞、dc、T细胞和未定义(ND)(图1G)。
一、scRNA-Seq和scATAC-Seq的整合
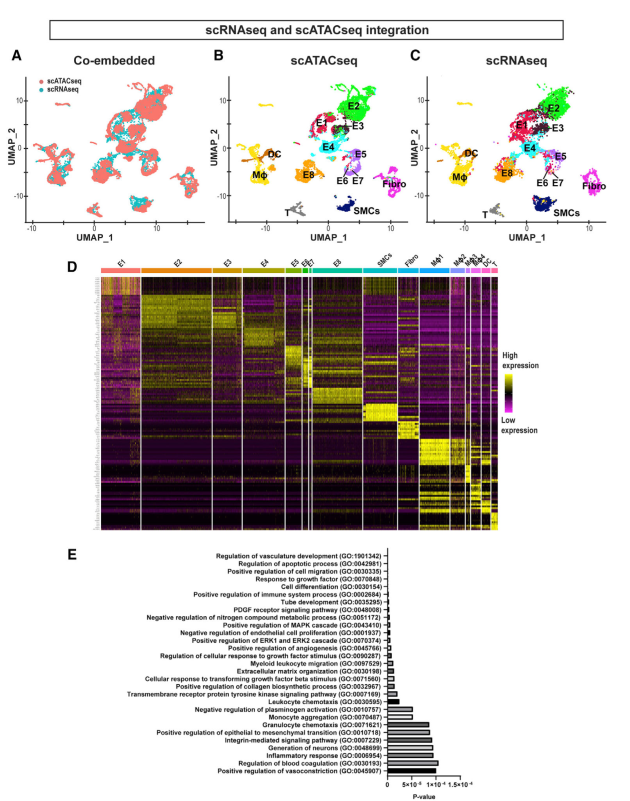
共嵌入的UMAP图显示,scRNA-seq和scATAC-seq数据集中分析的大部分细胞相互重叠,这表明在大多数细胞簇中,染色质可及性和相应的基因转录表达的变化是一致的(图2A)。
整合结果显示,两个数据集中所有巨噬细胞簇几乎完全重叠,表明我们的研究中确定的所有巨噬细胞簇没有明确区分。scATAC-seq和scRNA-seq数据的单个UMAP图显示了各自的小区集群标识(图2B和2C)。然后使用每个细胞簇中前10个上调的基因生成热图(图2D)。如图2E所示,暴露于慢性d-流中的ec表现出许多与致动脉粥样硬化途径相关的已知生物学过程的诱导。
二、伪时间轨迹,染色质可及性和基因表达分析揭示Flow-Dependent内皮细胞重新编程
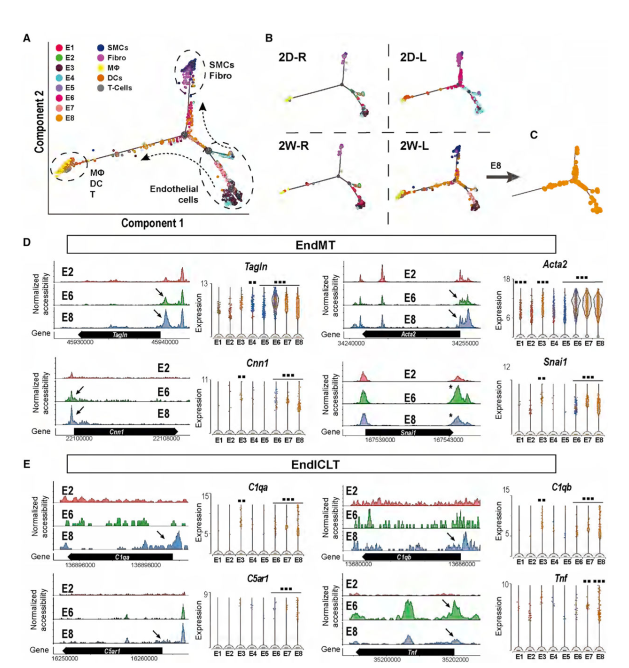
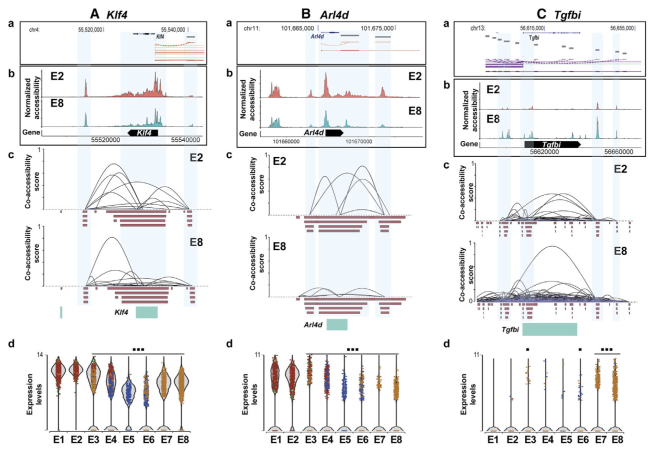
我们的分析明确了3种主要的分化细胞类型:(1)ec,(2)免疫细胞(巨噬细胞,树突状细胞和T细胞),以及(3)SMCs和纤维细胞(图3A)。此外,在每一细胞类型走向的轨迹路径上,还有许多其他细胞出现,表明它们响应d-flow的过渡性去分化状态。为了更好地理解轨迹结果,我们将分析分为四种实验条件(图3B)。在s-flow条件下(2D-R和2W-R),大部分细胞分化良好,少数细胞处于过渡状态。相反,d-flow条件诱导许多ec进入过渡状态,潜在地向smc和纤维转化分化,表明EndMT。令人惊讶的是,我们还发现许多ec在急性d-flow条件下(2D-L)向免疫细胞转移,在慢性d-flow条件下(2W-L)进一步增加。进一步使用E8聚类分析显示,这些暴露于慢性d-flow的ec向免疫细胞样类型(EndICLT)转变,但没有达到完全分化的免疫细胞状态(图3C和S3)。图3D显示了EC簇中EndMT、Tagln、Acta2、Cnn1和Snai1的四个标记物,分别代表了s流(E2)、急性d流(E6)和慢性d流(E8)染色质可及性的变化。与s-流(E2)和急性d-流(E6)相比,慢性d-流在E8的启动子区域(箭头)增加了这些基因的可及性。从scRNA-seq数据的小提琴图中可以看出,E8中相应基因的表达量增加,进一步证实了这一结果(图3E)。
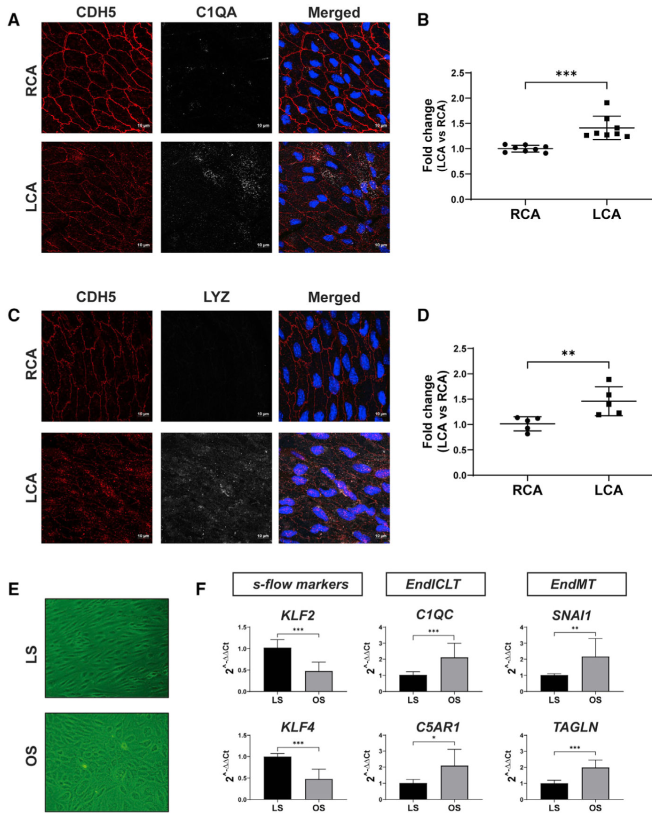
如图4所示,与LS相比,慢性OS降低了KLF2和KLF4的表达,同时诱导了EndMT标记物(SNAI1和TAGLN)。重要的是,慢性OS诱导了两个巨噬细胞标记基因(C1QC和C5AR1)的表达,直接证明了OS可以在体外诱导EndICLT。此外,我们利用小鼠PCL模型进行了一项en - face共免疫染色研究,以确定体内CDH5+ ECs中是否表达巨噬细胞标记蛋白。如图4A-4D所示,C1QA和LYZ在LCA ECs中明显被诱导,而在rca中没有,这为血流诱导的eniclt提供了更有力的证据。我们分析了由基因本体结果确定的d-flow条件激活的致动脉粥样硬化通路(图2E)。

如图5所示,E8中的d-flow改变了白细胞流量和炎症标志物(Il1β、Il6、Ccl2和Ccl3);ECM调节(Adamts4, Lamb1, Timp3,和Timp4);血管调节(Nos3, Ptgs2,和Edn1);和脂质代谢(Tm6sf2、Lsr和Mgll),并与E2的s-flow进行比较(图5A-5D)。这些结果表明,d-flow激活了致动脉粥样硬化的内皮反应,同时通过改变转录和染色质可及性水平上的基因表达来抑制抗动脉粥样硬化通路。
三、体内血流依赖TF结合基序的鉴定
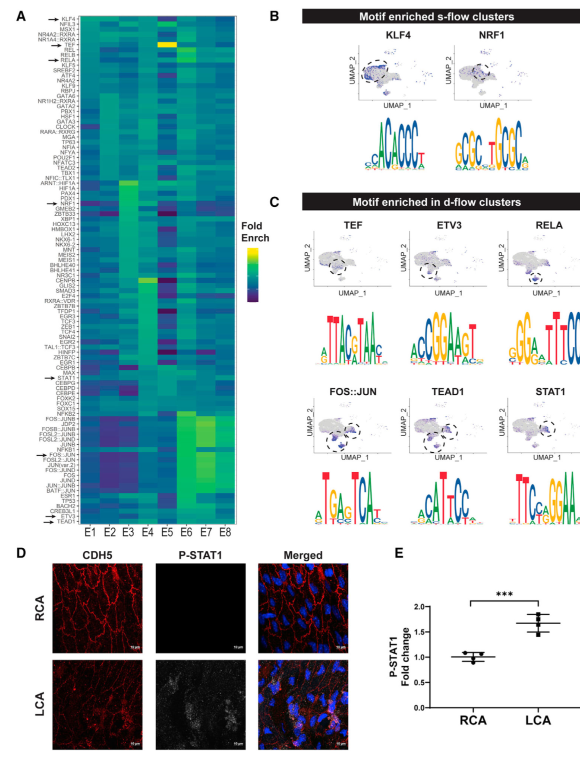
使用Signac和ChromVar软件包通过我们的scATAC-seq数据集来识别流敏感的TF结合基序(图6)。在每个内皮聚类(E1- E8)中识别出前20个TF结合基序,并绘制成热图(图6A)。图6B和6C显示了TF结合基序和它们被发现的各自的细胞簇。在s-flow条件下,KLF4的TF结合基元在E2中富集,而NRF1在E3和E4中富集(所有流条件下)(图6B)。相比之下,暴露于d-flow条件下的E5 E8中,TEF、ETV3、RELA、FOS::JUN、TEAD1和STAT1的TF基序富集(图6C)。对一些众所周知的流量敏感tf的基模的鉴定,KLF4(与KLF2基模相同),FOS:JUN (AP1), RELA和TEAD1证实了我们分析的有效性。为了进一步确定新发现的TF结合基序是否也与流量依赖反应相关,我们检测了phospho -STAT1水平是否对流量敏感,作为STAT1激活的标记。pcl术后2周,与RCA相比,CDH5+ LCA的ECs中phosphoSTAT1水平显著升高(图6D和6E)。






