外伤性损伤损害核浆运输,导致TDP-43病理

创伤性脑损伤(TBI)是世界范围内最常见的死亡和残疾原因之一。事实上,创伤性脑损伤导致的继发性损伤可导致长期的神经和神经精神后遗症,包括神经退行性疾病,如肌萎缩性脊髓侧索硬化症(ALS)、阿尔茨海默病(AD)和帕金森病。TBI还与慢性创伤性脑病(CTE)的发展有关,CTE是一种与反复头部创伤相关的进行性神经退行性综合征。反复创伤患者(如CTE)的死后脑组织以及创伤性脑损伤动物模型显示微管相关蛋白(TAU)和TAR DNA/RNA结合蛋白(TDP-43)病理变化。TDP-43病理是神经退行性变的标志,在~ 97%的ALS病例、~ 45%的额颞叶痴呆(FTD)病例和~ 60%的AD病例中均有TDP-43表现。尽管有证据表明TDP-43病理作为神经退行性变的生物标志物,但仍不清楚重复创伤如何促进TDP-43蛋白病。
TDP-43是一种主要的核DNA/RNA结合蛋白,穿梭于细胞核和细胞质之间。TDP-43调控RNA处理,如基因转录、mRNA剪接、mRNA稳定性、mRNA运输和定位,病理突变破坏RNA代谢。在许多神经退行性疾病中,TDP-43偏离细胞核并聚集在细胞质中。细胞质TDP-43聚集体被认为是神经退行性变的重要机制,因为这些聚集体被异常磷酸化和泛素化。有多种机制被提出来解释神经退行性疾病中TDP-43异常的细胞质积累和TDP-43病理的进行性扩散。
TDP-43包含一个类似朊病毒的低复杂度域,并具有一个本质上的无序区域(IDR),使TDP-43易于聚集。RNA结合蛋白(rbp)中的IDRs被认为在核糖体蛋白颗粒(如p -小体、应激颗粒和神经元颗粒)的组装中起关键作用,提示rbp的突变或异常聚集可能会破坏这些颗粒的动力学。此外,rbp中的IDRs如TDP-43经历了液-液相分离,TDP-43的病理突变改变了液-液相分离,这可能有助于疾病进程。因此,rbp如TDP-43的改变可能是神经退行性变的重要指标。然而,尽管这些机制可能解释了TDP-43病理突变在神经退行性疾病中的作用,但TDP-43如何在无突变的情况下聚集形成并导致神经退行性疾病,如反复创伤患者的大脑,目前尚不清楚。
最近有报道称,ALS/FTD中TDP-43的聚集可以隔离核孔蛋白、转运蛋白和其他因子,表明TDP-43的聚集强烈破坏核质转运(NCT)和核孔复合体。此外,在AD、ALS和亨廷顿氏病(HD)中NCT也被破坏,提示在这些神经退行性疾病中有一个共同的功能失调途径。然而,TDP-43在反复颅脑损伤致神经退行性变中的病理机制尚不清楚。此报道之前曾证明,重复的创伤导致果蝇大脑中的泛素、p62和TDP-43包涵体以及应激颗粒病理。在这里,我们对果蝇的大脑进行了蛋白质组学分析,以确定创伤损伤后改变的分子通路。
2021年5月,在Elife 杂志上发表了文章“Traumatic injury compromises nucleocytoplasmic transport and leads to TDP-43 pathology.”。此报道在体内,反复的创伤会上调核孔蛋白,改变核孔蛋白的稳定性,改变NCT蛋白,改变RanGAP1和核孔蛋白的分布,改变NCT。此外,核输出的药理抑制可以防止tbi介导的致命性和NCT缺陷。有趣的是,在体内和体外,核孔蛋白的上调导致TDP-43定位错误、聚集、磷酸化和溶解性改变,并降低运动功能和寿命。对NUP62病理和CTE患者脑组织中NUP62浓度升高的研究结果表明NCT缺陷与创伤损伤有关,这可能介导了TDP-43的病理变化。
技术路线
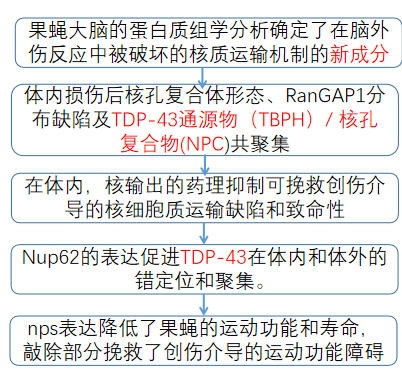
一、脑损伤改变了果蝇的大脑蛋白质组,扰乱了NCT蛋白和Nup蛋白水平
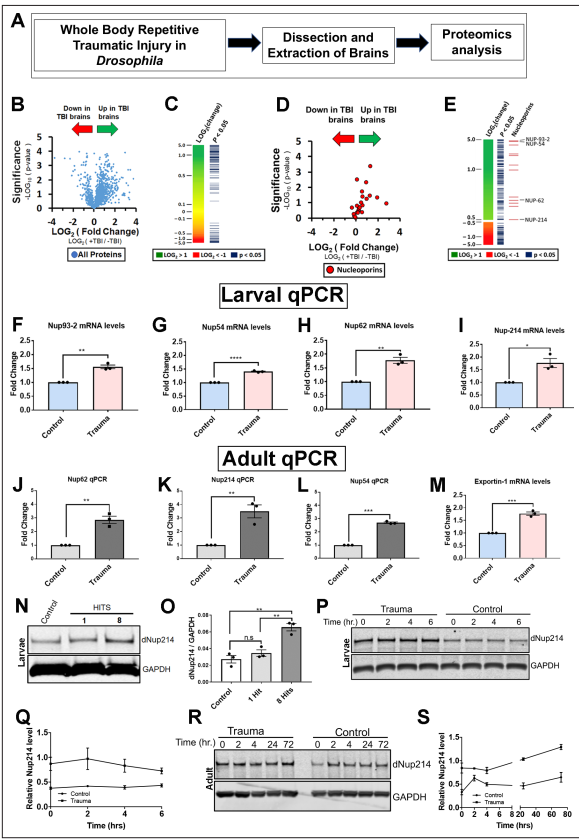
为了研究创伤性脑损伤的机制,我们使用了一个具有良好特征的创伤性脑损伤果蝇模型,该模型显示了强大的表型,如TDP-43同源物(Tbph)、p62、应激颗粒和泛素病理,以识别和研究创伤性脑损伤后大脑蛋白质组的变化(图1A)。对暴露于重复TBI的三龄果蝇幼虫大脑中的2000个蛋白质进行了无偏性蛋白质组学分析(w1118),发现361个蛋白质在创伤损伤后发生了显著变化(p 0.05,学生t检验)。基于基因本体论(GO)的复杂网络分析在BiNGO (Cytoscape 3)中对tbi相关脑蛋白质组与非tbi对照进行了关联分析,确定了不同类别的改变蛋白,其中大多数上调(图1B和C;图1图补充1A-E;补充文件1和3)。TBI后上调的最高类别是微管细胞骨架、蛋白质折叠和蛋白酶体。此外,我们还鉴定了涉及核蛋白复合体和剪接体的蛋白质。核孔复合体(NPC)和NCT通路的组成部分是tbi后上调的主要蛋白子集(图1图补充1F)。鼻咽癌通路此前尚未被认为与创伤介导的神经退行性变有关,但据报道,在ALS/FTD、AD、HD和其他神经退行性疾病中,鼻咽癌通路被破坏。因此,我们决定进一步研究鼻咽癌改变介导TDP-43在TBI中的病理变化。蛋白质组学分析显示,一些Nups在脑损伤时被上调(图1D和E)。对这些Nups的定量逆转录酶聚合酶链反应(qRT-PCR)分析证实,TBI显著上调Nup93-2、Nup54、Nup62、Nup44A,和Nup214 mRNA水平的果蝇幼虫(图1F I和图1图Supplement 1G)和成年大脑(图1J L)。此外,核输出基因Emb (Exportin)的mRNA水平在tbi后显著增加(图1M),而与对照组相比,微管相关蛋白Futsch的mRNA水平没有变化(图1图Supplement 1H),这与蛋白质组学分析一致。Western blotting进一步证实了tbi依赖性的果蝇幼虫脑内Nup214蛋白水平的升高(图1N和O)。Western blot分析了损伤后幼虫(0、2、4和6小时)和成虫(0、2、4、24和72小时)的时间过程,以评估Nup214蛋白的水平。在检测的时间点上,不管是幼虫还是成人的大脑中,Nup214蛋白的水平都是上调的(图1P,Q,R,S),这表明创伤可能会破坏Nup214的水平和体内的转换。
二、TBI破坏了NPC和RanGAP1的分布,导致TBPH/NPC共聚集

使用鼻咽癌标记Mab414,它可以识别包括Nup62在内的几个Nups的FG结构域,我们发现在非tbi控制的果蝇大脑中,核膜上有一个主要的同质的环状标记。非脑外伤对照组的腹神经索(VNC)鼻咽癌染色呈均匀分布。相比之下,暴露于TBI的vnc核膜NPC染色不规则,显示核形态紊乱。我们在脑外伤后观察到核膜间隙和聚集(Mab414团块)的出现(图2A)。TBI脑中Mab414染色异常的细胞百分比明显高于非TBI对照(图2B)。tbi暴露的vnc中Tbph和Mab414的核周和细胞质共聚集,而对照大脑显示很少或没有共聚集(图2C)。定量结果显示,与对照组相比,tbi暴露的vnc中具有共聚集的Mab414 tbph阳性细胞百分比显著升高(图2D)。RanGAP1对Ran-GTP的水解对于核出口过程中货物进入细胞质至关重要。RanGAP1维持核/细胞质Ran梯度,其丢失会导致细胞死亡。在非tbi对照组大脑中,RanGAP1在核膜内分布均匀,少数细胞表现出强烈的核信号。但tbi暴露后,RanGAP1染色分布异常,细胞核和细胞质强度高(图2E)。与对照组相比,脑外伤后RanGAP1分布异常的细胞百分比明显增高(图2F)。反复的创伤损伤会干扰RanGAP1在大脑中的定位。TBI大鼠损伤皮质(同侧半球)下海马区域的脑细胞表现出错误定位和/或聚集(箭头)或强烈的RanGAP1核染色(箭头),而假手术对照组主要是光滑的核周染色(图2H)。与假对照相比,创伤性脑损伤大鼠的NUP62显示了明显的胞质(箭头)和核(箭头)错位,假对照显示了很少的胞质(而没有核)错位(图2J)。创伤性脑损伤脑组织中NUP62病理细胞的百分比明显高于假手术对照组(图2K).
三、在体内,tbi介导的NCT缺陷和致死率被核输出抑制剂抑制
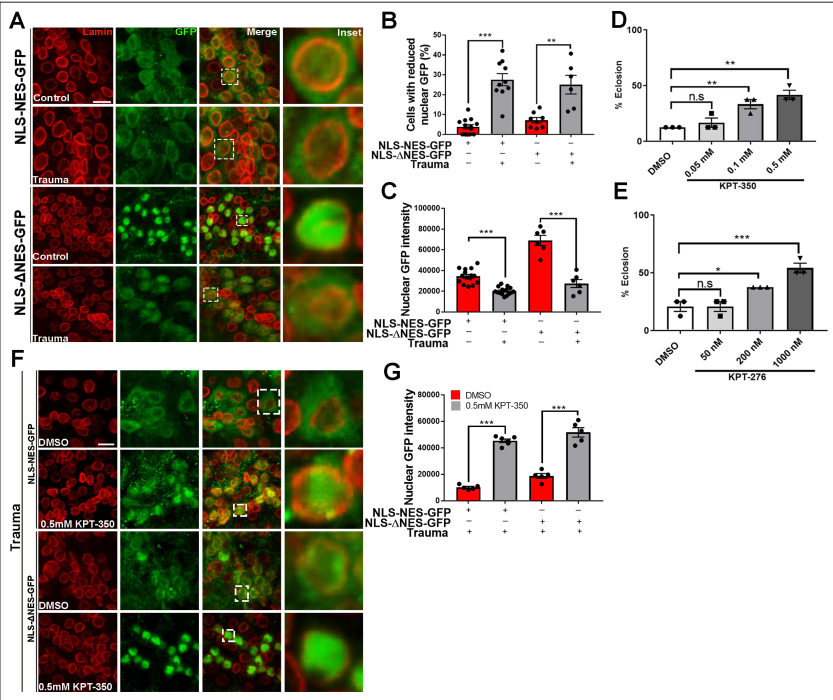
为了确定TBI是否会损害体内的核质运输,我们在果蝇运动神经元中过表达了一个带有核定位序列(NLS)和核输出序列(NES)标记的GFP蛋白(OK371-gal4)。在表达nlsnes -GFP的大脑中,GFP信号分布在细胞核和细胞质中(图3A)。然而,定量分析显示,在nls - nes -GFP表达的vnc暴露于TBI中,核GFP信号减少的细胞百分比显著增加,而核GFP强度显著降低(图3B和C),说明GFP核进口受到抑制和/或GFP核出口增加。接下来,我们在运动神经元中表达了一种用NLS和突变的NES (ΔNES)标记的没有核输出活性的GFP蛋白。表达NLS的非创伤性脑损伤动物的脑细胞-ΔNES-GFP显示了GFP在细胞核的强大定位(图3A),而创伤性脑损伤动物的vnc显示了核GFP减少的细胞数量显著增加,核GFP强度降低((图3B和C)。果蝇幼虫暴露于TBI,并在DMSO单独、KPT-350(0.05、0.1或0.5 mM)或KPT-276(50、200或1000 nM)上饲养。对经历过TBI的果蝇幼虫的羽化试验显示,KPT-350处理的动物(图3D)或KPT-276处理的动物(图3E)具有显著的剂量依赖性的致死抑制。kpt -350处理的果蝇核GFP信号显著高于dmso处理的对照组(图3G)。
四、在体内和体外,NUPs的上调导致TDP-43/TBPH定位错误和聚集
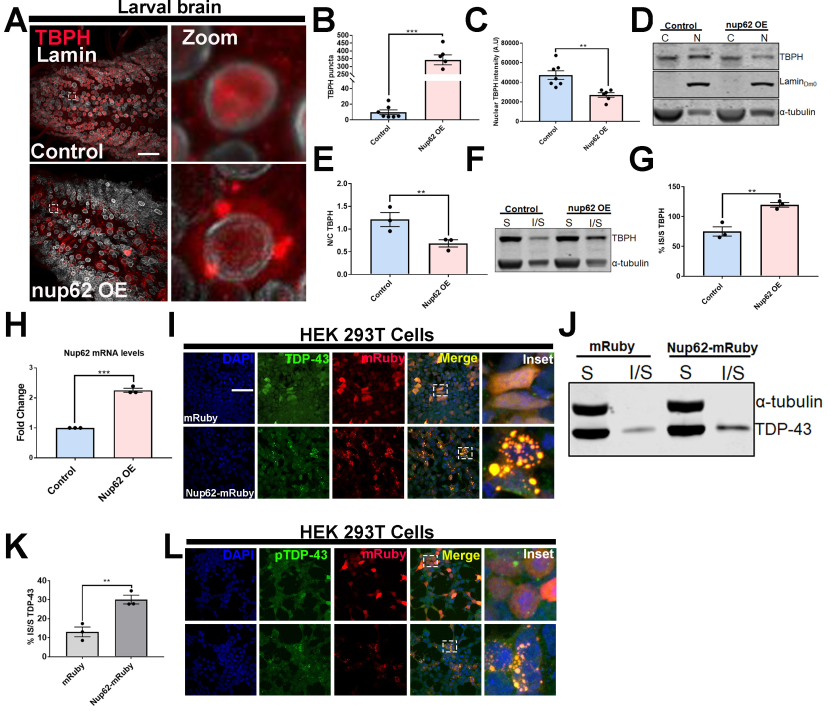
为了检测Nup上调对Tbph (Drosophila TDP-43)病理的影响,我们建立了一个位点特异性Nup62过表达(Nup62 OE)蝇线,并对内源性Tbph进行染色。在eGFP对照(以下称为对照)表达的果蝇幼虫VNC中,Tbph的分布以细胞核为主,而Nup62 OE幼虫VNC显著改变了Tbph的定位,出现细胞质聚集(图4A)。定量分析显示,与对照组相比,Nup62 OE果蝇幼虫或成年大脑中斑点Tbph显著增加(图4B)。与对照组相比,Nup62 OE vnc的核Tbph强度显著降低(图4C)。此外,核细胞质(N/C)分割进一步证实,与对照组相比,Nup62 OE动物的Tbph N/C比值显著降低(图4D和E),表明Nup62的上调改变了Tbph在体内的亚细胞定位。Nup62表达引起的Tbph的错位和聚集也让我们检测了Nup62表达是否影响Tbph的溶解度。Nup62 OE或对照果蝇大脑的可溶性-不可溶性分选显示,与对照相比,Nup62在运动神经元中表达的上调显著增加了不溶性,从而改变了Tbph的可溶性(图4F和G),表明Nup62水平是Tbph溶解度的重要决定因素。qPCR证实了Nup62的过表达(图4H)。NUP62与内源性TDP-43共聚合(图4I)。与单独mRuby相比,NUP62在HEK293T细胞中的表达导致TDP-43的溶解性显著改变(图4J和K)。检测了nup62介导的TDP-43聚集物在HEK293T细胞中是否被磷酸化。内源性与NUP62-mRuby共定位的TDP-43聚集体被磷酸化(图4L)。
五、敲除核孔蛋白来挽救核孔蛋白的表达导致果蝇的运动功能障碍和寿命缩短
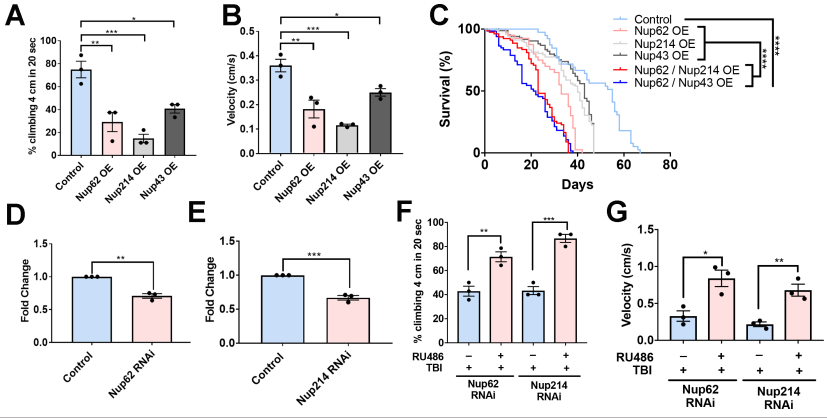
Nup62、Nup214、Nup43在运动神经元中过表达显著降低了运动功能和攀爬速度(图5A和B)。与各自的Nup对照或对照组动物相比,过表达Nup62和Nup214或Nup62和Nup43的动物的寿命明显缩短——Nup62/ Nup214 OE和Nup62/Nup43 OE的中位存活时间分别为23天和21天(图5C)。用RNAi成虫(Nup62或Nup214)多次暴露于创伤后,检测其运动功能和寿命。Nup62 mRNA (p <0.01)和Nup214 mRNA (p <0.001)与对照组相比,Nup62和Nup214 RNAi处理组的攀爬水平显著降低(图5D和E)。有趣的是,Nup62 RNAi和Nup214 RNAi处理组创伤后攀爬水平显著提高(图5E, )和速度(图5F)。
六、核孔病理存在于重复性TBI患者脑组织中,并与TDP-43病理共同聚集

轻度和重度CTE的组织,但年龄不匹配的对照组显示广泛和强烈的NUP62免疫反应性(图6A,B,C)。21例严重CTE患者脑组织的NUP62水平明显高于对照组(图6D)。轻度CTE病例中NUP62与pTDP-43的共聚集程度有限,而重度CTE病例中NUP62和pTDP-43阳性包体在额叶皮质的共聚集(箭头)更为明显(图6E)。






