YTHDF1通过控制FZD7的翻译促进胃癌发生

2021年5月,最新一篇发表在cancer research(IF=12.7000)的文章(YTHDF1 Promotes Gastric Carcinogenesis by Controlling Translation of FZD7)。此研究分析了cBioPortal (cBio cancer Genomics Portal)630例原发性胃腺癌数据集,发现YTHDF1(m6A读取蛋白)的突变主要是基因扩增,导致其过表达。YTHDF1的高表达与更具侵袭性的肿瘤进展和较差的总生存期相关。抑制YTHDF1在体内外均可抑制胃癌细胞增殖和肿瘤发生。在机制上,YTHDF1以m6依赖的方式促进了Wnt关键受体frizzled7 (FZD7)的翻译,突变的YTHDF1增强了FZD7的表达,导致Wnt/b-catenin通路的过度激活,促进了胃癌的发生。我们的研究结果表明,YTHDF1及其m6a介导的Wnt/b-catenin信号通路在胃癌中的致癌作用,为靶向此类表观遗传调控因子提供了一种新的方法
背景:超过100个不同的RNA修改特征已经在过去的几十年里,其中,该N6-methyladenosine (m6A)修改是最丰富的形式在真核mRNA。不同的m6A读者蛋白优先区分转录组范围内的RNA m6A景观。在细胞质中,大多数YTH (YTHDF1-3和YTHDC2)和IGF2BP (IGF2BP1- 3)家族蛋白与m6a修饰的mrna结合并调节其稳定性和翻译。此外,其他蛋白质可以结合m6a修饰的前体rna在细胞核内,并影响其加工。
m6a相关基因缺陷影响多种生物过程。例如,metttl3的缺失导致受损的胚胎干细胞退出自我更新走向分化;抑制METTL14导致明显的胚胎生长迟缓;斑马鱼胚胎中YTHDF2的消融延迟了早期胚胎发育中的母-合子过渡。特别是,RNA m6a相关基因正在成为在各种癌症中促进肿瘤启动和进展的关键调控因子,包括肺癌中的metttl3、肝癌中的metttl14、白血病中的FTO和乳腺癌中的ALKBH5。然而,m6A如何调节癌变以及下游通路和机制如何传递这些信号尚不完全清楚。

YTHDF1的增加通过加速Wnt受体基因FZD7的翻译促进胃癌的发生,导致Wnt通路以m6a依赖的方式激活
一、YTHDF1在胃癌中的过表达
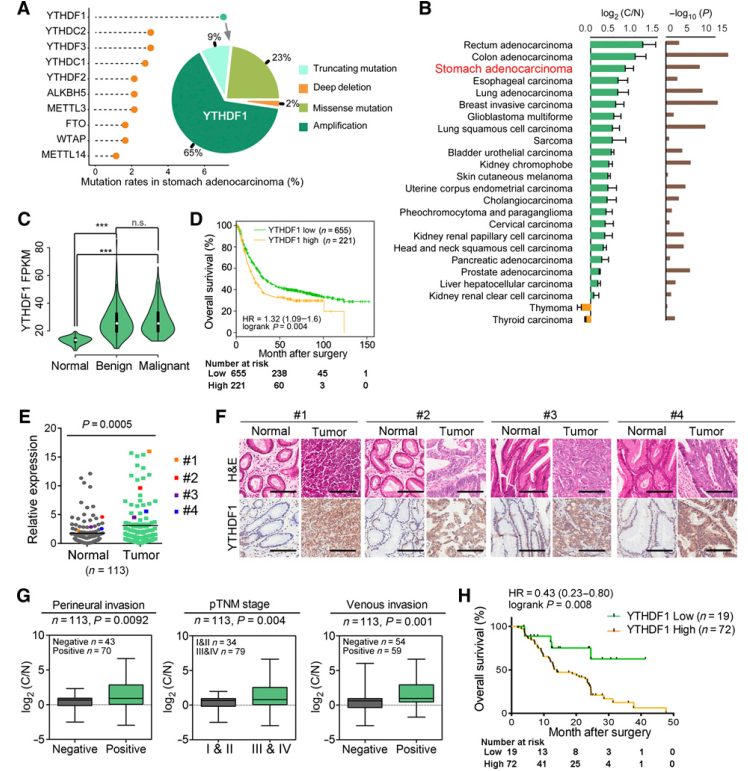
通过评估YTHDF1突变的分布,我们发现65%的突变是基因扩增,这通常会导致基因产物的过表达(图1A).通过对TCGA数据集进行分析,发现YTHDF1在胃癌患者中的表达确实明显高于正常组织(图1B)。YTHDF1的高表达与胃癌进展(图1C)和较差的总生存期(图1D)相关。对正常胃组织和胃癌标本进行免疫组化分析,证实肿瘤组织中YTHDF1蛋白表达上调(图1F)。此外,YTHDF1在胃癌患者中的异常高表达与更严重的临床病理特征(如神经周围侵犯、侵袭性肿瘤分期(III/IV期vs. I/II期)、静脉侵犯等显著相关(图1G)。Kaplan Meier生存分析也显示,YTHDF1高表达的胃癌患者4年总生存期较差。
综上所述,YTHDF1在胃癌发生中具有潜在的致瘤作用。
二、YTHDF1缺乏可抑制胃癌进展和转移
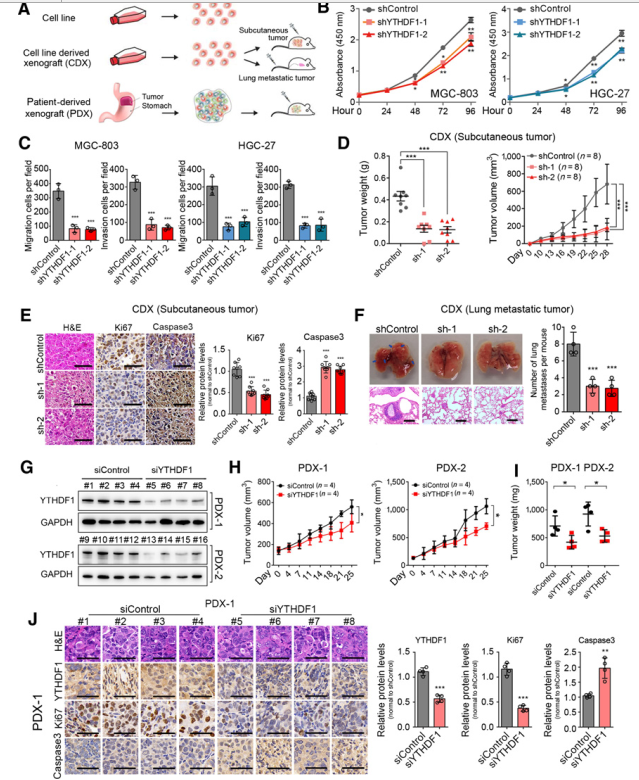
YTHDF1在不同胃癌细胞株中的蛋白表达水平,远高于正常胃腺细胞GES-1。为了进一步探讨YTHDF1在胃癌中的作用,采用了胃癌细胞系、细胞系来源的异种移植(CDX)和PDX模型(图2A)。首先,通过产生两种稳定的shRNA表达人胃癌细胞株MGC-803和HGC-27,研究了YTHDF1的抑制作用,这两种细胞株在所有被检测的胃癌细胞株中YTHDF1的表达相对较高(补充图S2B)。YTHDF1基因敲除确实降低了胃癌细胞的增殖(图2B)。此外,在MGC-803和HGC-27细胞中YTHDF1敲除降低细胞的迁移和侵袭能力(图2C)。随后通过皮下注射YTHDF1敲除的MGC-803细胞到免疫缺陷裸鼠,研究YTHDF1的抑制是否会影响体内胃癌的发生。YTHDF1水平的降低导致MGC-803移植肿瘤的肿瘤进展延迟(补充图S2D和S2E);与对照组相比,YTHDF1缺陷肿瘤的重量和体积显著减少(图2D)。因此,在YTHDF1缺陷肿瘤中,增殖标记物Ki-67下调,凋亡标记物cleaved caspase-3上调(图2E)。通过两种转移模型探讨YTHDF1是否参与了胃癌的体内转移。尾静脉注射MGC-803-sicontrol细胞导致肺转移,而注射MGC-803-siYTHDF1l细胞几乎完全消除转移淋巴结的形成。最后建立了PDX模型,发现敲除YTHDF1抑制了肿瘤的生长和重量。
上述结果表明YTHDF1在胃癌发生中起重要作用。
三、通过RNA-seq、RIP-seq和MeRIP-seq鉴定ythdf1调控的转录本
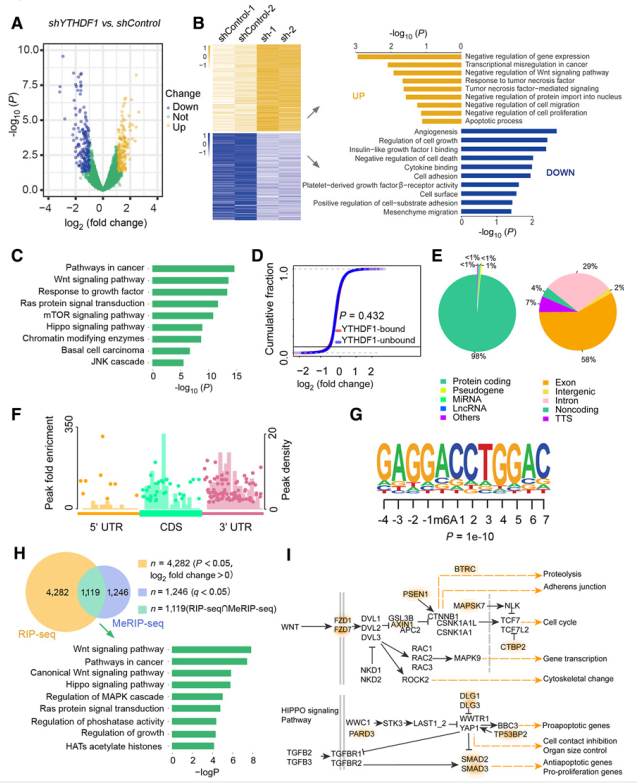
对YTHDF1基因敲除MGC-803细胞和对照细胞进行RNA-seq。RNA图谱显示YTHDF1抑制导致转录异常(图3A)。基因本体论(GO)分析表明,下调的基因在血管生成、细胞迁移、粘附和细胞生长等方面富集;而定位于负调控肿瘤进展的基因表达上调(图3B)。RIP-seq获得了9082个结合YTHDF1的候选基因。我们分析了功能富集变化最显著的前3000个基因,表明它们高度参与了癌症相关途径(图3C)。但累积分布分析表明,YTHDF1结合基因与YTHDF1未结合基因在转录水平上没有显著差异(图3D)。这与之前的研究结果一致,即YTHDF1主要调控基因翻译。MeRIP-seq鉴定YTHDF1调控的m6A修饰的转录本。2365个转录本检测到m6A修饰,主要发生在mrna中(98%;图3 e;补充表S7),优先聚集在外显子(58%;图3 e)。与其他n6 -甲基腺苷测序结果一致,m6A峰在30UTR区域富集(图3F),并仅被典型GGAC基元检测(图3G)。将RIP-seq和MeRIP-seq整合的重叠转录本进行富集分析,发现Wnt和Hippo信号通路受到了显著影响(图3H)。假设YTHDF1抑制通过Hippo或Wnt途径抑制肿瘤生长(图3I)。
四、FZD7是YTHDF1中真正的m6A修饰靶标
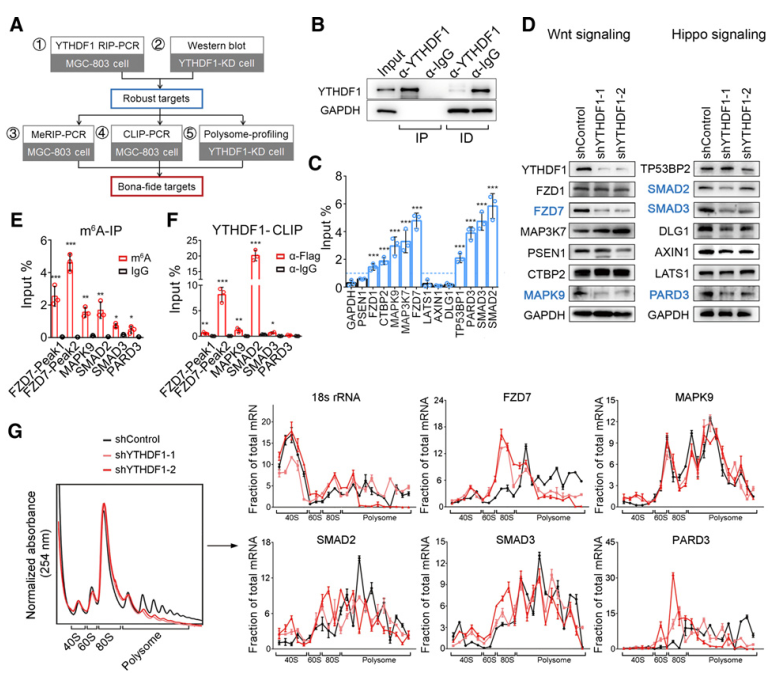
对于显著腹肌Hippo或Wnt通路的13个转录本,我们采用了多步骤筛选策略(图4A)。使用RIP结合qPCR验证确定YTHDF1相互作用的转录本(4B)。Wnt途径的FZD1、FZD7、CTBP2、MAPK9、MAP3K7等转录本,以及Hippo途径的TP53BP1、PARD3、SMAD2、SMAD3等转录本均被YTHDF1抗体特异性免疫沉淀(4C)。YTHDF1基因敲除仅显著降低了FZD7、MAPK9、SMAD2、SMAD3和PARD3的蛋白水平(图4D),但它们的mRNA未受影响。m6A免疫沉淀反应(m6A-IP)和YTHDF1 eCLIP和qPCR证实YTHDF1 对FZD7, MAPK9, SMAD2 SMAD3,和PARD3 mrna进行m6A修饰。FZD7的翻译效率下调最显著,而其他基因的翻译效率均出现轻微的抑制(图4G)。这些结果共同提示FZD7是YTHDF1在胃癌中真正的直接靶点。
五、YTHDF1以m6a依赖的方式调控FZD7的表达

在GC-803和胃癌细胞株基础上,进行m6A-qPCR和YTHDF1 RIP qPCR的基因特异性分析。确实,在FZD7 mRNA中观察到两个m6A峰,并且在MGC-803和HGC-27细胞中证实了与YTHDF1的关联(图5A和B)。标记YTHDF1突变体(YTHDF1- mut)具有两个关键氨基酸突变(K395A, Y397A)以消除其m6binding口袋(44),将其转染到MGC-803和HGC- 27细胞中(图5C)。在YTHDF1野生型(YTHDF1- wt)转染的胃癌细胞中观察到的FZD7表达上调在YTHDF1- mut中被消除,但在YTHDF1-WT和YTHDF1-MUT两种细胞系中,FZD7的mRNA水平相当(图5E)。RIP-qPCR分析显示,FZD7 mRNA与突变体YTHDF1的相互作用明显受损(图5F)。为了进一步探讨m6A修饰在FZD7 mRNA中的作用,我们构建了三种FZD7突变体,其中一种突变体为第一个m6A峰(FZD7- peak1 Mut),另一种突变体为第二个m6A峰(FZD7- Peak2 Mut),以及双突变体(FZD7- peak1 &2 Mut;图5)。与野生型相比FZD7 (FZD7-WT)突变在第二m6A峰和双m6A峰值突变(FZD7-Peak2傻瓜和FZD7-Peak1&2Mut)野生型YTHDF1没有反应过度(7和8)图5 h,面板,建议第二m6A峰FZD7 YTHDF1的主要网站的监管。同样,m6a结合能力的丧失完全消除了YTHDF1促进FZD7 mRNA翻译的作用(图5H,图9 12)。这些结果表明YTHDF1介导的FZD7的翻译控制依赖于m6A修饰。
六、THDF1通过FZD7调控Wnt/b-catenin通路
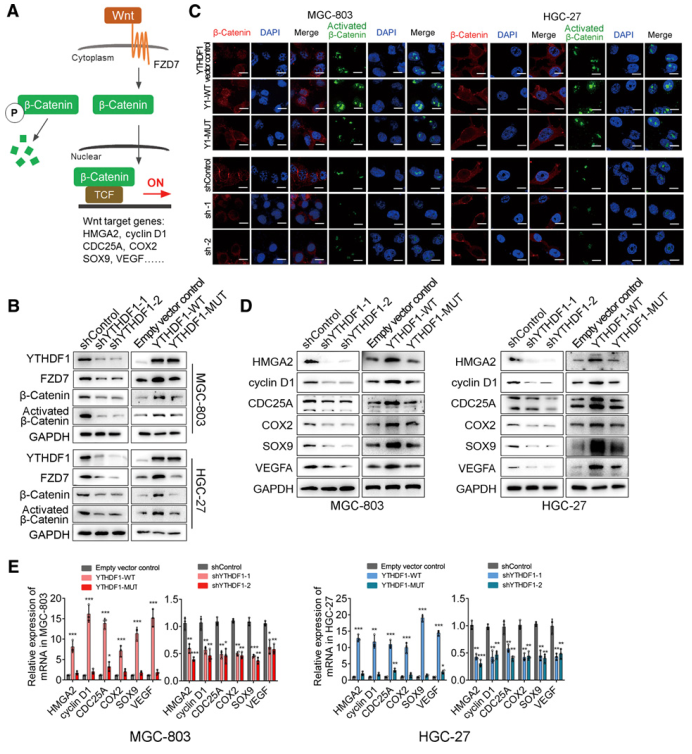
A,典型Wnt/b-catenin通路示意图。B, YTHDF1敲低或过表达MGC-803和HGC-27细胞中总(B -catenin)和非磷酸化(Ser33/37/Thr41, activated B -catenin) B -catenin的蛋白水平。C, IF染色分析YTHDF1敲低、过表达或突变过表达的MGC-803和HGC-27细胞中总(红色)和激活的(绿色)b-catenin的亚细胞定位。D,免疫印迹分析b-catenin靶基因、HMGA2、cyclin D、CDC25A、COX2、SOX9、VEGFA在YTHDF1敲低、过表达或突变过表达MGC-803和HGC-27细胞中的表达。E,定量分析YTHDF1敲低和过表达MGC- 803和HGC-27细胞中b-catenin靶基因的RNA水平(n =3)。
七、YTHDF1-FZD7-b-catenin轴促进胃癌进展

A和B, Western blot分析YTHDF1、FZD7、B -catenin和激活的B -catenin在YTHDF1敲低的MGC-803 (A)和HGC-27 (B)细胞中转染FZD7构建物或空载体对照。C和D,如上所述MGC-803 (C)和HGC-27 (D)细胞的增殖。E,如上所述MGC-803(左)和HGC-27(右)细胞的迁移分析。F,如上所述MGC-803(左)和HGC-27(右)细胞的侵袭分析。G,热图显示YTHDF1, FZD7,(总)b-catenin在人胃癌样本中的表达结果(n= 79)。H, YTHDF1、FZD7和(总)b-catenin在人胃癌样本中的表达的相关性分析(n= 79;Pearson和Spearman相关检验)。I,三对胃肿瘤及邻近正常组织中YTHDF1、FZD7、活化b-catenin的代表性IHC芯片结果。J,胃癌患者YTHDF1、FZD7、(total) b-catenin (low, n 39; high, n 40)及总生存率Kaplan Meier分析(log-rank with Mantel Cox test)。K,显示YTHDF1如何调节b-catenin信号通路促进胃癌进展的示意图。






