piRNA-30473通过调控DLBCL中m6A RNA甲基化而促进肿瘤发生和不良预后

弥漫性大B细胞淋巴瘤(DLBCL)是最常见的淋巴恶性肿瘤亚型,它的开始和进展受遗传和表观遗传的畸变控制。N6-甲基腺苷(m6A)作为最丰富的真核信息RNA修饰,通过调控靶基因影响多种基础生物过程;然而,m6A修饰在DLBCL中的作用尚不清楚。此外,piwi相互作用RNA (piRNAs)已被证明是癌症的表观遗传效应。目前,有研究发现piRNA-30473通过调控DLBCL中m6A RNA甲基化而促进肿瘤发生和不良预后,该研究于2021年3月发表在《Blood》杂志,IF为17.543。
技术路线:
1. piRNA-30473在DLBCL中升高,是DLBCL患者的不良预后因素
作者首先研究小RNA的表达水平与DLBCL患者的临床相关性。通过分析微阵列数据,与预后不良组(PP)比较,在预后良好(FPP)的病例中发现了4个显著下调或上调的piRNAs(图1A)。在这四个差异表达RNA的基础上,作者进一步发现与预后良好(FPP)的患者相比,预后不良患者(PP)的piRNA-30473表达水平显著升高(图1B),且DLBCL患者高水平的piRNA-30473与较差的总生存率相关(图1C)。综上所述, piRNA-30473可作为预后的生物标志物,并可用于DLBCL患者的预后分层。

图1 piRNA-30473在DLBCL中升高,是DLBCL患者的不良预后因素
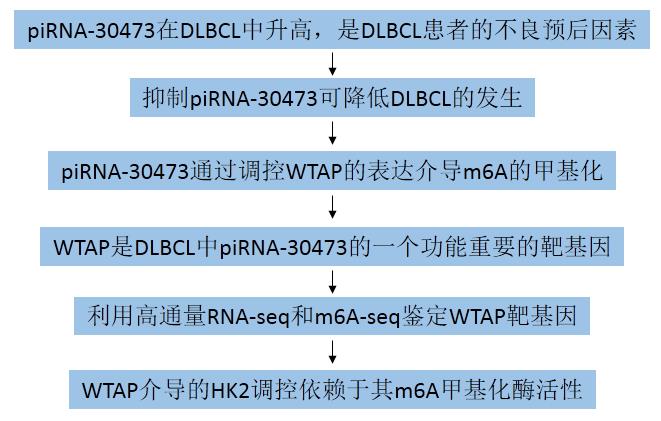
为了进一步探索piRNA-30473在DLBCL中的功能作用,作者使用antiagomir-30473在DLBCL细胞中去除piRNA-30473。结果发现,与对照组相比,在DLBCL细胞中耗尽piRNA-30473导致增殖减少(图2A)。此外,细胞周期分析显示,在DLBCL细胞中抑制piRNA-30473可以增加G1期细胞的比例,减少S期和G2期细胞的比例(图2B, 2C)。然而,耗尽piRNA-30473并不诱导细胞凋亡(图2D)。此外,通过SU-DHL-8异种移植DLBCL模型,以评估piRNA-30473对体内DLBCL进展的影响(图2E)。结果发现,抑制piRNA-30473抑制肿瘤增长 (图2F)。这些数据表明沉默piRNA-30473可以抑制DLBCL细胞在体内和体外的活性。
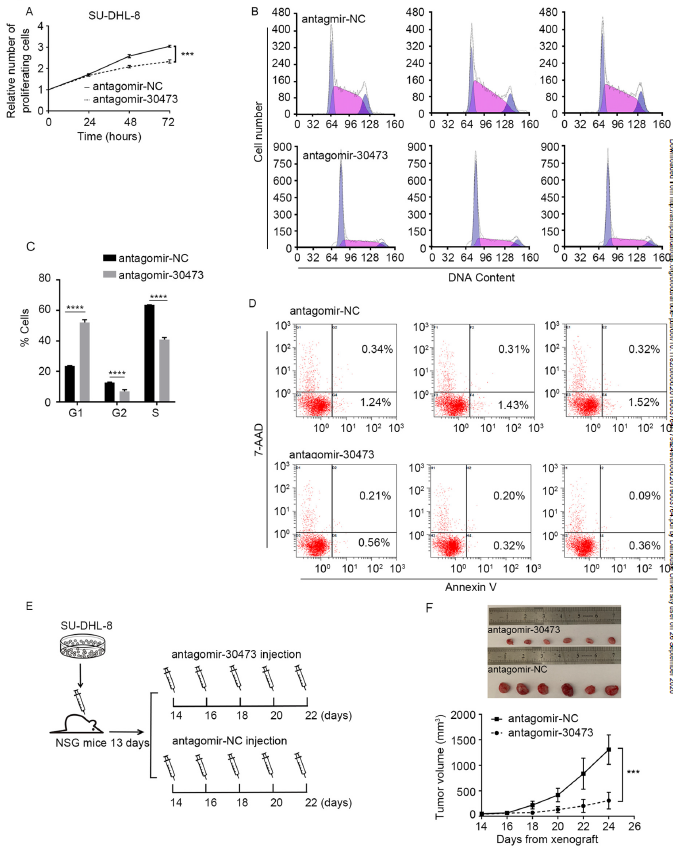
图2 抑制piRNA-30473可降低DLBCL的发生
3. piRNA-30473通过调控WTAP的表达介导m6A的甲基化
为了进一步探讨piRNA-30473在DLBCL中转录组调控中的作用,我们在转染antiagomir-30473后48 h检测m6A整体甲基化水平。结果显示,转染antiagomir-30473的细胞总体m6A水平降低(图3A, 3B)。METTL3, METTL14, WTAP, FTO 和ALKBH5是关键的m6A甲基转移酶或去甲基化酶,它们的失调可能导致DLBCL中m6A修饰谱异常。结果发现,抑制piRNA-30473降低了WTAP的表达(图3C,3D),而其他蛋白表达无明显差异。同时,免疫共沉淀表明,antiagomir-30473处理降低了WTAP与METTTL3和METTTL14的相关性(图3E)。
接下来为了证明piRNA-30473在WTAP mRNA中是否存在结合位点,作者先使用miRNA特异性靶检测算法确定假定的结合位点(图3F),后续实验结果证明,piRNA-30473通过与WTAP的3’-UTR结合,降低了WTAP mRNA的衰减,进而增强了mRNA的稳定性(图3G,3H)。
图3 piRNA-30473通过调控WTAP的表达介导m6A的甲基化
4. WTAP是DLBCL中piRNA-30473的一个功能重要的靶基因
作者研究WTAP是否在DLBCL的临床结果中发挥了关键作用,并使用免疫组化分析来评估DLBCL患者样本中WTAP蛋白的表达。免疫组化和GEO数据库分析均显示WTAP表达升高预示DLBCL患者预后不良(图4A,4B)。另外耗尽WTAP也可诱导生长抑制和细胞周期阻滞,且无凋亡迹象(图4C, 4D, 4E,图4F)。通过过表达WTAP可在很大程度上挽救对piRNA-30473的抑制作用。这些数据表明WTAP是piRNA-30473的重要功能靶点,并在DLBCL中发挥致癌作用。

图4 WTAP是DLBCL中piRNA-30473的一个功能重要的靶基因
5. 利用高通量RNA-seq和m6A-seq鉴定WTAP靶基因
为了进一步验证WTAP介导的m6A甲基化对DLBCL细胞的影响,对对照组和WTAP缺失的SU-DHL-8细胞进行m6A测序(m6A-seq)。结果发现,一致motif DRACH在免疫纯化的RNA中富集(图5A),m6A位点主要存在于外显子和3’-UTR中,且m6A位点在终止密码子附近富集程度最高(图5B),并通过筛选差异表达基因中出现的m6A低甲基化峰,鉴定出136个基因(图5C)。
HK2基因有助于肿瘤高糖酵解率,同时DLBCL在缺氧胁迫下促进生长需要HK2。GSEA分析表明,WTAP的潜在靶基因与缺氧信号显著相关 (图5D),提示HK2是DLBCL中WTAP的关键靶基因。m6A-seq数据显示,WTAP靶向HK2转录本的5’-UTR, WTAP的敲除导致5’-UTR的m6A水平显著下降(图5E)。最后作者为了验证HK2是否是WTAP靶基因,通过构建荧光素酶报告载体和CRISPR/CAS9敲除实验,证明了HK2是WTAP在DLBCL中的直接下游靶点(图5F,5G,5H,5I,5J)。

图5 利用高通量RNA-seq和m6A-seq鉴定WTAP靶基因
6. WTAP介导的HK2调控依赖于其m6A甲基化酶活性
m6A阅读器IGF2BP2识别WTAP转录本中的m6A位点,以促进其稳定性。qPCR结果显示,IGF2BP2缺陷细胞中HK2的转录水平显著降低(图6A),mRNA稳定性实验显示HK2在IGF2BP2缺陷细胞中趋于不稳定(图6B)。pGL3-HK2-WT载体的荧光素酶活性通过抑制IGF2BP2而降低,而pGL3-HK2-MUT载体的荧光素酶活性则消失(图6C)。因此, IGF2BP2与WTAP共同作用,影响DLBCL细胞中HK2 mRNA的稳定性和表达。此外,考虑到piRNA-30473在肿瘤发生和疾病进展中的功能重要性,利用选择性抑制剂靶向piRNA-30473/WTAP/HK2轴可能是治疗DLBCL的一种有前景的治疗策略(图6D)。
图6 WTAP介导的HK2调控依赖于其m6A甲基化酶活性
结论:
作者证明了piRNA-30473通过调节m6A RNA甲基化,从而触发下游信号级联而促进DLBCL的肿瘤发生和不良预后。该研究强调了m6A修饰机制在DLBCL中的功能重要性,并通过揭示一个之前未被发现的DLBCL基因调控机制,为肿瘤发生的表观遗传机制提供了深刻的见解。
参考文献:
Han H, Fan G, Song S, Jiang Y, Qian C, Zhang W, Su Q, Xue X, Zhuang W, Li B. piRNA-30473 contributes to tumorigenesis and poor prognosis by regulating m6A RNA methylation in DLBCL. Blood. 2021, 137(12):1603-1614.






