lncRNA在NPM1突变的急性髓系白血病事件中的罪证
核磷蛋白(Nucleophosmin,NPM1)是急性髓系白血病(AML)中最常见的突变基因,会导致编码的核仁蛋白(NPM1c+)发生异常胞浆易位。NPM1c +维持一个独特的白血病基因表达程序,以激活HOXA/B簇和MEIS1癌基因为特征,促进白血病发生。然而,NPM1c+控制这种基因表达模式促进白血病发生的机制仍在很大程度上未知。本文揭示了HOXBLINC lncRNA激活在NPM1c +白血病中扮演促癌作用。HOXBLINC和其合作者MLL1是NPM1c+ AML的潜在治疗靶点。本文于2021年3月发表在《Nature Communications》IF:14.919。
技术路线:

主要实验结果:
1、HOXBLINC lncRNA在NPM1c +白血病中特异性上调
HOX基因,特别是HOXA和HOXB聚类基因的上调不仅是AML发病的特点,也是其主要机制。HoxBlinc lncRNA已经被证明是在发育过程中激活前HoxB基因转录所必需的。为了确定HOXBLINC是否与HOXB基因一起在AML中异常表达,检测了正常BMMNC细胞和CD34+阳性细胞,以及NPM1c +AML病人中HOXBLINC lncRNA的表达,发现HOXBLINC lncRNA在NPM1c +AML病人中显著高表达,在TCGA数据发现一样的结果(图1A-B)。表明HOXBLINC lncRNA在NPM1c +白血病中特异性上调。
2、HOXBLINC的缺失扰乱了NPM1c+介导的转录程序和白血病发生
随后鉴定了NPM1c +AML和NPM1c WTAML病人中的差异表达基因,与WT相比,有871个下调基因和980个上调基因,包括HoxBlinc和NPM1c+的特征基因HoxB2-5,HoxA7,9-11,Meis1,Runx1(图1c)。然后,通过RNA-seq分析比较了对照组和HOXBLINCi细胞的全基因组转录组变化。一致地,NPM1c+细胞表现出HOXBLINC lncRNA和常见的NPM1c+ AML标记基因的高表达(图1d)。有趣的是,在OCI-AML3细胞中抑制HOXBLINC显著抑制了许多NPM1c+标志性基因的转录,如HOXB2-5、HOXA9-11、RUNX1和MEIS1(图1d)。GSEA和GO分析显示,HOXBLINC的缺失会影响NPM1突变、HOXA9通路、癌症、细胞周期、细胞命运、髓样细胞分化以及Wnt和JAK-STAT信号通路中涉及AML的通路和基因(图1e-f)。此外,与对照组相比,HOXBLINC KD显著抑制OCI-AML3细胞增殖(图1g)。当把Dox诱导的HOXBLINC KD OCI-AML3克隆移植到NOD-scid IL2Rγnull (NSG)小鼠,然后进行Dox诱导或对照处理时,与未接受Dox处理的小鼠相比,Dox处理的受体小鼠的生存期显著延长(图1h)。并且HOXBLINC KD显著增加了小鼠预后,以及肿瘤病理改变(图1i-j)。因此,HOXBLINCKD降低了肿瘤负担,并减弱了体内白血病进展,这可能是NPM1c+ AML患者的特异性。

图1 HOXBLINC在NPM1c+ AML患者中被激活,HOXBLINC的缺失扰乱了NPM1c+介导的转录程序和白血病发生
3、HoxBlinc在造血中的转基因表达导致小鼠的AML样致死疾病
已有研究表明,小鼠造血干细胞(HSCs)中人源化NPM1c+敲入等位基因(NPM1c/+)的激活会导致Hox基因过度表达、增强self-real和骨髓增生扩大,以及迟发性AML的发展。由于NPM1c+激活HOXBLINC,而HOXBLINC对NPM1c+介导的转录程序和白血病发生至关重要,因此确定HOXBLINC的激活是否足以导致异常造血和类似于NPM1c/+小鼠的髓系恶性肿瘤非常重要。HoxBlinc在长期(LT)和短期(ST)造血干细胞中表达高,在祖细胞(MPP, CMP和GMP)中表达降低,除了B220+ B细胞,在成熟细胞系中进一步降低(图2a)。HoxBlinc在造血中的表达模式提示该lncRNA可能在调控HSPC功能中发挥重要作用。为了研究HoxBlinc活化对体内正常造血和白血病发生的影响,构建了HoxBlinc转基因(Tg)小鼠模型,在Vav1启动子和增强子(HS321/45-vav载体)的控制下,将全长小鼠HoxBlinc cDNA插入小鼠基因组,以确保转基因在造血系统中的特异性表达(图2b)。获得2只HoxBlincTg小鼠。将该转基因插入到Tg第1系18q染色体上Bin1基因的内含子中(图2c)。BM细胞中HoxBlinc RNA的表达水平分别是Tg Line #1和#2内源性HoxBlinc表达水平的18倍和3倍(图2d)。
对HoxBlincTg (Line #1)小鼠队列的监测显示,1岁以内,67%的HoxBlincTg小鼠(15只中有10只)因病死或被杀,而WT小鼠(n = 12只)没有死亡(图2e)。与野生型相比,垂死的HoxBlincTg小鼠表现出体重减轻、肝脾肿大、淋巴结肿大以及脚垫和股骨苍白(图2f)。形态学上,May-Grünwald-Giemsa染色显示母细胞明显增加(图2g,左)。BM细胞自旋制备也显示髓系细胞占优势,未成熟髓系前体增多(图2g,右侧)。骨髓组织切片的形态学评估显示髓样增生伴未成熟髓样前体增多,以髓过氧化物酶(MPO)阳性表明髓样来源(图2h)。此外,HoxBlincTg的组织学评估显示脾脏、肝脏和淋巴结切片正常器官结构扭曲,并有MPO阳性骨髓细胞浸润(图2h-i)。这些数据表明,与NPM1c/+小鼠相似,HoxBlinc过表达小鼠足以引起类似AML的异常血液学特征。
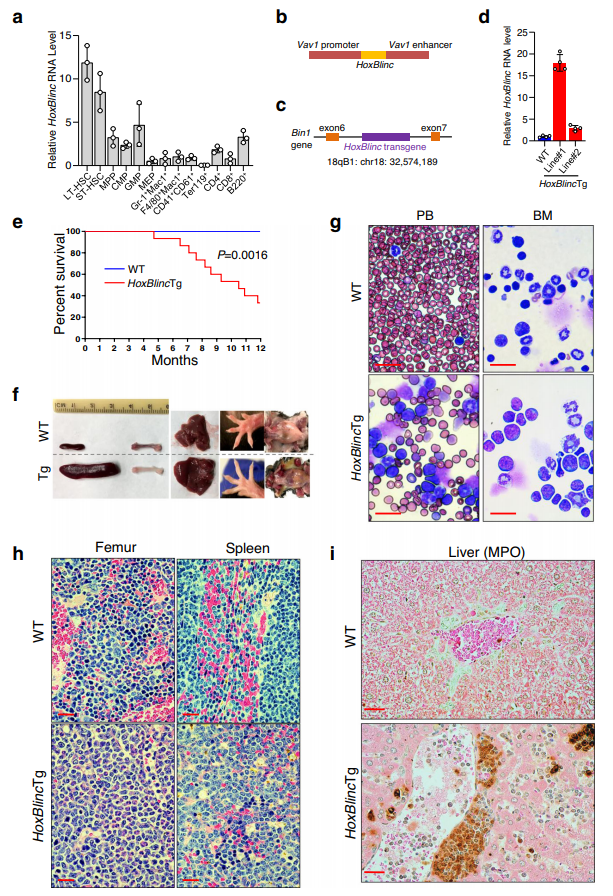
图2 HoxBlinc转基因过表达小鼠导致致死性AML
4、HoxBlinc基因表达增强HSC自我更新,扩大骨髓形成
NPM1c+促进HSC自我更新和髓细胞扩张的能力已被明确。为了进一步了解HoxBlinc在AML发病机制中的作用,研究了HoxBlinc过表达对HSPC功能的影响。HoxBlincTg BM细胞中Lin- scale-1+c-Kit+ (LSK)细胞的比例明显高于野生型小鼠,而Lin- scale-1- c-Kit+ (LK)细胞群与野生型小鼠相似(图3a)。计算ST-HSCs LT-HSCs总数时,股骨和多能祖细胞(MMP)计算基于比例LSK内细胞群和BM多孔性,LT-和ST-HSCs池,但不是MPP明显扩大,尽管只有ST-HSCs LSK内细胞的比例增加(图3b)。当对LK细胞内的每个髓系祖细胞群进行分析时,HoxBlincTg小鼠中GMP的百分比显著高于WT小鼠,但MEP/CMP细胞群的百分比低于WT小鼠(图3c)。因此,HoxBlinc过表达导致HSPC池失调,导致体内造血系统向髓系倾斜。
接下来,通过体外复制、配对子细胞实验和体内竞争移植研究了HoxBlinc过表达对造血干细胞自我更新和再生能力的影响。在HoxBlincTg LSK细胞中,连续4轮的复制电位均显著高于WT细胞(图3d)。使用WT和HoxBlincTg原始CD34−LSK细胞的配对子细胞检测显示,具有对称自我更新能力的HoxBlincTg CD34−LSK细胞比例更高,而进行对称分化或不对称自我更新的细胞比WT减少(图3e)。竞争移植实验表明,HoxBlincTg BM细胞移植后,受体外周血中供体细胞(CD45.2+)嵌合率稳定上升,移植7个月后达到~80%,而WT BM细胞移植后小鼠外周血中CD45.2+细胞群保持在~50%(图3f)。有趣的是,接受HoxBlincTg BM细胞的小鼠在移植后2.5-7个月死亡率更高(图3g)。总体而言,HoxBlinc基因在小鼠中的表达增强了HSC的自我更新,并扩大了骨髓形成,导致AML样疾病,与NPM1c/+小鼠中看到的表型相似。
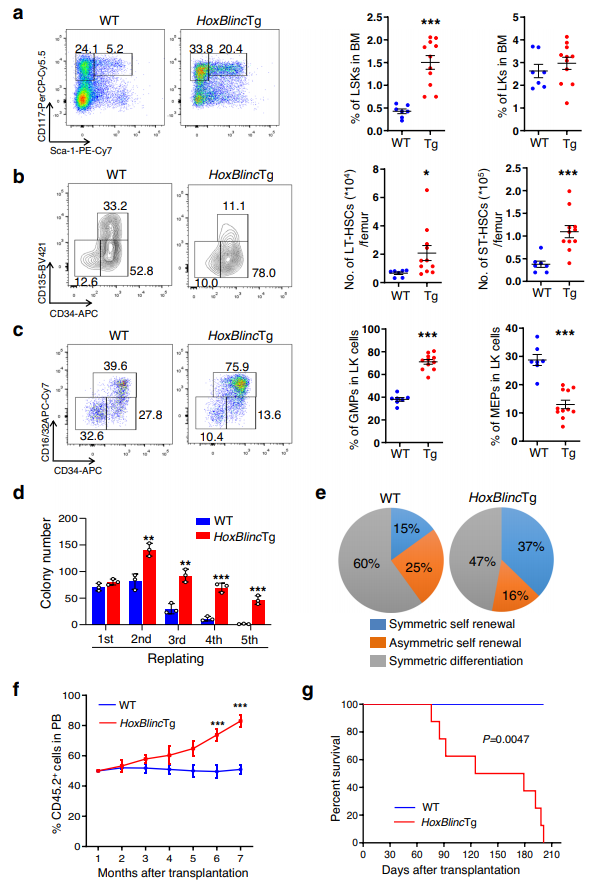
图3 HoxBlinc转基因表达增强HSC自我更新,扩大骨髓形成
5、HoxBlinc的过表达通过提高HSPC+中增强子/启动子染色质的可及性激活NPM1c+标记基因
为了进一步确定HOXBLINC是否是NPM1c+的下游介质,以维持HSPC中NPM1c+标记基因的激活,对8周龄小鼠的WT和HoxBlincTg LSK细胞进行了RNA-seq,总计鉴定到1281个差异表达基因(图4a)。其中,上调的有718个,下调的有563个。值得注意的是,在NPM1c/+ vs . WT LSK细胞中,27.3%的上调基因和21%的下调基因基因重叠(图4b)。GSEA分析HoxBlincTgv s. WT LSK细胞差异表达基因揭示了与NPM1c / +与WT LSK细胞相似的转录特征和富集通路,包括NPM1-mutated特征,HOXA9致癌途径,HSC增殖,细胞命运的承诺,骨髓分化,Wnt和JAK-STAT信号通路(图4c-d)。
由于HoxBlinc通过招募SETD1A和MLL1复合物,并在HoxB前位点组织活跃的染色质结构域,促进HoxB前基因的表达,NPM1c+或HoxBlincTg引起的HoxBlinc上调可以通过增强子/启动子染色质可及性来激活其在HSPC中的靶基因。为了验证这一点,使用WT、NPM1c/+和HoxBlincTg小鼠的LSK细胞进行了转座酶可及染色质分析高通量测序 (ATAC-seq)。巧合的是,NPM1c/+和HoxBlincTg LSK细胞有相当一部分基因表现出启动子可及性的增加(28.9%)或减少(24.3%)(图4e)。此外,NPM1c+或HoxBlincTg使启动子可及性增加的基因中有相当一部分也上调,这些基因包括NPM1c特征基因HoxB2-5、HoxA9-10、Meis1和Runx1,以及其他靶基因如Stat1和Cdr2(图4f-g)。这些结果表明HoxBlinc lncRNA的过表达通过增强HSPC中增强子/启动子染色质的可及性特异性激活NPM1c+标记基因。
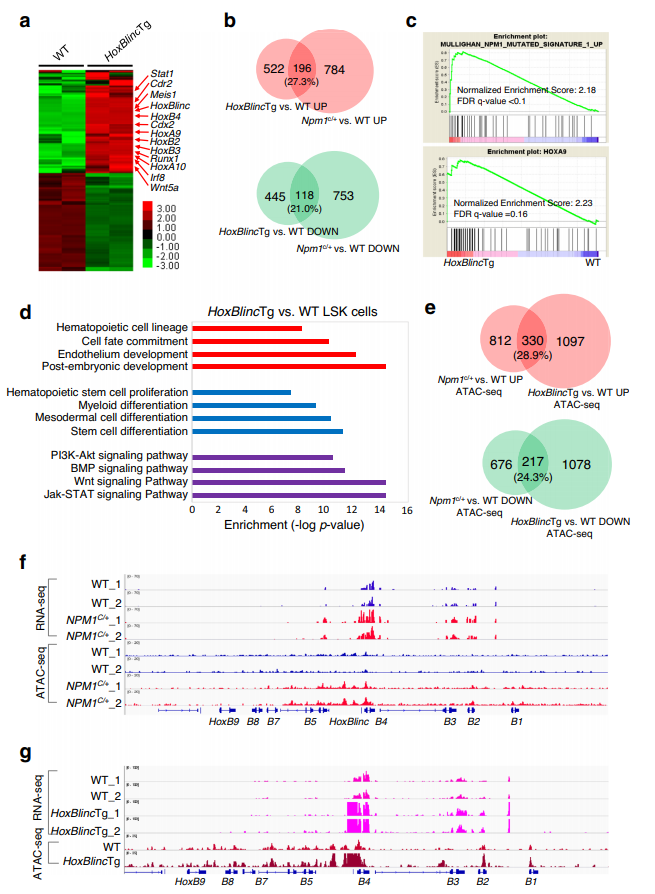
图4 HoxBlinc过表达通过增强LSK细胞启动子染色质的可及性激活NPM1c+标记基因
6、HoxBlinc直接与靶基因结合,介导染色质相互作用,驱动HSPC中的基因调控网络
CTCF边界促进了受限拓扑相关域(TADs)内增强子/启动子的相互作用。作者之前报道了后HOXA位点的CTCF边界建立和维持活跃的TAD,以驱动后HOXA基因表达。为了研究HoxBlinc过表达是否会影响CTCF定义的HoxB位点前TAD域和增强子/启动子调控网络,使用高通量测序捕捉环状染色体构象(4C-seq) 使用HoxB位点CTCF结合位点(cbs)作为HoxBlincTg与WT Lin−c-Kit+细胞(图5a)。有趣的是,HoxBlinc过表达增强了这些由CBS5 /5和/或+43CBS介导的HoxB前位点内的长程相互作用(图5b)。而+73Kb CBS (+73CBS)和HoxB13 CBS (CBS13)与前HoxB基因不互作,尽管+73CBS与CBS5/6和CBS8/9存在交互作用,但不受HoxBlinc过表达的影响(图5b)。此外,HoxBlinc过表达也诱导了CBS4/5和/或+43CBS与HoxBlinc靶基因如Stat1、Crd2和后HoxA基因启动子区域的长程相互作用,而非HoxBlinc靶基因HoxD(图5c)。这些数据表明,HoxBlinc与CBS4/5和+43CBS协调,促进并维持与NPM1c+标记基因位点的长期染色质相互作用,从而激活它们。
为了完全理解HoxBlinc过表达调控HSPC造血转录程序的机制,进行了ChIRP-seq在WT和HoxBlincTg Lin - c-Kit+细胞中绘制基因组HoxBlinc结合位点。HoxBlinc的过表达显著增加了其与HoxB前基因启动子区域和其他反式靶点的结合,如Stat1、Cdr2、Wnt5a、Runx1和后HoxA基因(图5d)。Lin-c-Kit+细胞基因组中HoxBlinc结合位点的整体分布表明,HoxBlinc主要与非编码区相互作用,包括基因间区、内含子和启动子。值得强调的是,HoxBlinc的过表达显著增加了其与启动子和UTR的占用(图5e)。整合来自WT和HoxBlincTg HSPC的ChIRP-seq、RNA-seq和ATAC-seq数据集显示,大约74%的基因HoxBlinc结合增加表现在基因表达水平增加两倍以上(图5f),44.7%的基因表现出启动子染色质可及性增强(图5g)。这些数据表明,HoxBlinc直接结合造血特异性靶基因,主要是NPM1c+特征基因,并介导染色质的长程相互作用,驱动HSPC的基因调控网络。

图5 HoxBlinc直接与靶基因结合,介导染色质相互作用,驱动HSPC中的基因调控网络
7、MLL1的募集对于HoxBlinc过表达介导的靶基因表达和HSPC功能异常至关重要
由于HoxBlinc招募SETD1A和MLL1复合物在小鼠ECS衍生的原始红细胞祖细胞的HoxB位点组织活性染色质域。所以作者先证实了人类HOXBLINC与MLL1和SETD1A的相互作用。然后体内外研究SETD1A和MLL1在HoxBlinc过表达介导的HSPC功能异常和白血病发生中是否重要。然而,在HoxBlincTg LSK细胞中,敲除Mll1而非Setd1a能够缓解HoxBlinc过表达介导的异常复制潜能(图6a)。当使用表达慢病毒对照或shMll1的HoxBlincTg Lin c-Kit+细胞进行移植时,与表达HoxBlincTg Lin c-Kit+细胞的shScramble相比,mll1KD显著延长了接受shMll1表达HoxBlincTg Lin c-Kit+细胞的受体的存活时间(图6b)。而mll1KD也能很大程度上恢复HoxBlincTg小鼠中CD117+/CD11b+未成熟髓系细胞和GMPs的异常扩增以及贫血(图6c, d)。这些数据表明Mll1 KD能够缓解HoxBlinc过表达诱导的AML发展。
由于MLL1在HoxBlinc过表达介导的异常造血过程中至关重要,HSPC中HoxBlinc过表达可能通过增加MLL1募集来激活其靶基因,从而提高H3K4me3占用率,以促进增强子/启动子染色质的可及性。为了证实这一点,使用WT和HoxBlincTg LSK细胞进行了MLL1和H3K4me3 ChIP-seq。ChIP-seq和CHIRP-seq联合分析显示HoxBlinc和MLL1的基因组结合位点存在高度重叠(图6e-g)。令人惊讶的是,51.2%的基因HoxBlinc结合增加显示MLL1招募增加,其中大部分(31.7%)也显示H3K4me3占用增加,包括NPM1c+-标记基因,如前HoxB、后HoxA、Meis1和Runx1,以及其他造血基因,如Stat1和Cdr2(图6e-g)。这些数据表明,HoxBlinc过表达通过增加MLL1的募集和随后H3K4me3占用的增强来介导靶基因的表达。

图6 MLL1的募集对于HoxBlinc过表达介导的靶基因表达和HSPC功能异常至关重要
总之,本文发现HOXBLINC过表达是驱动白血病发生的关键事件,通过控制MLL1招募、染色质结构域和启动子的顺式和反式表达,建立异常NPM1c+标记基因表达程序。因此,本研究不仅为HSC和NPM1突变的AML的生物学提供了分子视角,而且还为NPM1c+ AML的药物靶点识别创造了独特的机会。
参考文献:
Zhu Ganqian., Luo Huacheng., Feng Yang., Guryanova Olga A., Xu Jianfeng., Chen Shi., Lai Qian., Sharma Arati., Xu Bing., Zhao Zhigang., Feng Ru., Ni Hongyu., Claxton David., Guo Ying., Mesa Ruben A., Qiu Yi., Yang Feng-Chun., Li Wei., Nimer Stephen D., Huang Suming., Xu Mingjiang.(2021). HOXBLINC long non-coding RNA activation promotes leukemogenesis in NPM1-mutant acute myeloid leukemia. Nat Commun, 12(1), 1956. doi:10.1038/s41467-021-22095-2






