HIF-2α激活通过增加细胞内的铁来增强结肠癌细胞的氧化死亡

结肠癌(CRC)是世界上第三常见的癌症,也是癌症相关死亡的主要原因。癌细胞迅速扩张,所有实体瘤由于血管化不足而经历缺氧。缺氧是实体肿瘤的一个标志,它促进细胞生长、生存和转移,并对化疗和放疗产生耐药性。缺氧反应主要由转录因子缺氧诱导因子1α (HIF-1α)和HIF-2α介导,而HIF-1α和HIF-2α在CRC中表现出不同的作用。我们的研究表明,癌症细胞依赖于HIF-2α的一种机制脆弱性,可用于CRC治疗。该研究2021年6月发表在《JOURNAL OF CLINICAL INVESTIGATION》,IF为14.808。
技术路线:
主要研究结果:
1. 药物筛选确定肿瘤类肠道中HIF-2α的合成易损性
作者构建Apc缺失型(Cdx2-ERT2Cre;Apcfl/fl)和CRC HIF-2α过表达小鼠模型(Cdx2-ERT2Cre;Apcfl/fl HIF-2αLSL/LSL),从这2个小鼠模型中分离肠类药物,并用化疗药物培养,生长被监测了5天(图1A)。在Cdx2-ERT2Cre;在Apcfl/fl HIF-2αLSL/LSL小鼠中,他莫昔芬可诱导HIF-2α,并特异性地破坏结肠上皮细胞中的Apc。来自Cdx2-ERT2Cre;Apcfl/fl肿瘤肠系膜的小鼠对doxorubicin, mitoxantrone, irinotecan,以及 eribulin等药物高度敏感,与来自Cdx2-ERT2Cre;Apcfl/fl HIF2αLSL/LSL的不同(图1B)。RSL3、sorafenib索拉菲尼、erastin和DMF被认为是最有效的小分子,可以显著降低Cdx2-ERT2Cre;Apcfl/fl HIF2αLSL/LSL肿瘤肠道类物质的生长(图1C)。Erastin和RSL3是经典的ferroptosis激活剂,分别抑制xCT(由Slc7a11基因编码,是xC系统的一个组成部分)和GPX4。DMF一种细胞可渗透的线粒体衍生物,在一些癌症细胞系中具有细胞毒性(图1D)这些结果表明,HIF-2α表达的肿瘤可以被氧化应激激活剂选择性靶向。

图1 筛选能抑制过表达HIF-2α的肿瘤肠样细胞生长的化合物
Erastin和RSL3是经典的铁死亡诱导剂,作者已证明,缺氧模拟FG4592或缺氧显著增强了铁死亡诱导物erastin和RSL3以HIF-2α依赖的方式处理后的细胞死亡。作者在最后一次给药后14天,分析这些小鼠的结肠组织的组织学变化(图2A)。Slc7a11的缺失或HIF-2α的过度表达与对照动物的情况无法区分(图2B)。然而,Slc7a11的破坏与HIF-2α过表达联合导致结肠上皮变性和空泡化(图2B)。通过4-羟基2-壬烯醛(4-HNE)染色测定脂质过氧化诱导的氧化应激(图2C)。与对照组相比,Villin-CreERT2Slc7a11fl / fl; HIF-2αLSL/LSL小鼠的组织学评分(图2D)和4-HNE强度(图2E)均显著增加,表明这些小鼠氧化应激和上皮细胞损失增加。此外,与对照组比较,Villin-CreERT2-HIF-2αLSL/LSL小鼠的HILPDA和PLIN2 mRNA水平显著升高(图2F)。与对照组相比,Villin-CreERT2-HIF-2αLSL/LSL小鼠肝脏和肠道铁水平都更高(图2G)。肝脏铁含量的增加是由于小肠对铁的吸收增加。这些数据证实了HIF-2α在体内对铁死亡敏感的作用,并提示诱导铁死亡的药物可能对缺氧细胞有很高的杀伤效果。
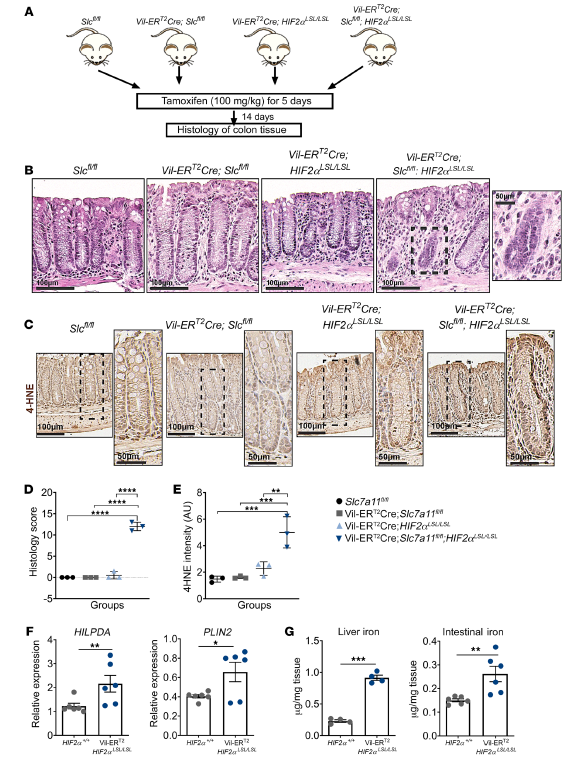
图2. HIF-2α激活可增强体内铁死亡
3. HIF激活可促进DMF诱导的CRC细胞死亡
作者的筛选鉴定出DMF是一种小分子,可以有效地减少低氧肿瘤肠道样体的生长(图1C)。一组CRC细胞系使用DMF单独或联合缺氧或模拟缺氧FG4592处理。通过MTT和长期克隆生存试验评估,FG4592增强DMF诱导的CRC细胞死亡(图3,A- C)。此外,DMF处理和缺氧培养的细胞存活率较低(图3,D和E)。与erastin和RSL3数据一致,HIF-2α是促进DMF介导的CRC细胞生长的关键(图3F)。
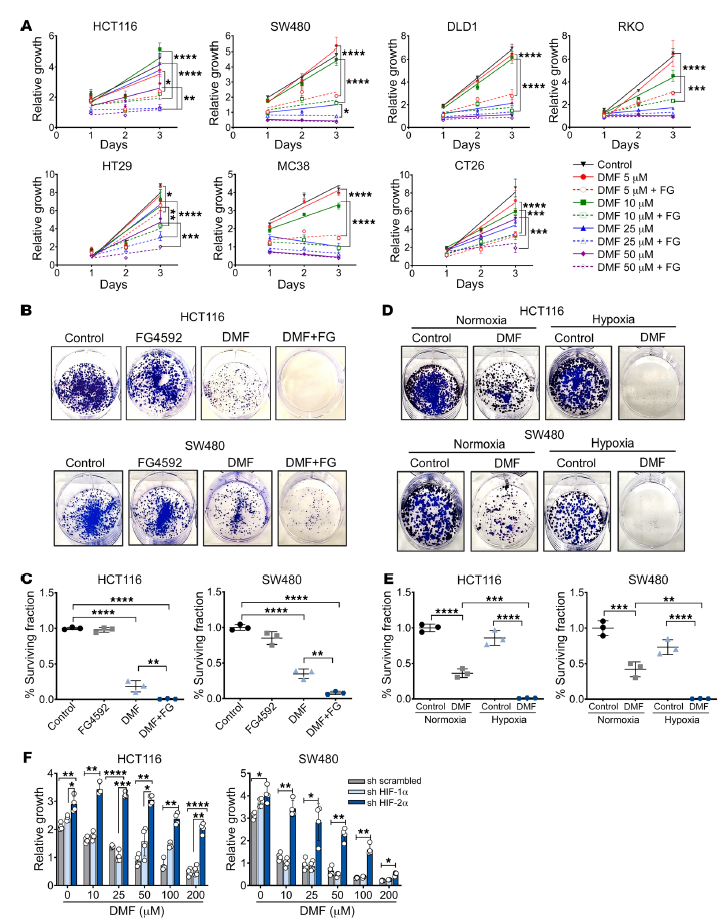
图3. 缺氧模拟有助于DMF诱导的CRC细胞生长抑制
4. DMF独立于铁死亡诱导细胞死亡
由于DMF与其他细胞对铁死亡激活剂一起有效地降低了缺氧细胞的生长(图1C),我们评估了DMF是否介导了铁死亡激活剂的死亡。在DMF处理后,Fer-1和Lip-1不能挽救细胞的死亡和活力,而rsl3介导的细胞死亡被Fer-1和Lip-1挽救(图4A)。在DMF处理后,Fer-1和Lip-1不能挽救细胞的死亡和活力,而RSL3介导的细胞死亡被Fer-1和Lip-1挽救(图4A)。DMF可与抗氧化剂GSH直接反应,导致NADPH降低,ROS增强。然而,FG4592和糖酵解抑制剂的共同作用并没有降低细胞活力(图4E)。这些结果表明,在DMF介导的缺氧肿瘤细胞死亡中有其他机制参与。

图4. DMF在CRC细胞中不是铁转移诱导物。
5. 在DMF诱导的HIF-2α介导的细胞死亡中,活性氧积累和铁毒性是必不可少的
添加半胱氨酸前体n -乙酰半胱氨酸(NAC)的生长培养基挽救了含或不含FG4592 DMF处理的HCT116和SW480细胞的死亡和活力(图5A和补充图9C)。在DMF处理和维持缺氧的细胞中也观察到类似的结果(图5B)。FG4592或单独的缺氧处理增加了ROS,这是通过细胞渗透的2,7 -二氯二氢荧光素二醋酸酯(H2DCFDA)评估的,它被用作ROS的指标(图5,C和D)。与DMF的协同处理增强了ROS生成的增加,而NAC可以挽救ROS生成(图5,C和D)。为了证实对氧化细胞死亡的敏感性是由HIF-2α介导的,利用了shRNA介导的HIF-1α和HIF-2α敲低细胞。HIF-2α敲低细胞中的ROS水平显著降低(图5E),表明DMF处理后HIF-2α在ROS产生中的作用。
由于HIF激活会导致线粒体代谢的变化和ROS的产生,作者分析了DMF或FG4592处理是否会引起线粒体代谢物池的变化。然而,线粒体代谢物水平未见显著变化,表明HIF-2α通过其他机制影响细胞ROS(图5F)。由DMF和FG4592介导的细胞死亡在低铁和对照培养基中被挽救(图5G)。总之,这些数据表明,铁毒性通过HIF-2α和氧化应激脆弱性的机制。
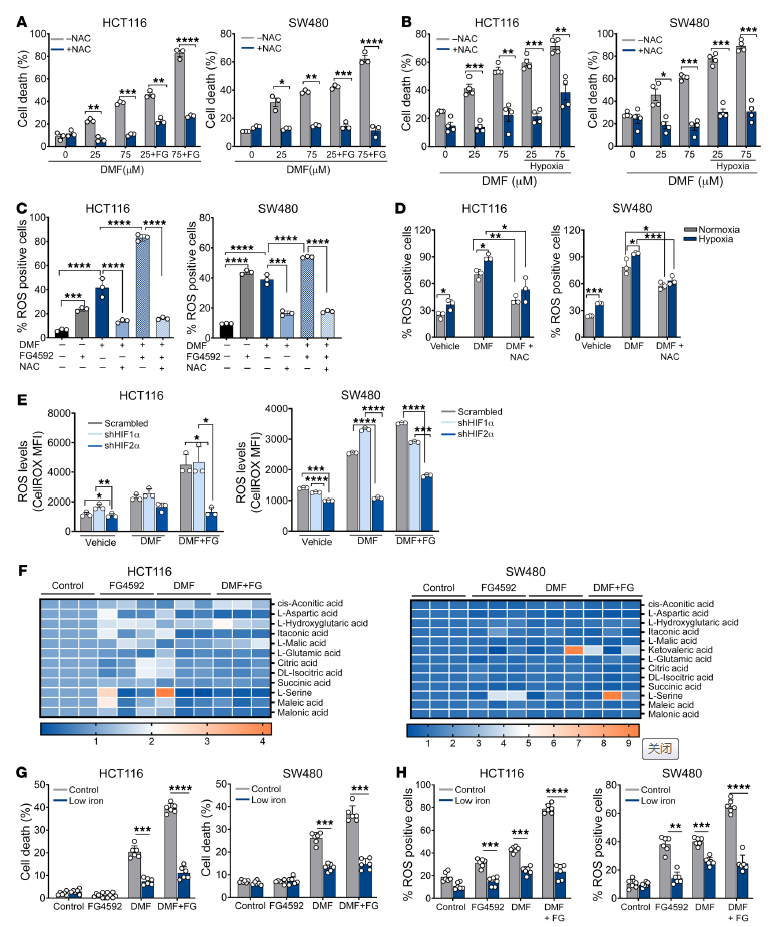
图5. 活性氧的产生和铁的积累参与DMF和FG4592介导的CRC细胞死亡
6. H2S的保护性过硫化作用可以挽救DMF和HIF-2α诱导的细胞死亡
接下来,评估了不可逆的蛋白质氧化是否参与了DMF和FG4592诱导的细胞死亡。H2S可通过过硫化作用(翻译后修饰)防止半胱氨酸硫醇的过度氧化(图6A) 为了排除H2S的保护作用不是由于DMF上的硫化物阴离子亲核添加导致的DMF消耗,在DMF和FG4592或DMF和缺氧导致细胞死亡16小时后,将Na2S和3-MP添加到新鲜培养基中(图6B)。即使在这些条件下,Na2S和3-MP也能防止细胞死亡(图6,C和D)。此外,补充3-MP和Na2S后,DMF或DMF和FG4592诱导的细胞内ROS水平降低(图6E)。这些数据与模型一致,即DMF增强HIF诱导的细胞死亡涉及氧化蛋白损伤,而氧化蛋白损伤受到H2S的保护。
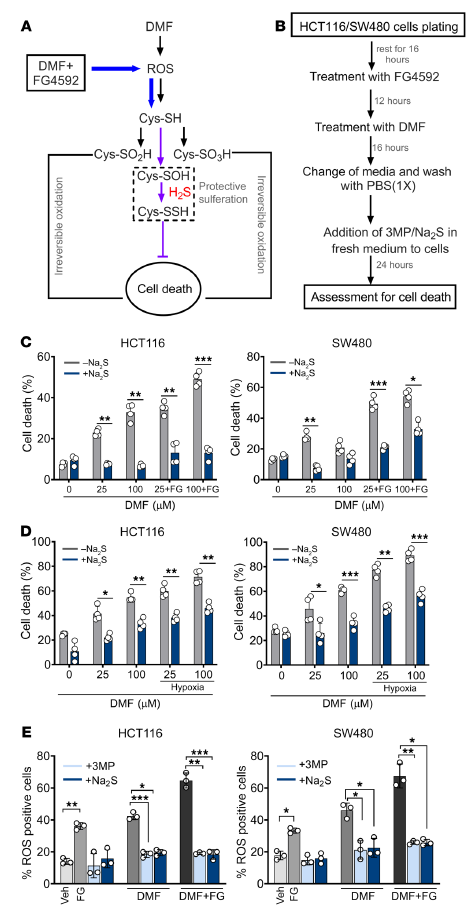
图6. H2S可防止不可逆的蛋白质氧化,挽救DMF和FG4592介导的细胞死亡
7. FG4592增强DMF介导的体内CRC细胞死亡
接下来,作者评估了DMF和FG4592联合治疗已建立的CRC肿瘤的体内疗效。此,HCT116、SW480和DLD1细胞被皮下植入免疫缺陷小鼠的侧壁,并在DMF和FG4592治疗前建立10天(图7A)。从与接受对照或单独药物治疗的患者相比,在所有3个异种移植中,DMF和FG4592治疗的肿瘤体积(图7B)和肿瘤重量(图7C)均显著减少。通过BrdU掺入试验评估的肿瘤细胞增殖在DMF和FG4592联合处理的HCT116、SW480和DLD1异种移植中也降低了(图7D)。然而,在与DMF和FG4592共同处理的所有3个异种移植物中,tunel阳性凋亡细胞的百分比都有所增加(图7E)。总之,这些数据表明,缺氧肿瘤细胞对DMF治疗非常脆弱,突出了一个潜在的治疗窗口。

图7. DMF和FG4592增强体内CRC细胞死亡
为了证实HIF-2α在DMF介导的体内CRC细胞死亡中的作用,利用HIF-2α敲低HCT116细胞。在DMF和FG4592治疗前,将稳定的非靶标扰乱和HIF-2α敲低的HCT116细胞皮下注射到免疫受损小鼠的两侧,并允许其生长10天(图8A)。HIF-2α基因敲低的细胞对DMF和FG4592处理具有抗性。在DMF+FG4592处理的小鼠中,表达杂乱shRNA的细胞显示肿瘤体积和重量显著减少,而HIF-2α敲低的细胞则完全耐受(图8,B和C)。同样,在DMF+FG4592处理后,HIF-2α敲低细胞的肿瘤增殖和凋亡没有改变(图8,D和E)。这些数据表明,HIF-2α激活增加了体内氧化细胞死亡的脆弱性。
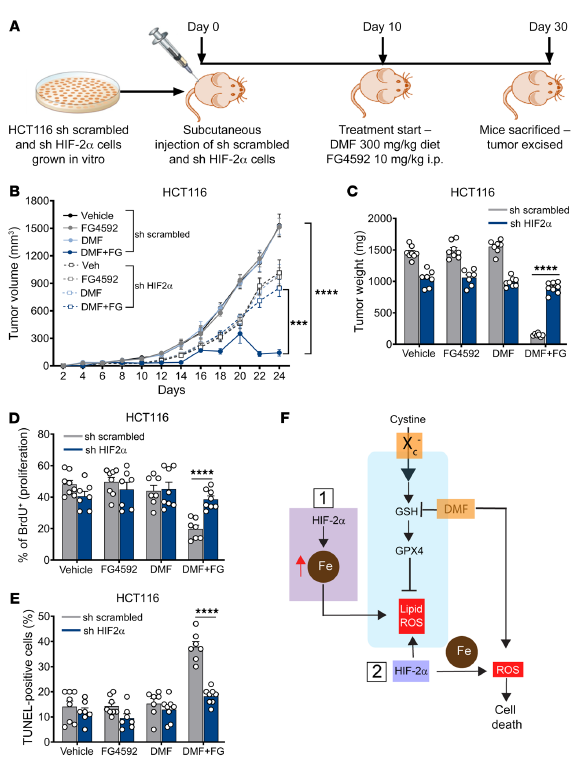
图8. DMF介导的体内CRC细胞死亡依赖于HIF-2α
总结:
该研究揭示了HIF-2α在驱动低氧CRC细胞对氧化应激诱导化合物(如DMF)的合成致命性方面的作用,并揭示了利用这种内在脆弱性进行化疗发展的潜力。






