外泌体linc-ROR介导癌细胞和脂肪细胞之间的串扰,促进胰腺癌肿瘤的生长

胰腺癌(PC)是最棘手的癌症之一,被认为是预后最差的消化系统肿瘤。外泌体是微环境中肿瘤细胞和基质细胞之间相互交流的重要介质。肿瘤的发展不仅由癌细胞决定,还受肿瘤微环境(Tumor microenvironment, TME)中缺氧、脂质和间质细胞这三个重要因素的调控。肥胖与包括PC在内的几种癌症的风险增加有关,并增加PC的发病率和死亡率。然而,PC衍生的外泌体在TME的进展和与脂肪细胞的串扰中的潜在分子机制尚未阐明。因此,有作者对此进行了研究,并把研究结果发表在《Molecular Therapy - Nucleic Acids》,IF:8.886。
技术路线:
主要研究结果:
1. PC细胞衍生的linc-ROR相关外泌体的特性和作用
为了研究外泌体对PC细胞释放的脂肪细胞的影响,从培养基的上清(无外泌体血清)中分离出外泌体,并通过透射电子显微镜(TEM)和纳米颗粒跟踪分析(NTA)进行定量。透射电镜显示直径为30 ~ 150 nm的清晰圆形颗粒(图1A),NTA显示出类似大小的外泌体分布(图1B和1C;)来源于PANC-1和BxPC-3细胞。在建立的PC细胞系(PANC-1, AsPC-1, MIA-PACA-2, CFPAC-1和BxPC-3)中观察到linc-ROR的表达高于永生的正常胰腺细胞系(CCCHPE- 2)(图1D)。此外,外泌体linc-ROR的差异表达与细胞内linc-ROR一致(图1E)。Western blot分析从CC-HPE-2、PAN-1和BXPC-3细胞上清分离的外泌体中提取的蛋白,显示了外泌体蛋白CD9和TSG101的存在(图1F)。接下来,研究外泌体linc-ROR的稳定性。从PANC-1上清液中分离出的外泌体作为参考,用RNase A (10 mg/mL)培养0、30、60和90 min,在每个时间点测量外泌体linc-ROR表达(图1G)。此外共聚焦显微镜证实了脂肪细胞摄取PC细胞外泌体的能力(图1H和2C)。脂肪细胞作为受体细胞,对PC细胞的外泌体具有吸收效率,表明外泌体linc-ROR可传递给脂肪细胞,在PC细胞和脂肪细胞之间的生物学功能调节中发挥着重要作用。
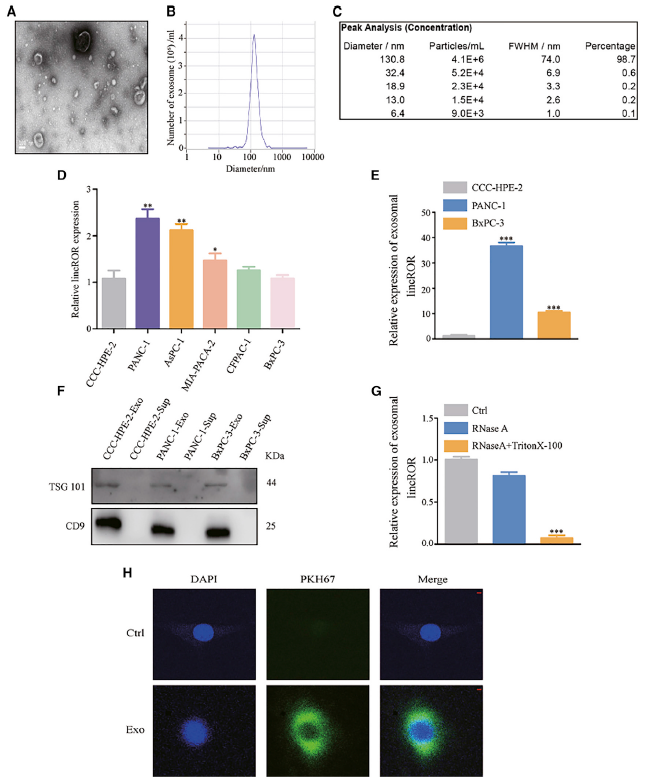
图1 PC细胞衍生的外泌体的特征和作用
2. PC细胞衍生的外泌体中linc-ROR表达的增加可以转移到脂肪细胞中,在共培养系统中诱导去分化
作者接下来使用体外间接共培养模型研究了外泌体linc-ROR在诱导脂肪细胞去分化中的作用(图2A)。为了探究外泌体linc-ROR在脂肪细胞脱分化中的作用机制,作者继续诱导3T3-L1脂肪细胞5天,使其成为具有独特脂滴的成熟脂肪细胞(图2B)。脂滴经红油染色呈规则的圆形。当从PC细胞中分离出来的外泌体(绿色荧光染料,pkh67标记)与脂肪细胞共培养时,激光扫描共聚焦显微镜(LSCM)显示,受体细胞(蓝色荧光染料,DAPI标记)随着时间的增加表达更高的摄取潜能(图2C)。这证实了吸收能力是依赖于时间的。
在与转染sh阴性对照(CoshCtrl)的PANC-1细胞共培养过程中,与转染shROR (CoshROR)相比,成熟脂肪细胞表现出脂滴明显减少,细胞外观呈拉长状,类似成纤维细胞的形态(图2D)。为了确定外泌体linc-ROR诱导脂肪细胞脱分化的机制,采用western blot和实时荧光定量PCR分析PID 11不同实验条件下脂肪细胞的基因表达水平。正如预期的那样,在一些成熟的脂肪细胞特异性标记物,如葡萄糖转运体-4 (GLUT4)、增殖激活受体γ (ppar)和激素敏感脂肪酶(HSL)的表达方面,我们观察到,与CoshROR或单个脂肪细胞(PBS-Adi)组相比,CoshCtrl组明显降低了它们的表达水平(图2E)。此外,还检测了一些成纤维细胞特异性基因的表达水平,如α平滑肌肌动蛋白(α-SMA)、基质金属蛋白酶11 (MMP11)和胶原蛋白I(图2E)。共培养6天后其表达水平显著升高,进一步支持脂肪细胞向成纤维细胞样细胞的脱分化过程。
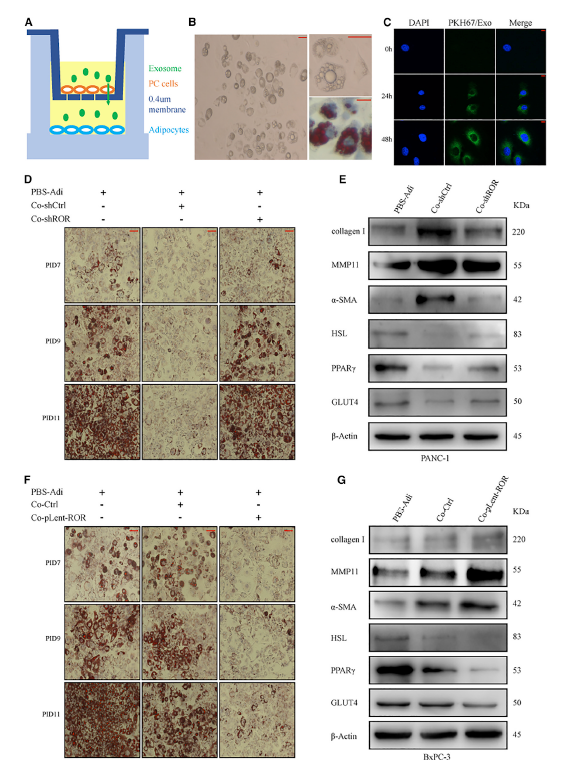
图2 PC细胞衍生的外泌体中linc-ROR表达水平的升高可以通过共培养系统转移到脂肪细胞并诱导去分化
3. 脂肪细胞通过外泌体linc-ROR去分化促进PC肿瘤的发生
功能上,菌落形成分析的结果显示,在共培养体系中,敲低/过表达外泌体linc-ROR表达显著降低/增强了PC细胞的生长活力(图3A和3B),实时细胞分析(RTCA) xCELLigence实验产生了类似的结果(图3C和3D)。如图所示,共培养/较高linc-ROR组比各自的对照组表现出更好的生长。这些结果也被EdU实验结果所证实(图3G和3H)。综上所述,外泌体linc-ROR表达较高的脂肪细胞脱分化后,PC细胞增殖能力增强。
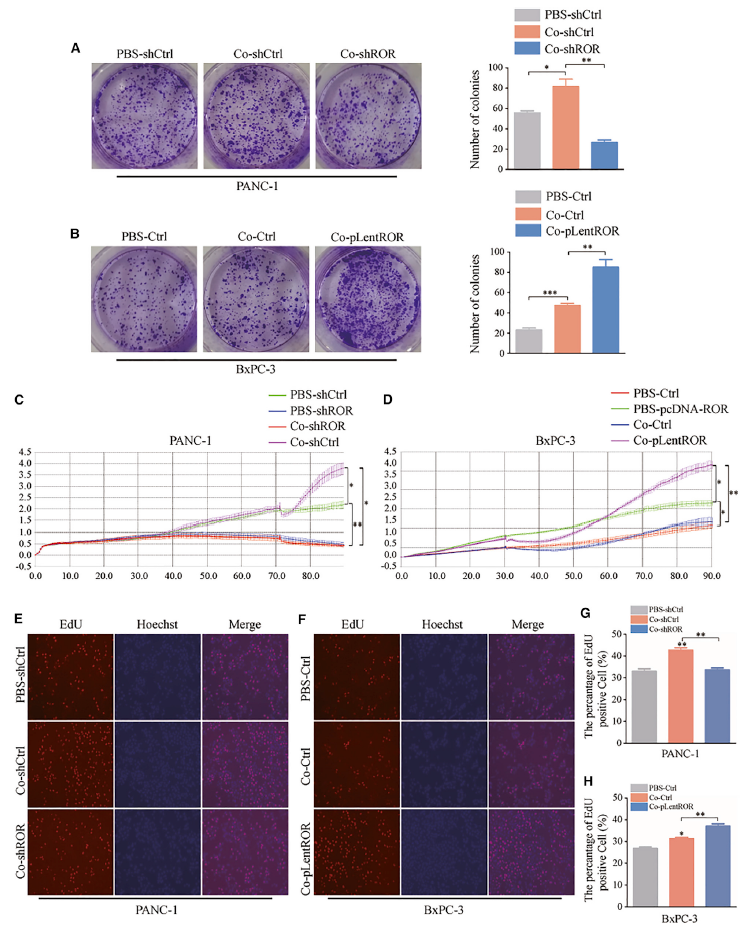
图3 脂肪细胞通过外泌体linc-ROR去分化促进PC肿瘤的发生
4. 脂肪细胞和PC细胞共培养系统诱导PC细胞的迁移、侵袭和形态改变,并伴有EMT
研究结果还表明,与PBS-shCtrl/PBS-Ctrl相比,脂肪细胞和外泌体linc-ROR共培养体系的条件培养基增强了PC细胞系的运动性(图4A和4B)。重要的是,作者发现由外泌体linc-ROR表达增加引起的脂肪细胞脱分化使PC细胞更有运动能力,如图4A和4B所示(图4A和4B)。此外,经外泌体linc-ROR处理的脂肪细胞产生的条件培养基在很大程度上诱导PC细胞通过Transwell过滤器迁移和侵袭(图4C和4F)。图像还显示,条件培养液改变了PC细胞的形态,从凝聚型转变为分散型(图5B),典型表现为细胞间连接丢失和细胞伪足扩展,免疫荧光(IF)实验显示,间质标记物波形蛋白表达增加,上皮标记物E-cadherin表达减少(图5A)。这些数据证实了外泌体linc-ROR的表达增加,通过共培养系统作用于脂肪细胞,促进体外PC转移。
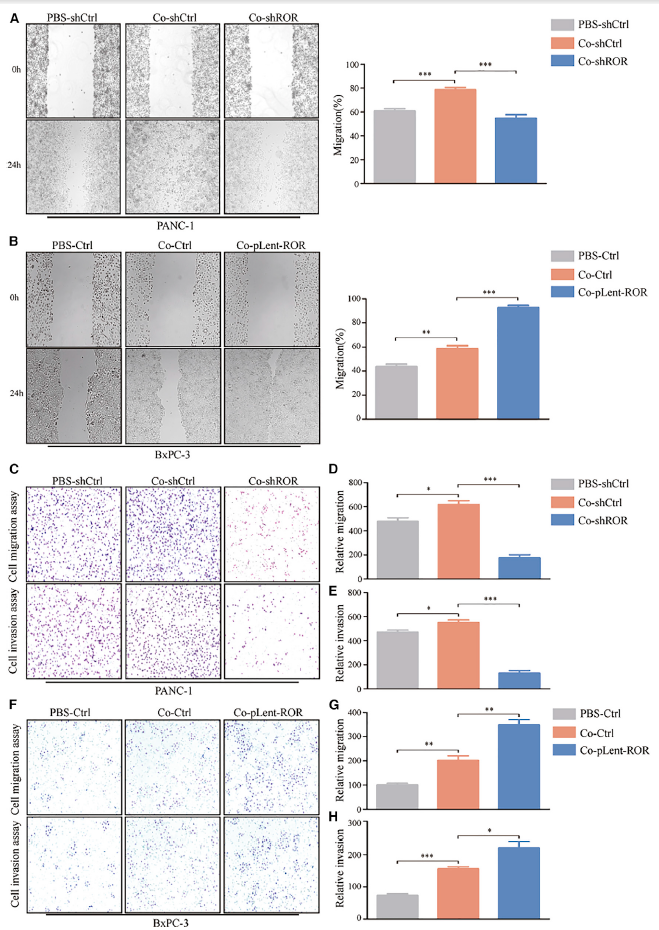
图4 脂肪细胞和PC细胞共培养系统诱导细胞迁移和侵袭
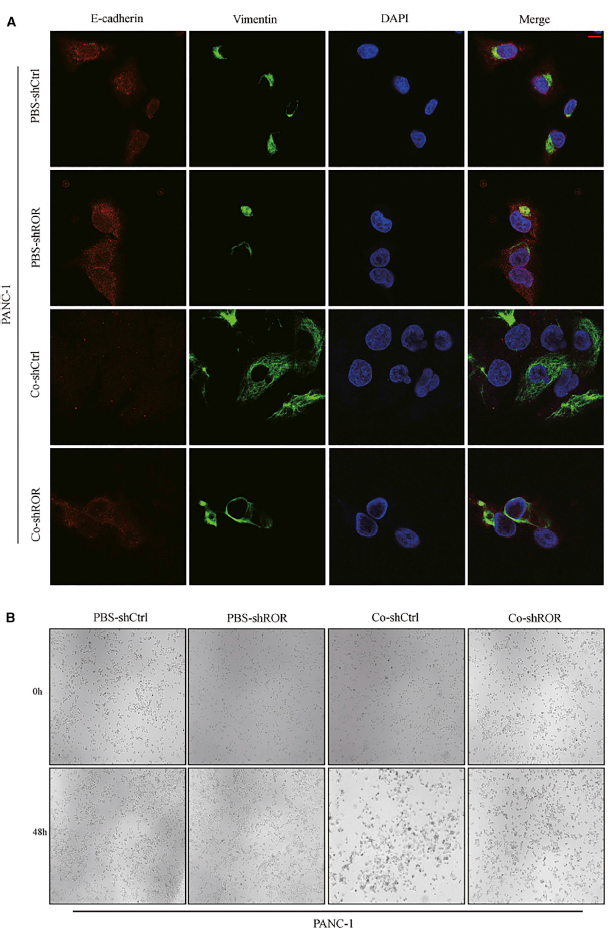
图5 共培养系统改变了PANC-1细胞的形态,诱导了EMT
5. 外泌体linc-ROR通过激活HIF1α/ZEB1信号通路和白细胞介素-1b (IL-1b)诱导脂肪细胞去分化,促进PC细胞的EMT
接下来,作者深入研究了外泌体linc-ROR和脂肪细胞条件培养基在PC微环境中的生物学功能。如图6A所示,只有外泌体linc-ROR增加的脂肪细胞表现出脱分化,最终随着共培养时间的延长(0 h、24 h和48 h)促进HIF1α的表达。此外,还测量了与脂肪细胞共培养的PANC-1细胞中ZEB1的表达(图6B)。结果表明,脂肪细胞在共培养过程中不仅促进了HIF1α的表达,而且随着时间的推移也促进了ZEB1的表达。在共培养系统中,HIF1α在ZEB1信号通路的有效重组中发挥了核心作用。使用实时定量PCR和western blotting来研究HIF1α是否在共培养条件下与作为对照的PBS激活ZEB1通路(图6C)。正如预期的那样,小干扰RNA (siRNA) (si-HIF1α)诱导的HIF1α的减少降低了ZEB1的表达。特别是HIF1α和共培养模型对ZEB1具有协同的正调控作用(图6I)。
为了增加上述结果的严谨性,使用转染了pLent-ROR的BxPC-3细胞来研究linc-ROR过表达是否会导致下游HIF1α-ZEB1表达的改变。实验结果揭示了linc- ROR和共培养条件在HIF1α-ZEB1信号通路中的有效性和可行性,并与plt阴性对照或pbs对照处理的BxPC-3细胞进行了比较(图6D-6F)。IL-1b等细胞因子在PC微环境中通过旁分泌信号在脂肪细胞和肿瘤细胞之间发挥重要的介导作用。因此,通过ELISA检测了与脂肪细胞共培养微环境中IL-1b的浓度(图6G和6H)。数据显示较高的外泌体linc-ROR可刺激脂肪细胞分泌IL-1b。此外,对PC细胞的western blot分析显示,ZEB1诱导的EMT细胞发生了典型的变化,包括E-cadherin蛋白表达降低,而vimentin蛋白表达显著升高(图6C, 6F, 6I)。因此,这些结果表明,外泌体linc-ROR诱导脂肪细胞脱分化,并提高PC细胞中ZEB1的表达,从而诱导EMT。
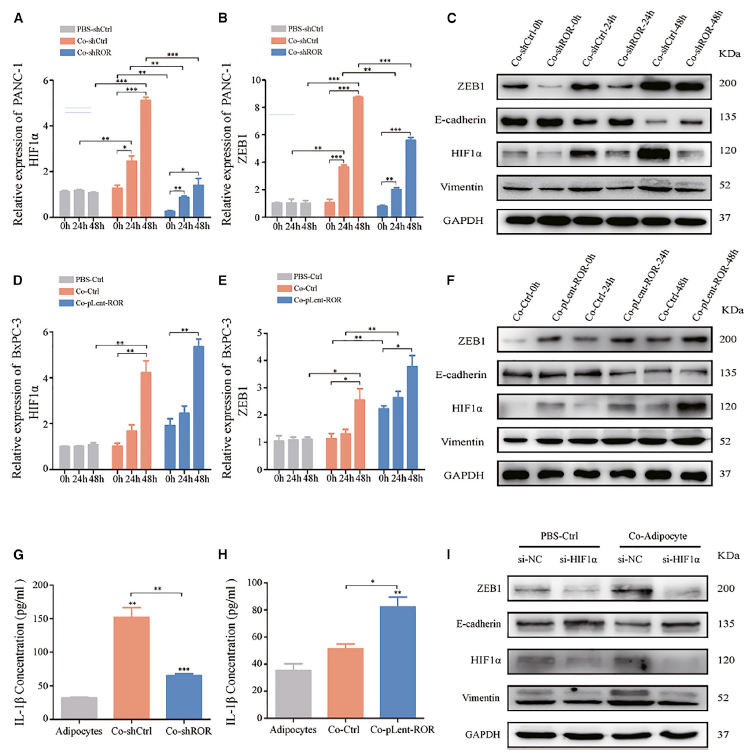
图6 外泌体linc-ROR通过激活HIF1α-ZEB1信号通路和增加IL-1b,诱导脂肪细胞去分化,促进PC细胞的EMT
6. 外泌体linc-ROR介导的肿瘤微环境可促进PC细胞通过体内脂肪细胞的条件培养基生长
为了进一步评估外泌体linc-ROR在脂肪细胞转化表型中的作用,从而促进体内PC增殖的进程,将BxPC-3细胞与由BxPC-shCtrl (PBS-Ctrl和Co-Ctrl)衍生的外泌体刺激的脂肪细胞条件培养基混合或转染pLent-ROR (PBSpLent- ROR和CopLent-ROR)的脂肪细胞皮下接种裸鼠(图7A)。用过表达的外泌体linc-ROR处理的去分化脂肪细胞在肿瘤内注射条件培养基(每周3次)可在不同时间点产生最大的肿瘤生长体积(图7B)。5周后,观察到BxPC-3细胞与CopLent-ROR混合产生的肿瘤结节比BxPC-3细胞单独(Co-Ctrl)或PBS-Ctrl混合产生的肿瘤结节更大(图7C)。PBS-Ctrl组和PBS-pLent-ROR组Ki-67蛋白表达显著低于Co-Ctrl组和CopLent-ROR组(图7D)。这些结果表明,TME中的外泌体linc-ROR诱导脂肪细胞脱分化,促进体内PC生长。同时,以往的外泌体表征研究表明,外泌体包裹的linc-ROR在膜的保护下具有更好的稳定性(图1G和1H),这是良好的生物标志物的必要前提。为了验证血清中外泌体linc-ROR的诊断性能,在同一验证队列中测量了它的表达(图7E)。此外,根据48例PC患者和48例健康个体的外泌体linc-ROR表达情况进行受试者-操作特征(ROC)曲线分析(图7F)。如预期,外泌体linc-ROR检测PC的ROC曲线下面积(AUC)为0.854。血清外泌体linc-ROR预测PC的最佳临界值为1.21086 (CRC与健康人相比的fold change),敏感性为72.92%,特异性为95.83%,提示外泌体linc-ROR是一种有前景的诊断PC的血清生物标志物。
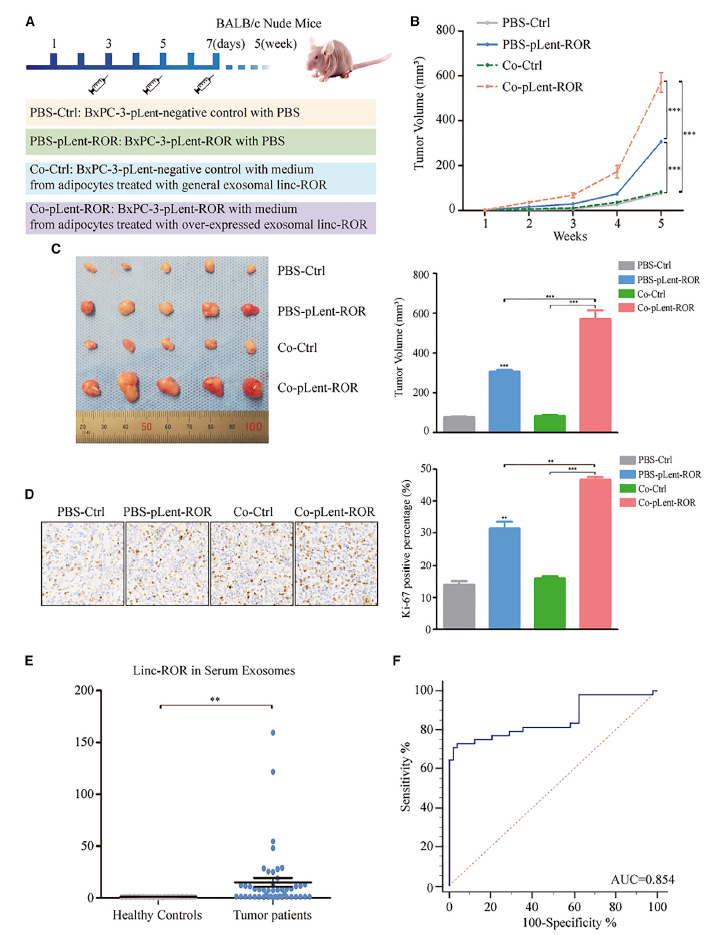
图7 外泌体linc-ROR介导的肿瘤微环境可促进PC细胞通过体内脂肪细胞的条件培养基生长
主要结论:
该研究结果表明,外泌体linc-ROR不仅作为PC的临床生物标志物,还介导了TME中PC细胞和脂肪细胞之间的串话。暴露于外泌体后,活化的脂肪细胞可能通过释放细胞因子IL-1b去分化为前脂肪细胞/成纤维细胞样细胞,IL-1b反过来通过HIF1α-ZEB1轴维持PC细胞的生长和转移(图8)。
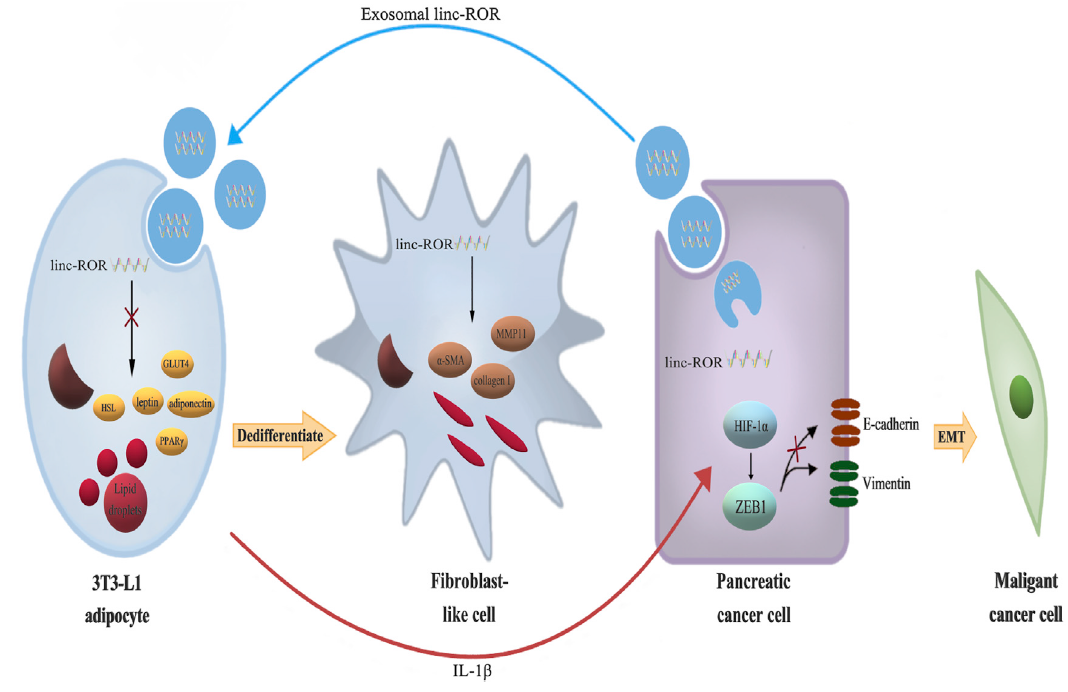
图8 PC细胞来源的外泌体linc-ROR诱导脂肪细胞去分化为前脂肪细胞/成纤维细胞样细胞,进而通过细胞因子IL-1b激活HIF1α-ZEB1信号通路维持PC细胞的生长和侵袭






