外泌体lncRNA构成调节环路驱动膀胱癌的淋巴结节转移
具有淋巴结(LN)的前列腺癌(BCa)患者的预后更差。BCa来源外泌体可作为循环生物活性载体以介导肿瘤微环境中的信号转导进而触发肿瘤转移。本研究揭示了一个新的机制,即外泌体BCYRN1协同增强VEGF-C/VEGFR3信号通路诱导LN转移。本文于2021年6月发表在《Clinical and Translational Medicine》 IF:11.492期刊上。
技术路线:

主要实验结果:
1、外泌体BCYRN1与BCa淋巴结转移相关
首先作者对患者的尿来源的外泌体进行高通量测序,发现255个lncRNA上调表达,然后分析外泌体lncRNA与VEGF-C/VEGFR3信号激活的相关性,发现BCYRN1,MAP4K3-DT和RP5-857K21.7与其显著正相关,扩大临床样本验证后发现只有BCYRN1在BCa患者尿液外泌体中高表达(图1A-1D)。FISH和亚细胞定位显示BCYRN1主要存在于细胞质中。此外,临床验证的结果显示BCYRN1在BCa组织的表达显著高于癌旁,在LN转移的肿瘤组织中表达水平显著高于无LN转移的,且其高表达与不良预后相关(图1G-1K)。免疫组化分析显示淋巴管内皮透明质酸受体1 (LYVE-1)阳性信号的结果显示,BCa组织瘤周和瘤内区域BCYRN1表达与微淋巴管密度呈正相关(图1M-1N)。以上说明外泌体BCYRN1促进BCa淋巴结转移并与不良预后相关。

图1外泌体BCYRN1过表达与BCa淋巴结转移相关
2、BCYRN1在BCa细胞分泌的外泌体中高表达
随后,在体外检测外泌体BCYRN1的表达模式,和体内结果一致,与对照组细胞相比,BCYRN1在BCa细胞分泌的外泌体中高表达。BCYRN1过表达和干扰实验的结果显示,过表达BCYRN1促进HLECs的淋巴管生成和迁移,干扰BCYRN1的表达则相反。表明外泌体BCYRN1促进体外BCa的恶性表型。
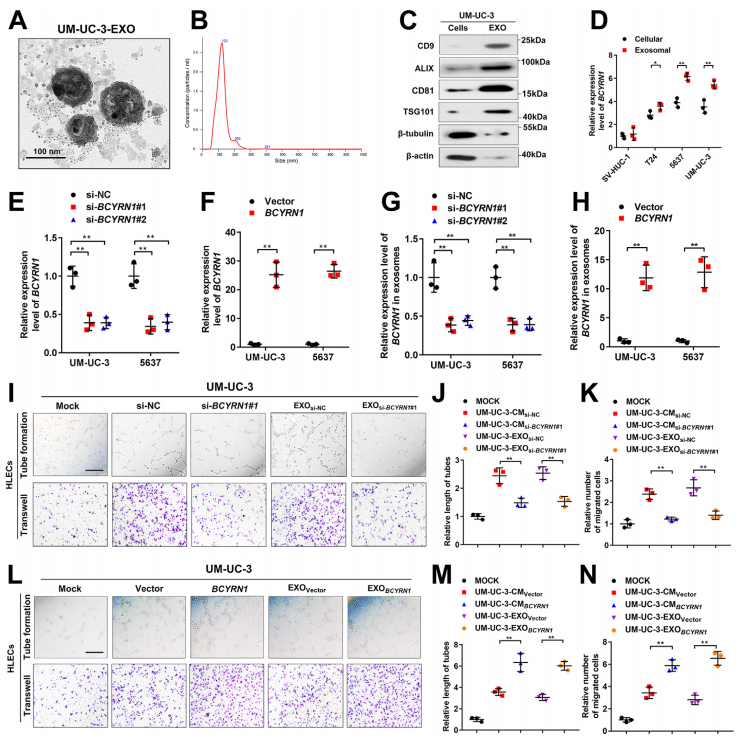
此外,体内实验显示,过表达外泌体BCYRN1显著增强原癌肿瘤的LN转移(图3B-3C),并且增大了LN的转移体积和比例(图3D-3G)。 提示,外泌体BCYRN1促进体内BCa的LN转移。

图3外泌体BCYRN1在体内增强BCa的LN转移
从lncRNA和蛋白相互作用的角度出发,作者使用pull-down实验鉴定了与BCYRN1相互作用的候选蛋白质(图4A-4C),然后使用WB证实BCYRN1与hnRNPA1之间存在相互作用(图4D-4E)。共聚焦实验表明两者存在共定位表达,RIP表明与对照相比,BCYRN1显著富集于hnRNPA1探针中,这进一步证实了两者的结合关系。序列敲除后的WB表明BCYRN1与hnRNPA1的结合依赖50–100-nt区域,如图4I所示区域。总之,BCYRN1通过50-100nt区域直接与hnRNPA1结合。
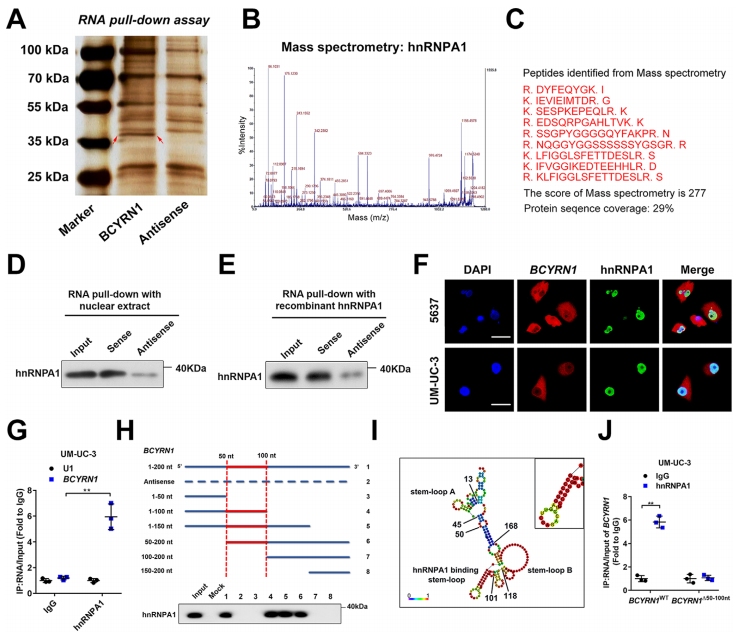
4、BCYRN1上调WNT5A的表达通过与其启动子形成DNA-RNA复合物
鉴于许多证据表明lncRNA广泛参与肿瘤进展的细胞内信号调节,所以作者检测了BCa细胞中过表达或沉默BCYRN1后终于信号相关基因的表达变化。结果显示WNT5A是最显著改变的基因,且其表达与BCYRN1表现出相关性(图5A)。荧光素酶实验显示包含有-500至-700bp的WNT5A启动子的片段可以显著增加BCYRN1过表达细胞的荧光素酶活性(图5B)。ChIRP实验显示BCYRN1直接与WNT5A启动子的-661至671bp区域结合。FRET实验显示与单链RNA/WNT5A TTS3对照组相比,在BCYRN1 TFO3/WNT5A TTS3组的信号强度在570-580nm出显著增强,在520nm处显著减弱(图5E-5G)。
作者此前的研究证实hnRNPA1诱导的H3K4me3在基因表达中发挥了重要作用,所以作者猜测BCYRN1是否通过增加hnrnpa1诱导的WNT5A启动子上的H3K4me3来介导WNT5A的转录激活。ChIP-qPCR证实了该猜想,BCYRN1沉默显著降低了WNT5A启动子中hnRNPA1和H3K4me3的富集程度,而BCYRN1过表达显著增加了BCa中hnRNPA1和H3K4me3在WNT5A启动子中的富集(图5H-5I)。因此,以上表明BCYRN1通过与WNT5A启动子结合,形成DNA-RNA结构,招募hnRNPA1增加其H3K4me3水平,激活WNT5A转录。
5、BCYRN1激活Wnt/β-catenin信号通路,促进VEGF-C的分泌
随后,作者发现沉默或过表达BCYRN1会相对应的抑制或激活Wnt/β-catenin信号通路,如图5J-5M所示,并且也会相对应的减少或增加VEGF-C分泌,如图5N-5Q。总之,BCYRN1能激活Wnt/β-catenin信号通路促进VEGF-C分泌。

图5 BCYRN1表观遗传学上调WNT5A表达,激活Wnt/β-catenin通路,促进BCa细胞VEGF-C分泌
6、外泌体BCYRN1被HLECs内化,促进BCa的淋巴管生成
研究发现外泌体BCYRN1可以被HLECs内化,过表达或沉默BCYRN1可以增加或减少受体HLECs中BCYRN1的表达(图6A-6F)。随后构建了BCYRN1敲除的HLECs细胞系,然后在敲除组和野生组过表达BCYRN1,结果发现无论敲除组还是对照组,过表达BCYRN1的外泌体处理都会显著增加细胞tube的长度,迁移数量,而敲除后沉默BCYRN1则相反(图6G-6L)。这些结果表明,外泌体BCYRN1可以被HLECs内化,进而促进BCa的淋巴管生成。
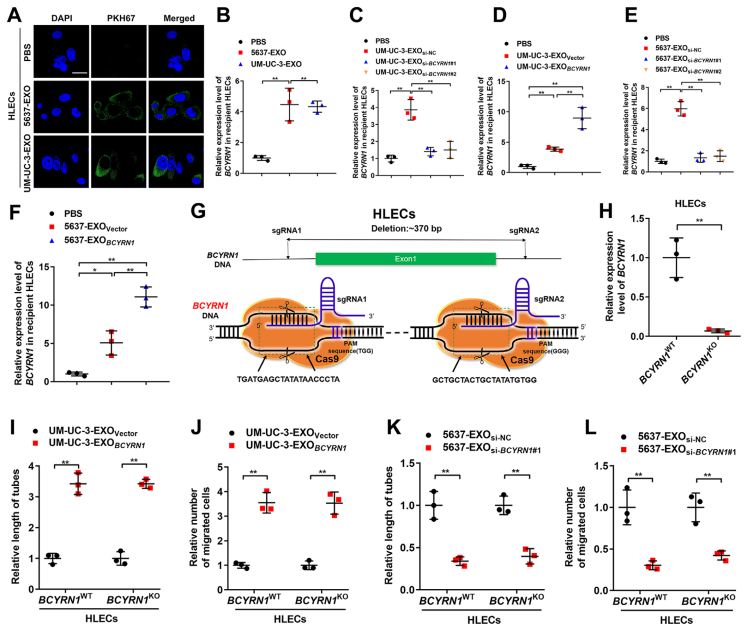
图6外泌体BCYRN1被传递到HLECs促进BCa的淋巴管生成
7、外泌体BCYRN1与hnRNPA1/WNT5A/VEGFR3调节轴形成前馈回路
用BCYRN1沉默外泌体孵育HLECs后,其VEGFR3的表达显著下降,过表达则相反(图7A-7D)。生物素化寡核苷酸的RNA下拉实验表明,外泌体BCYRN1与VEGFR3的3 -UTR直接相互作用,而诱导VEGFR3的3 -UTR的潜在结合位点突变,则削弱了其与外泌体BCYRN1的相互作用(图7F-7K)。由于与mRNA的3-UTR的相互作用是有助于细胞中的RNA稳定性的一个共同特征,作者进一步进行放线菌素D检测,揭示由BCYRN1沉默的BCa细胞分泌的外泌体显著缩短了VEGFR3 mRNA的半衰期,而过表达BCYRN1的BCa细胞的外泌体延长了VEGFR3 mRNA的半衰期(图7L-7O)。提示外泌体BCYRN1促进了HLECs中VEGFR3 mRNA的稳定性。预测的BCYRN1的二级结构如图7P所示,包含与VEGFR3的3’-UTR结合的一个茎环结构。突变该区域则显著废止了延长VEGFR3 mRNA的半衰期的能力(图7Q-7R)。总之,研究表明,外泌体BCYRN1通过与VEGFR3的3’ -UTR相互作用,促进VEGFR3 mRNA在HLECs中的稳定性,从而构成一个与hnRNPA1/WNT5A/VEGFR3调节轴相连的前反馈回路。
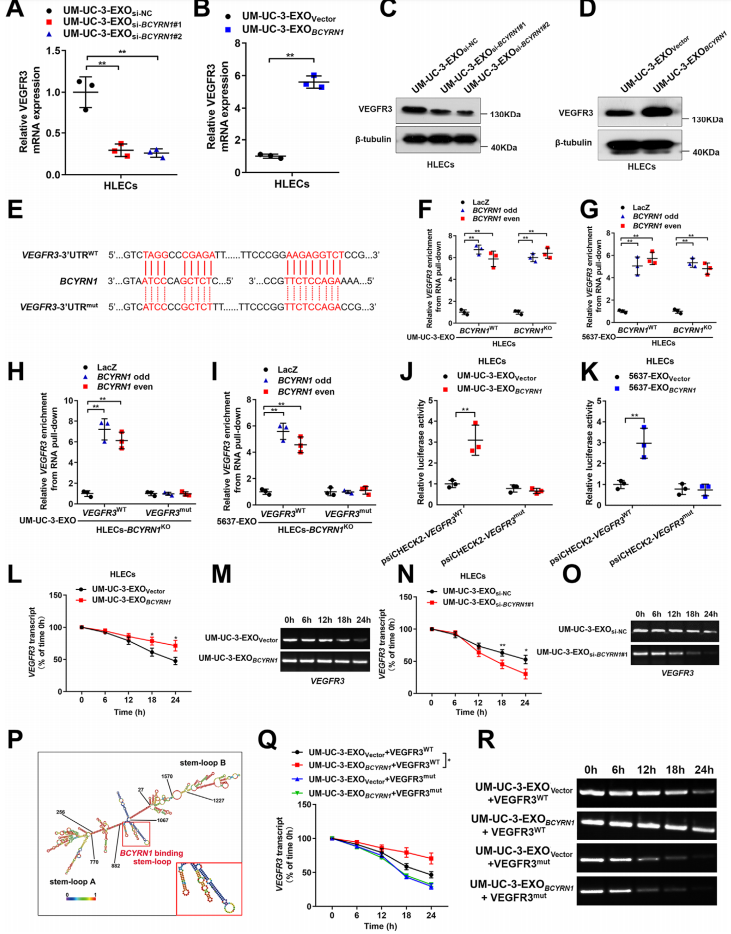
图7外泌体BCYRN1通过增强VEGFR3 mRNA在HLECs中的稳定性上调VEGFR3的表达
8、前馈环路诱导的VEGF-C/VEGFR3信号对于外泌体BCYRN1介导的LN转移至关重要
接下来,作者探讨了抑制前导环路诱导的VEGF-C/VEGFR3信号是否会减弱外泌体BCYRN1诱导BCa淋巴管生成和LN转移的促进作用。挽救实验结果如图8所示,与BCYRN1过表达BCa分泌外泌体孵育会促进HLECs的成管和迁移,但是这被沉默VEGFR3所废除(图8A)。此外,作者引入了阻断VEGFR3活性的抑制剂,SAR131675,结果发现,经SAR131675处理后,外泌体BCYRN1诱导的裸鼠淋巴结荧光强度增强明显受损(图8B)。WNT5A和VEGFR3的表达在上述各处理下的变化模式也和上述一致(图8C-8F),提示阻断VEGFR3可抑制外泌体BCYRN1介导的BCa体内淋巴管生成。此外,图8G-8I的结果表明,BCYRN1外泌体与BCa患者淋巴结转移显著相关。综上所述,这些发现表明前导环路诱导的VEGF-C/VEGFR3信号通路对于BCYRN1介导的BCa淋巴管生成和LN转移是必不可少的。
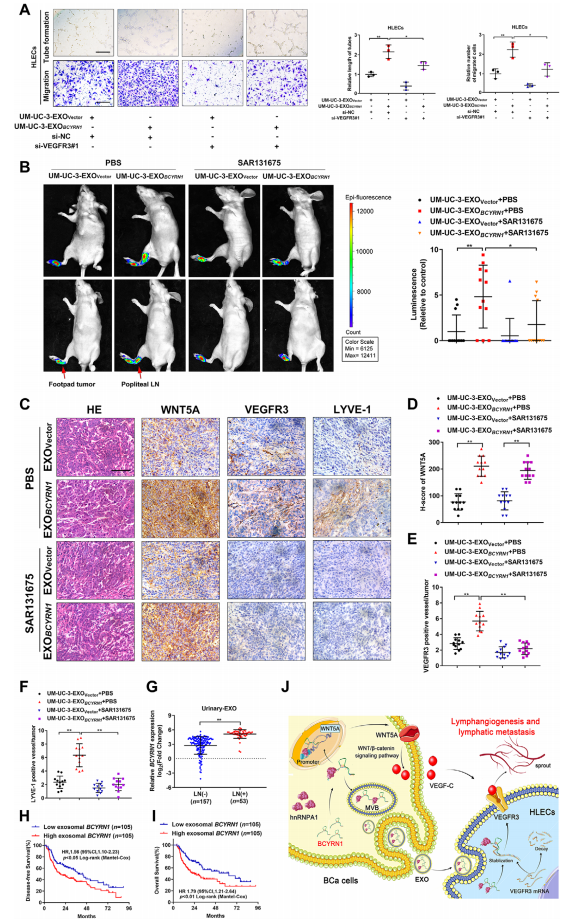
图8前馈环路诱导的VEGF-C/VEGFR3信号对于BCa的外泌体BCYRN1介导的LN转移至关重要
总之,如图8J所示,该研究结果强调了外泌体BCYRN1通过形成一个与hnRNPA1/WNT5A/VEGFR3调节轴相关的前反馈回路在BCa淋巴管生成和LN转移中的重要作用。外泌体BCYRN1通过VEGFC依赖方式介导BCa LN转移的分子机制,为外泌体lncRNA诱导肿瘤淋巴转移提供了新的思路。靶向外泌体BCYRN1阻断VEGF-C/VEGFR3信号的病理过度激活是一种很有前景的LN转移性BCa患者的临床干预手段。
参考文献:
Zheng Hanhao., Chen Changhao., Luo Yuming., Yu Min., He Wang., An Mingjie., Gao Bowen., Kong Yao., Ya Yiyao., Lin Yan., Li Yuting., Xie Keji., Huang Jian., Lin Tianxin.(2021). Tumor-derived exosomal BCYRN1 activates WNT5A/VEGF-C/VEGFR3 feedforward loop to drive lymphatic metastasis of bladder cancer. Clin Transl Med, 11(7), e497. doi:10.1002/ctm2.497






