Lnc-DC促进乳腺癌中雌激素独立生长和它莫西芬耐药

选择性雌激素受体调节剂(SERMs)如他莫昔芬已被证明对雌激素受体(ER)阳性乳腺癌有效。然而,这种内分泌治疗的主要障碍是雌激素独立生长,导致耐药性,其潜在机制尚不完全清楚。目前,有研究对长链非编码RNA (lncRNA)是否参与ER阳性乳腺癌中雌激素独立生长和他莫西芬耐药的调控进行了研究,该研究于2021年10月发表在《Cell Death & Disease》,IF:8.469。
主要技术路线:
主要研究结果:
1. Lnc-DC被鉴定为参与雌激素独立生长的潜在lncRNA;它的上调与乳腺癌患者的生存和他莫西芬反应有关。
作者首先对参与雌激素非依赖性生长的lncRNA进行功能筛选。使用图中概述的选择程序图1A,发现在雌激素剥夺28天后,用于载体控制的存活细胞很少,而用于SAM gRNA文库的存活细胞更多,这表明可以促进细胞在无E2培养基中存活的SAM gRNA被富集。由于雌激素非依赖性常常导致三苯氧胺抵抗,因此这个过程是否会影响这些细胞对三苯氧胺的反应。正如所料,选择后(As)细胞比选择前(BS)细胞对他莫昔芬更具耐药性(图1B)。与这些结果一致的是,TUNEL检测显示,AS细胞在三苯氧胺作用下的凋亡率(~8%)远低于BS细胞(~20%)(图1C)。接下来,将BS细胞或AS细胞注射到雌性裸鼠的乳腺脂肪垫中,以确定它们是否可以在不补充雌激素的情况下生长成肿瘤。正如预期的那样,添加E2(雌二醇颗粒)的亲代MCF-7导致100%的肿瘤发生率(图1D)。不含E2的BS细胞肿瘤率为17%;相比之下,不含E2的AS细胞肿瘤摄取率为35%(图1D),进一步表明lncRNA参与促进雌激素独立生长。为了确定哪些SAM gRNAs被这种选择富集,作者采用了两步方法。第一步是对该文库中的每个lncRNA进行qRT-PCR序列分析。第二步是利用gRNA特异性引物集,通过qRT-PCR检测SAM gRNA的相对丰度,重点检测雌激素剥夺后富集的SAM gRNA。lncRNA分析发现,与选择前(BS)相比,选择后(AS)有3个lncRNA (C1qTNF9B-AS1, Lnc-DC和MEG3)表达上调(图1E)。基于乳腺癌基因芯片数据库,发现Lnc-DC和MEG3都在数据库中。有趣的是,在1764例乳腺癌病例中,Lnc-DC上调与无复发生存期(RFS)较差相关,Logrank为4.6e-0.5, HR = 1.39(图1F)。高Lnc-DC水平与低RFS相关,Logrank为0.01,HR = 4.4(图1G)。该分析也支持了Lnc-DC水平高的患者对他莫昔芬反应较差的观点(图1H),提示了Lnc-DC的临床重要性。因此,我们进一步对Lnc-DC进行了表征,用于后续实验。
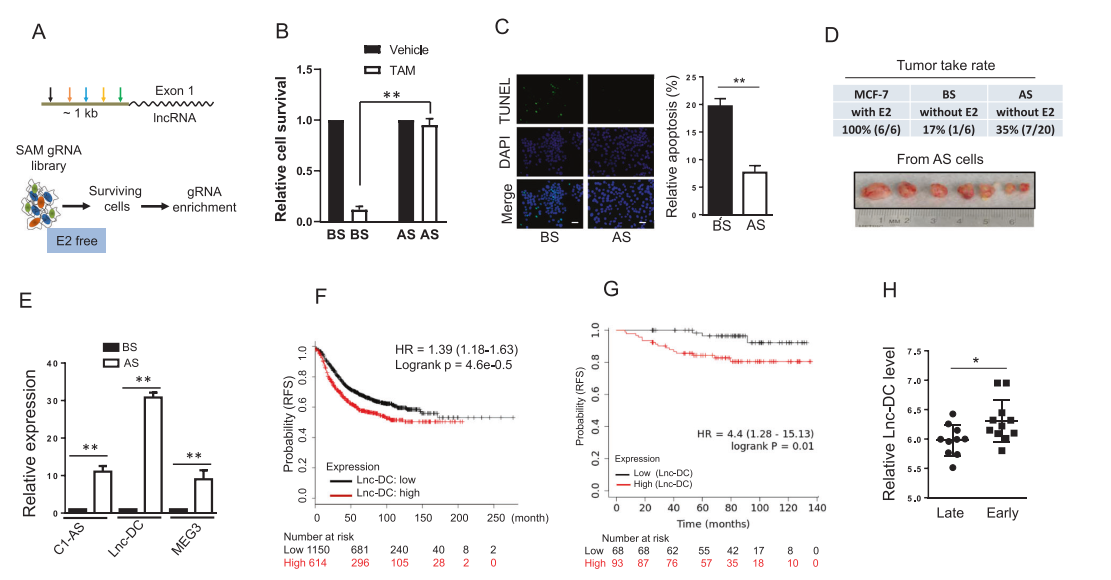
图1 Lnc-DC作为一种潜在的lncRNA参与雌激素独立和他莫西芬耐药。
2. Lnc-DC促进他莫昔芬耐药
为了证实Lnc-DC gRNA对上调Lnc-DC表达的作用,从gRNA区域和支架区域设计了引物来检测外源性的Lnc-DC gRNA水平。虽然该SAM文库中包含5种不同的Lnc-DC gRNA,但选择后只有Lnc-DC gRNA 1 (Lnc-DC1)高度富集(图2A)。另外,只有LncDC1能够激活内源性的Lnc-DC表达(图2B),这表明虽然不是所有的gRNA都能诱导内源性基因表达,但那些能够诱导内源性基因表达的gRNA可以通过雌激素剥夺等选择手段富集。接下来,作者确定了Lnc-DC对他莫昔芬耐药的贡献。用它莫西芬处理Lnc-DC1细胞和载体对照细胞。如图2C所示,Lnc-DC1细胞对他莫昔芬的抗性是载体对照细胞的3倍。同样,Lnc-DC1导致的凋亡率低于载体对照(图2D)。此外,Lnc-DC1细胞显示Bcl2和Bcl-xL水平升高(图2E),这可能是观察到的对他莫昔芬耐药的部分原因。Lnc-DC也降低了PARP和Caspase 3的裂解水平(图2F)。通过TUNEL实验可以明显看出,Lnc-DC KO细胞对他莫昔芬更敏感(图3A)。然后,作者选择了两个单一的Lnc-DC KO克隆,同时纳入了另一个ER阳性乳腺癌细胞系T47D(图S4)。菌落形成分析显示,在MCF-7细胞中,两个Lnc-DC KO克隆对他莫昔芬更敏感(图3B)。例如,MCF-7 Lnc-DC KO的IC50为11.6 (KO#17)和12.92 (KO#66),而病媒控制(IC50为21.3)。与载体对照相比,Lnc-DC KO T47D细胞对他莫昔芬也更敏感(图3C)。为了进一步确定Lnc-DC在他莫昔芬耐药中的作用,作者进行了抢救实验。在MCF-7和T47D细胞中,发现Lnc-DC KO增加了对他莫昔芬的敏感性;相比之下,在KO细胞中Lnc-DC的重新表达恢复了作为载体对照的他莫昔芬应答(图3D, E)。总之,这些结果支持了LncDC在他莫昔芬耐药中的作用。
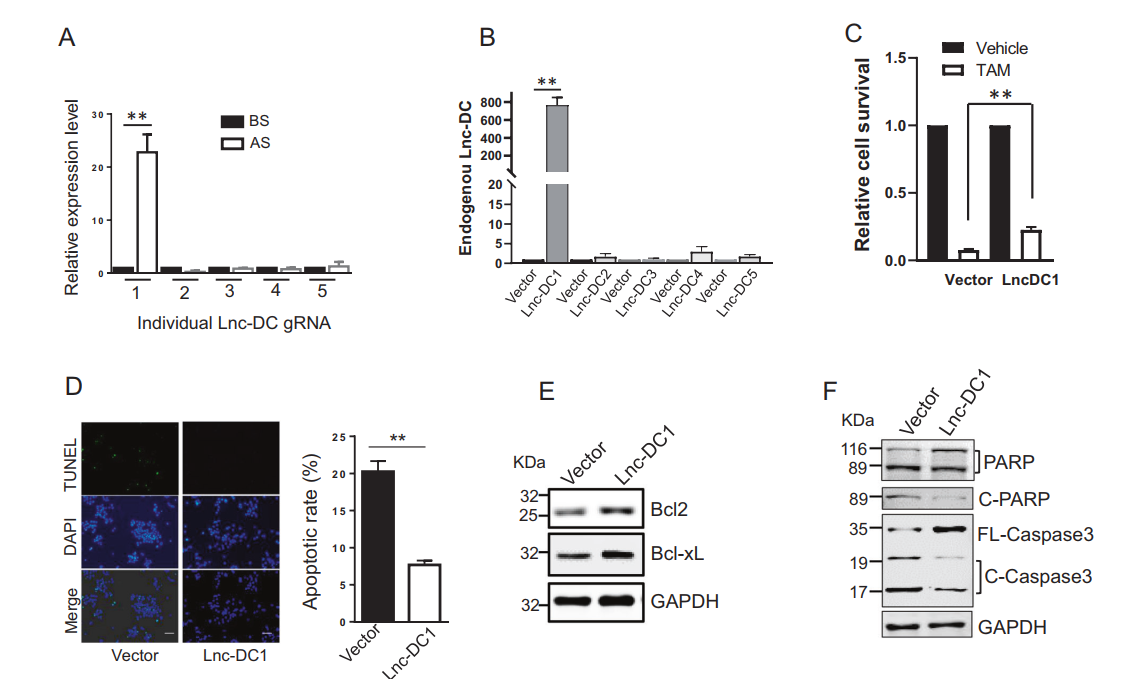
图2 Lnc-DC促进他莫昔芬耐药
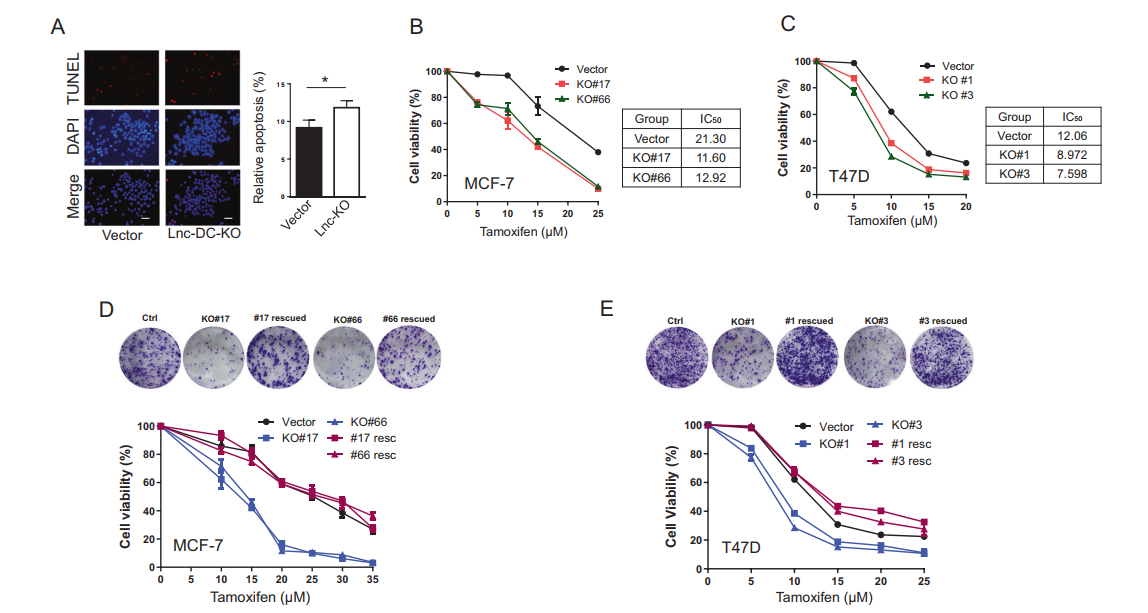
图3用Lnc-DC KO法和抢救法测定Lnc-DC介导的他莫昔芬耐药性。
3. Lnc-DC促进STAT3磷酸化
为了确定Lnc-DC如何促进他莫昔芬耐药,作者检测了这些细胞中STAT3的磷酸化。首先在选择前检测了携带SAM gRNA库的细胞中STAT3的磷酸化,发现载体细胞和库细胞之间没有差异(图4A)。然而,在选择后,库细胞比BS细胞显示更高水平的磷酸化STAT3(图4B)。为了确定Lnc-DC在STAT3激活中的作用,作者过表达了Lnc-DC,发现LncDC1能够增加pSTAT3Y705在正常和E2游离培养基中的水平(图4C)。此外,Lnc-DC KO导致pSTAT3Y705水平下降(图4D)。STAT3抗体RNA免疫沉淀实验证实Lnc-DC与STAT3相互作用(图4E)。此外,在S1m-LNC-DC沉淀中检测到一个STAT3带。这些结果有力地支持了Lnc-DC和STAT3之间的相互作用是特定的。为了确定Lnc-DC如何影响STAT3活性,作者发现雌激素剥夺降低了STAT3与SHP-1的相互作用(图4G), 而SHP-1是一种参与调控STAT3活性的磷酸酶。重要的是,Lnc-DC降低了SHP-1与STAT3之间的相互作用(图4H),这可能部分解释了当Lnc-DC水平升高时,STAT3活性升高的原因。
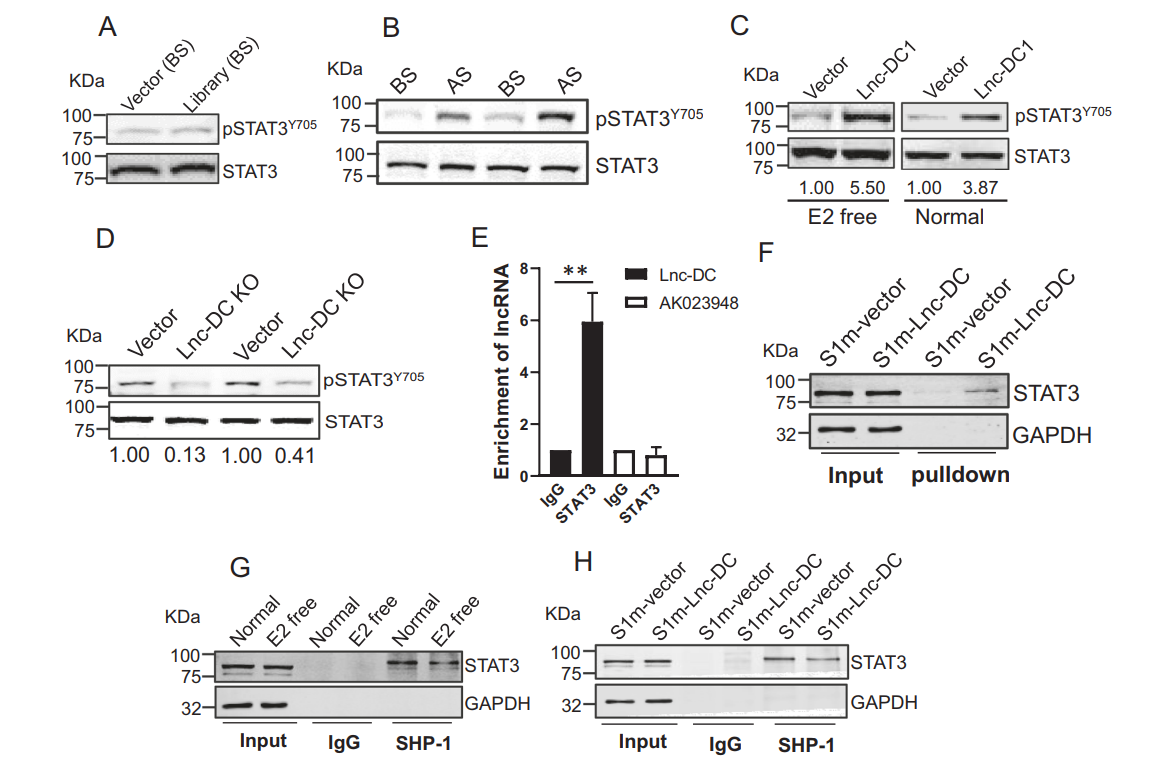
图4 Lnc-DC通过与STAT3相互作用促进STAT3活性
4. 他莫昔芬耐药AS细胞分泌的细胞因子激活STAT3
与载体对照相比,在AS细胞的条件培养基中观察到pSTAT3Y705的明显激活(图5A),表明细胞因子分泌到培养基中,能够激活相邻细胞的STAT3。为了确定从AS细胞培养中分泌的细胞因子,通过携带102种细胞因子抗体的细胞因子阵列从条件培养基中进行细胞因子分析。事实上,有一组11种细胞因子在AS细胞来源的培养基中比在载体对照细胞中更高(图5B)。qRT-PCR分析验证了其中5个(GDF15、IGFBP-2 PDFG-A、CXCL12和VEGF)(图5C为绿色),与载体对照相比,它们在AS细胞中也上调(图5D)。qRT-PCR分析显示,这5个细胞因子基因中有4个在STAT3 KD细胞中明显下调(图5E)。特别是GDF15的抑制最为明显。最后,与对照组相比,用GDF15、IGFBP-2和VEGF处理MCF-7细胞可增强pSTAT3Y705的磷酸化(图5F)。这些结果提示STAT3和细胞因子存在一个正反馈回路,它们共同促进他莫昔芬耐药。
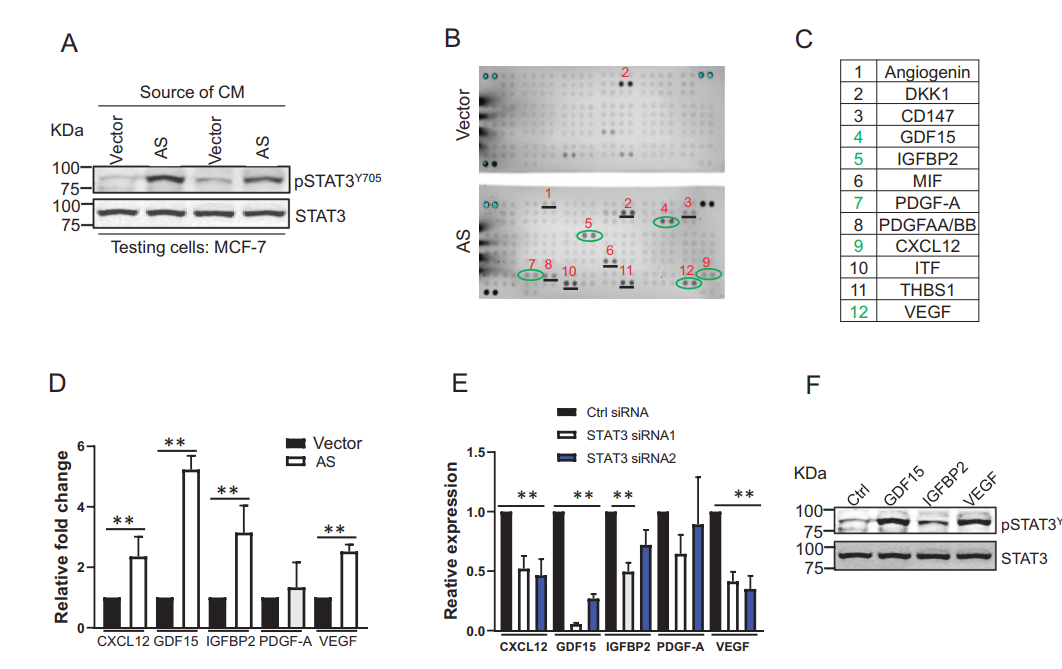
图5 STAT3介导的细胞因子的产生
5. Lnc-DC通过STAT3促进细胞因子的产生
通过qRT-PCR证实了Lnc-DC1细胞中三个细胞因子基因中的两个被转录激活(图6A)。还发现这两种细胞因子的蛋白质水平升高(图6B)。此外,在Lnc-DC细胞中通过siRNA下调STAT3,发现STAT3 KD能够抑制GDF15和IGFBP2(图6C)。此外,Lnc-DC KO下调GDF15 mRNA水平(图6D)和蛋白水平(图6E)。特别是, GDF15在GDF15转录起始位点上游约600 bp处携带一个典型的STAT3结合位点(图6F)。STAT3抗体ChIP分析证实STAT3与GDF15启动子相互作用(图6F)。针对GDF15启动子的PCR引物仅在STAT3抗体通道中检测到一条独特的PCR带,而IgG或Ku80抗体(阴性对照)通道中检测不到。总之,这些结果表明,在Lnc-DC起关键作用的地方存在STAT3-细胞因子循环。结果,这些细胞变得独立于雌激素,并对它莫西芬产生抗药性(图6G)。
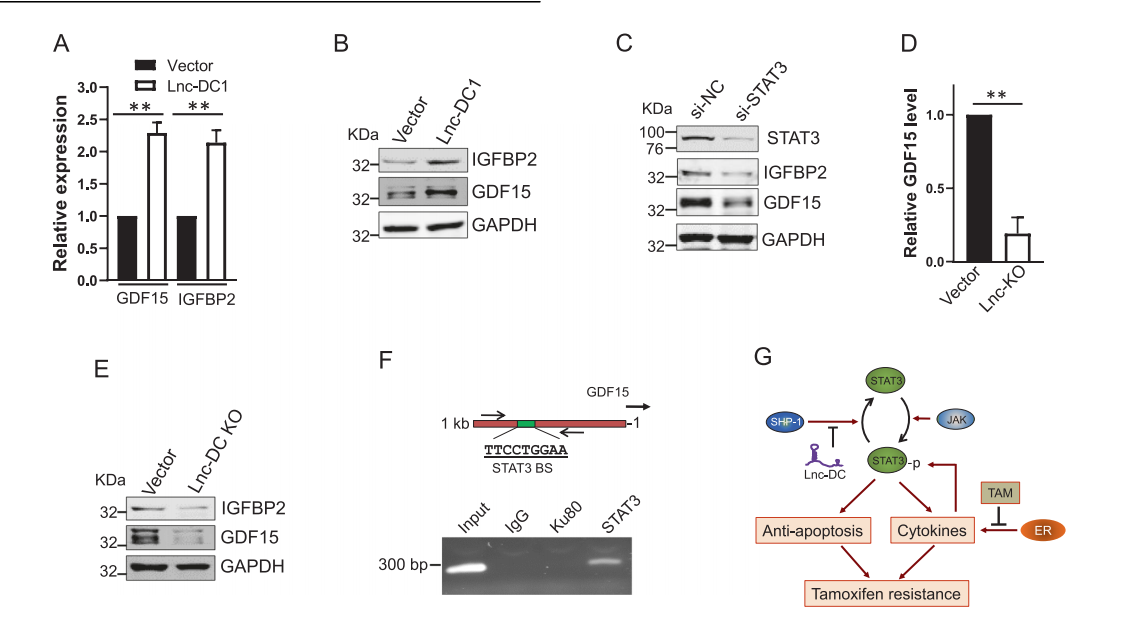
图6 Lnc-DC促进细胞因子基因的表达
主要结论:
综上所述,作者证明了Lnc-DC在STAT3细胞因子环路的调控中发挥了关键作用,导致雌激素独立和他莫西芬耐药。此外,临床数据挖掘表明,Lnc-DC可能作为预测他莫昔芬反应的潜在标志物。在这个调节系统中,JAK促进STAT3磷酸化,而SHP-1促进去磷酸化。Lnc-DC与STAT3的相互作用可能阻止SHP-1对pSTAT3的作用,保持较高的pSTAT3水平。STAT3已知能够上调抗凋亡基因,并刺激细胞因子的产生。由于CXCL12、IGFBP2和GDF15等细胞因子可同时受ER和STAT3调控,可以想象这些细胞因子除了抗凋亡基因外,可以在升高的Lnc-DC背景下持续产生,即使通过雌激素剥夺或三苯氧胺治疗等临床干预手段关闭内质网信号,这些肿瘤细胞仍能存活和生长。该研究为临床研究他莫昔芬耐药提供新的思路。






