长链非编码RNA lnc-LEMGC联合DNA-PKcs抑制胃癌转移

长链非编码RNA (lncRNA)在肿瘤的发生发展中发挥重要作用;然而,它们在胃癌转移中的作用仍然是未知的。目前有作者通过lncRNA芯片筛选,发现差异表达的lncRNA,并通过功能验证和调控机制研究,发现lnc-LEMGC通过直接抑制其结合蛋白DNA-PKcs的磷酸化和使DNA-PKcs下游EGFR信号失活而抑制胃癌转移。该研究于2021年10月发表在《Cancer Letters》,IF:8.679。
技术路线:
主要研究结果:
1. 分析转移性和非转移性胃癌组织之间的lncRNA差异表达谱
为了研究转移性胃癌中lncRNA的整体表达谱,作者进行了lncRNA微阵列分析,以比较5例有淋巴结转移(LNM)的胃癌病例和5例没有LNM的胃癌病例。分层聚类显示样本的非随机分配有两个分支,lncRNA表达的不同模式可能反映胃癌转移的分子机制(图1A)。与非转移性样本相比,转移性胃癌样本中有225个lncRNAs下调,228个lncRNAs上调(fold change≥2, P< 0.05,raw data >50)。
2. Lnc-LEMGC是胃癌转移相关的lncRNA
与无LNM的胃癌组织相比,有LNM的胃癌组织中有五种表达显著上调,其他五种表达显著下调(图1B)。为了验证微阵列分析结果,通过定量PCR(qPCR)证实uc001pqq.1过度表达,而在LNM胃癌组织中AK095500、AK021443和ENST0000398098的表达降低(图1C、D)。作者选择AK095500(lnc-LEMGC)进行进一步研究。在90例具有广泛临床病理参数的原发性胃肿瘤中测定了lnc-LEMGC的表达水平。在转移性胃癌组织中,Lnc-LEMGC表达下调10.7倍,因此,Lnc-LEMGC表达降低与胃癌转移潜能相关(图1E)。在胃细胞系中也检测了lnc-LEMGC的表达水平,表明lnc-LEMGC在高转移人胃癌细胞系SGC 7901中的表达逐步增加,然后是低转移细胞系AGS、KATOII、MKN45、MGC803、BGC823(图1F)。低lnc-LEMGC表达与LNM阳性(P<0.0001)、远处转移阳性(P=0.0032)和AJCC分期(P=0.0333)密切相关。此外,Kaplan-Meier分析显示lnc-LEMGC过表达与生存期更长有关(图1G)。单分子RNA荧光原位杂交显示lnc-LEMGC主要分布在细胞核中,核/细胞质分离证实了这一点(图1H和图I)。因此,低水平的lnc-LEMGC可作为胃癌患者肿瘤转移或预后较差的预测因子。
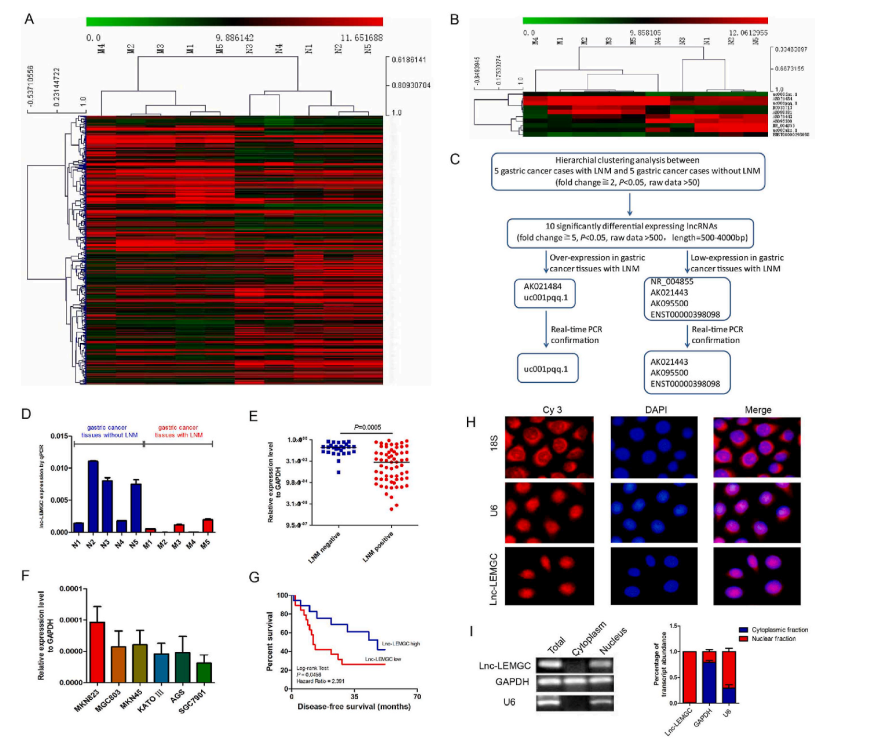
图1 鉴定与验证lnc-LEMGC作为抗胃癌转移的lncRNA
3. Lnc-LEMGC在体内外均抑制胃癌细胞的侵袭和转移能力
Lnc-LEMGC过表达明显抑制了癌细胞的迁移和侵袭活性(图2A)。在皮下移植模型中,肿瘤侵入高转移性SGC 7901异种移植物的肌肉组织,而lnc-LEMGC过表达组显示局部侵袭活性降低,并表现出良好的包封性。相反,肿瘤在低转移BGC 823异种移植物中包裹良好,而lnc-LEMGC抑制BGC 823组中的肿瘤细胞显示出多部位局部浸润(图2C,顶部)。在同质转移模型中,结果显示lnc-LEMGC的上调显著降低了肺转移定植的发生率。反过来,lnc-LEMGC的缺失显著增加了转移定植(图2C,中间)。在苏木精和伊红(H&E)染色切片中进一步评估肺转移(图2C,底部)。结果表明,lnc-LEMGC抑制胃癌细胞的局部侵袭和远处转移。
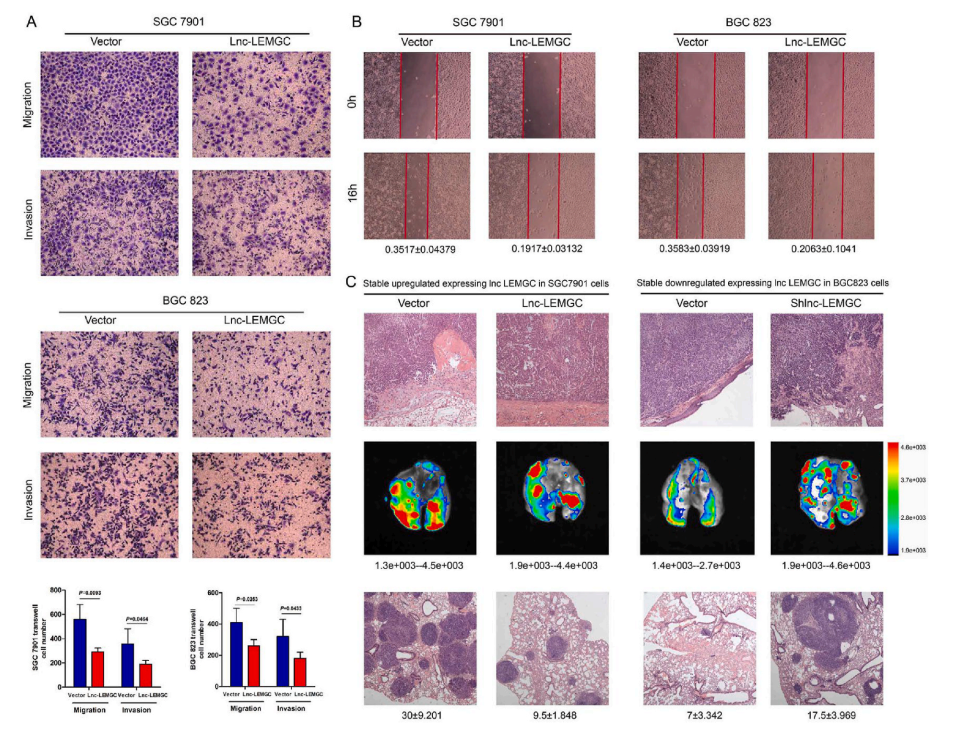
图2. Lnc-LEMGC在体内外均抑制胃癌细胞的迁移和侵袭能力
4. Lnc-LEMGC结合DNA依赖的蛋白激酶,催化亚基在抑制肿瘤转移中发挥作用
据报道,lncRNA与蛋白质相互作用,调节分子信号通路。因此,假设lnc-LEMGC可能以类似的方式运行。为了验证这一假设,合成了生物素化的lnc-LEMGC正义和反义链(图3A),并使用RNA-pull down鉴定了lnc-LEMGC结合蛋白。质谱分析显示,lnc-LEMGC-protein 复合物中含有6种蛋白,包括DNA依赖蛋白激酶、催化亚基(DNA-PKcs)、plectin、epiplakin、氨甲酰磷酸合成酶1 (CPS1)、vimentin和ATP5A(图3B)。根据以往的研究,DNA-PKcs和vimentin参与了肿瘤的进展,因此选择它们作为推测的lnc-LEMGC结合蛋白。将被RNA拉下的蛋白进行Western blot分析,检测lnc-LEMGC与DNA-PKcs蛋白的结合。但未观察到lnc-LEMGC和波形蛋白的联合作用(图3C)。 RIP试验表明,与对照IgG相比,抗DNA-PKcs的抗体可以富集lnc-LEMGC(图3D)。因此,lnc-LEMGC与DNA-PKcs直接结合。如上所述,过表达lnc-LEMGC的侵袭率降低,而siRNA介导的DNA-PKcs沉默阻断了这一作用(图3E-H)。这些结果表明lnc-LEMGC与DNA-PKcs联合调控细胞侵袭。其次,采用免疫组化方法分析83例石蜡包埋的原发性胃癌的DNA-PKcs表达与临床病理特征的关系(图3I)。DNA-PKcs蛋白主要在胃癌细胞核中表达。DNA-PKcs阳性表达为lnc-LEMGC抑制胃癌迁移和侵袭。
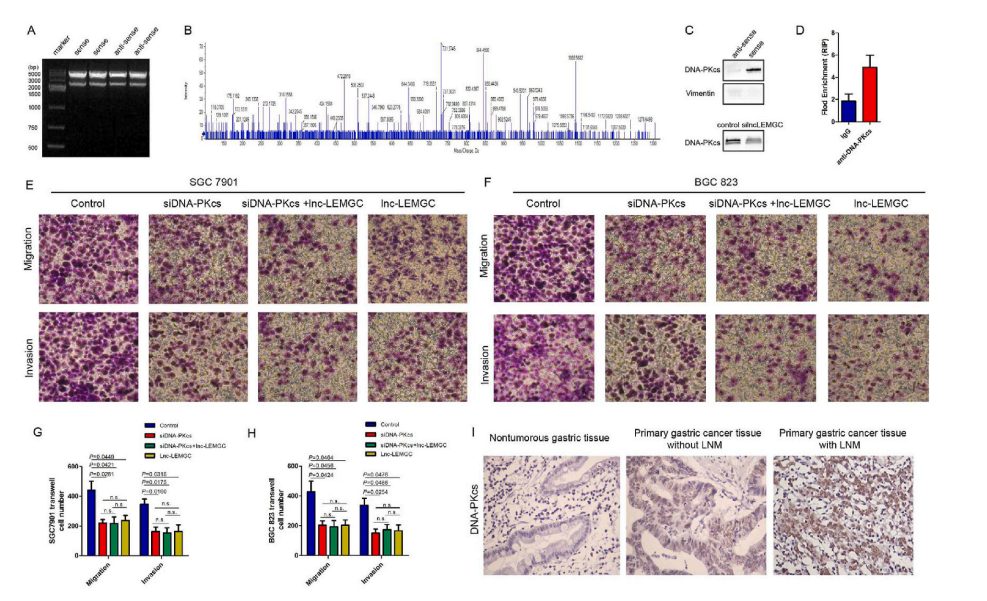
图3 Lnc-LEMGC与DNA-PKcs联合发挥抑制转移的作用
5. Lnc-LEMGC/DNA-PKcs复合物调控表皮生长因子受体信号
为了确定lnc-LEMGC/DNA-PKcs复合物在抑制肿瘤进展中的作用机制,作者在lnc-LEMGC表达的SGC7901细胞和阴性对照细胞之间进行转录组分析。与阴性对照组相比,lnc-LEMGC过表达的细胞中有1462个基因表达上调,1929个基因表达下调(图4A)。Lnc-LEMGC过表达显著抑制了转化生长因子α生长因子受体(EGFR, ErbB1)通路的mRNA表达(图4B)。在胃癌细胞中,qPCR进一步证实了基因芯片的结果。Lnc-LEMGC过表达组中TGFα、ErbB1、SRC和蛋白酪氨酸激酶2 (FAK)的mRNA表达被抑制(图4C)。此外,lnc-LEMGC的上调抑制了ErbB1、SRC、FAK和磷酸化FAK (p-FAK;图4 d)。此外,Lnc-LEMGC沉默后蛋白表达增加(图4E)。此外,当DNA-PKcs表达被沉默时,可以观察到下游基因ErbB1、SRC、FAK和p-FAK的蛋白表达降低(图4F和G)。这些数据提示lnc-LEMGC/DNA-PKcs复合物通过下调ErbB1、SRC、FAK和pFAK参与的EGFR通路抑制肿瘤转移。
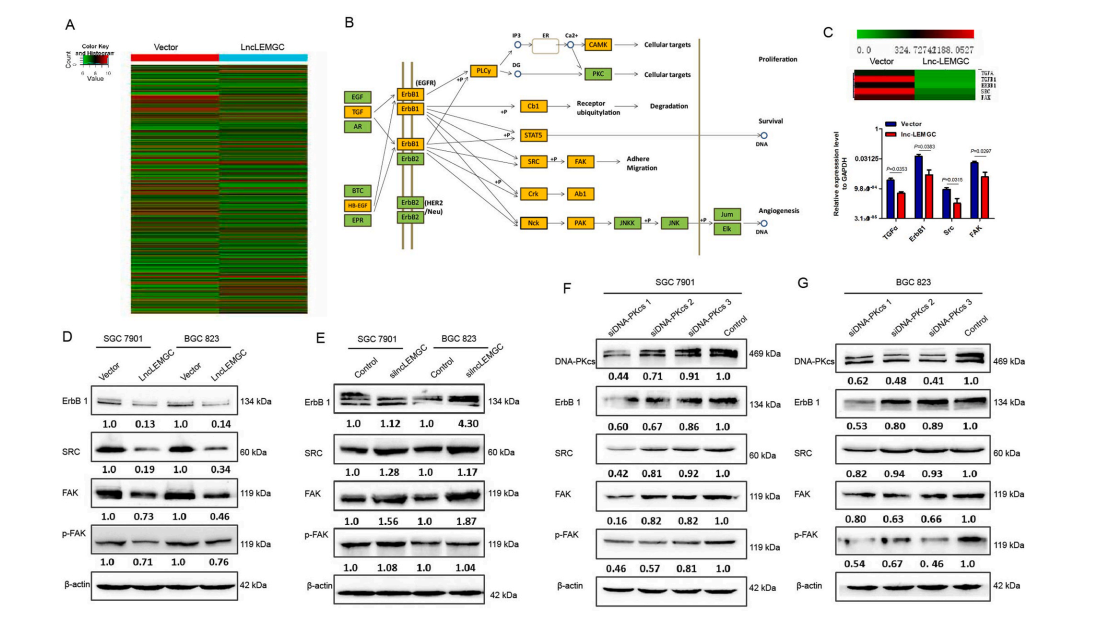
图4 Lnc-LEMGC/DNA-PKcs复合物调控ErbB信号通路。
6. lnc-LEMGC与DNA-PKcs结合抑制后者的磷酸化
为了探讨lnc-LEMGC对DNA-PKcs活性的影响,检测lnc-LEMGC对DNA-PKcs磷酸化的影响。异位lnc-LEMGC表达抑制了2056丝氨酸(S2056)上的DNA-PKcs磷酸化水平,但沉默lnc-LEMGC则增强了其磷酸化水平(图5A和B)。这些结果表明lnc-LEMGC表达与DNA-PKcs磷酸化呈负相关。利用lnc-LEMGC的3’端一系列缺失片段,确定lnc-LEMGC与DNA-PKcs相互作用的区域(图5C)。在RNA-pull down中,Lnc-LEMGC从其3’端缺失至1800 nt与DNA PKcs结合,并抑制DNA PKcs S2056磷酸化。然而,1300-1800 nt中lnc-LEMGC缺失则消除了这些效应(图5D),表明这些nt对于lnc-LEMGC与DNA-PKcs的相互作用至关重要,后者抑制DNA-PKcs磷酸化。通过ATM激酶抑制剂可以抑制DNA-PKcs激酶活性,减少DNA-PKcs S2056的磷酸化(图5E)。此外,当DNA-PKcs磷酸化被抑制时,ErbB1、SRC、FAK和p-FAK的表达水平降低(图5F)。ErbB1、SRC、FAK和p-FAK蛋白表达水平在全长组以及1300-1800 nt片段组均受到抑制(图5G和H)。这些结果表明,lnc-LEMGC 的1300-1800 nt通过抑制S2056磷酸化和灭活EGFR信号来抑制DNA-PKcs的激活。
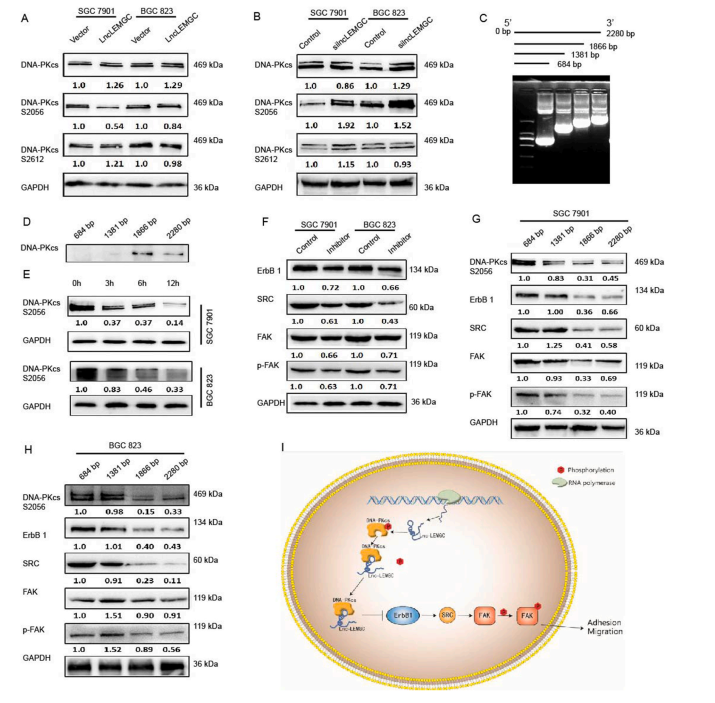
图5 lnc-LEMGC与DNA-PKcs结合抑制后者的磷酸化
主要结论:
在这项研究中,在有或没有LNM的胃癌组织中lncRNA表达存在显著差异。转移性胃癌组织中Lnc LEMGC显著降低,与胃癌患者的肿瘤转移呈负相关。Lnc-LEMGC的1300-1800 nt片段与DNA-PKcs协同抑制DNA-PKcs S2056磷酸化,并通过下调ErbB1-SRC-FAK信号通路抑制肿瘤转移(图5I)。因此,lnc-LEMGC是胃癌进展的关键调节因子。
参考文献:
Zhang H, Ma RR, Zhang G, et al. Long noncoding RNA lnc-LEMGC combines with DNA-PKcs to suppress gastric cancer metastasis. Cancer Lett. 2021; 524:82-90. doi: 10.1016/j.canlet.2021.09.042






