lncRNA ropm介导的脂质代谢控制乳腺癌干细胞的特性
乳腺癌细胞复发、远处转移、化学耐药性是乳腺癌患者死亡的主要原因。肿瘤干细胞( CSCs )被认为是肿瘤发生、发展、复发、转移和化疗耐药的“种子”。 lncRNAs通过调节细胞核中的核结构和转录,以及影响细胞质中mRNA的稳定性、翻译和翻译后修饰。本文提出lncROPM及其靶点PLA2G16能调节BCSCs,促进乳腺癌发展、复发和化疗耐药。本文于2021年10月发表在《Journal of hemetology and Oncology》,IF=11.059。
技术路线

主要结果:
1. 新型代谢相关的lncROPM在BCSCs中高表达
作者首先分离了乳腺癌干细胞(CD44+CD24−/low)和非乳腺癌干细胞(CD44−/lowCD24+),通过微阵列芯片分析LncRNA的表达谱,以Fold change > 2.0 ,p < 0.05为界限,在BCSC中筛选出349个上调及236个小下调的LncRNA(Fig. 1A),由于代谢重编程已成为肿瘤细胞的一个标志,作者从中筛选出23个代谢重编码相关的LncRNA,发现其中的一个lncRNA在BCSC中高表达,并参与磷脂代谢,将其命名为lncROPM(Fig. 1B)。接下来,在7个乳腺癌细胞系中,与Non-CSCs相比,LncROPM在BCSC中表达更显著(Fig. 1C)。通过原位杂交和亚细胞分离实验,发现LncROPM主要定位在细胞质上(Fig. 1D,E)
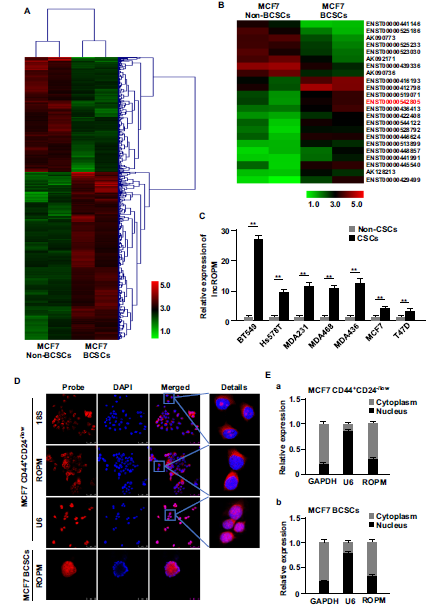
Fig1. 新型代谢相关的lncROPM在BCSCs中高表达
2. LncROPM在乳腺癌中起致癌作用,与乳腺肿瘤的临床特征及干性密切相关
作者进一步研究lncROPM在乳腺癌中的临床意义。发现lncROPM在死亡患者中的表达量高于存活患者(Fig. 2A),通过无病生存期和无进展生存期进行生存分析,发现高水平的LncRoPM往往与预后差相关(Fig. 2B,C),此外,lncROPM在乳腺癌三阴患者中的表达与无病生存率、无进展生存率也呈负相关(Fig. 2D,E)。与癌旁组织相比,乳腺癌组织中ROPM明显上调(Fig. 2E), 而ROPM的表达水平与肿瘤大小、肿瘤分期、组织分解、淋巴转移情况、复发情况也密切相关,病情越严重,ROPM表达越明显(Fig. 2G)。接下来作者研究了ROPM的表达量与干性标记物Sox2, Oct4之间的相关性,发现他们是成正相关(Fig. 2H,I)。lncROPM在非BCSCs和BCSCs中的表达,结果显示,与非BCSCs相比,lncROPM在BCSCs中的表达明显增加,尤其是在恶化程度高的乳腺癌干细胞中表达更显著(Fig. 2J),此外,相比于化疗敏感的肿瘤组织,化疗耐药的乳腺肿瘤组织中lncROPM显著升高(Fig. 2 K)。
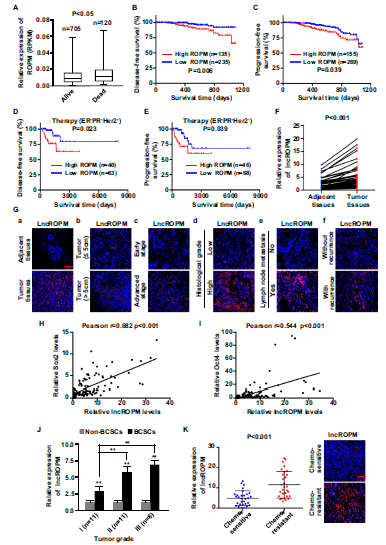
Fig2. LncROPM是一种与乳腺癌患者的临床特征及干性相关的致癌基因
3.LncROPM是维护BCSC所必需的
为了探讨lncROPM在BCSCs中的作用,作者在BCSCs中使用两种慢病毒介导的短发夹RNA (shRNAs)敲除了lncROPM(Fig. 3A),并且将异位lncROPM与携带慢病毒的lncROPM转染至非bcscs(Fig. 3B),在BCSC中敲除lncROPM之后,肿瘤明显变小,乳腺球形成率降低(Fig. 3C,D)。将异位lncROPM与携带慢病毒的lncROPM转染至non-BCSC之后,肿瘤明显变大,乳腺球形成率提高(Fig. 3E,F)。接下来,通过限制性稀释法检测lncROPM在体内外对肿瘤起始的影响,发现在乳腺癌干细胞中,lncROPM的缺失明显损害了体外和体内的肿瘤启动能力(Fig. 3G,H),而在非乳腺癌干细胞中,异位lncROPM启动肿瘤形成能力(Fig. 3I,J)。说明LncROPM是维护BCSC所必需的。
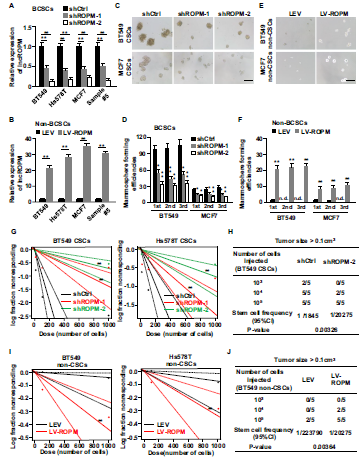
Fig3 LncROPM是维持BCSCs特性所必需的
4. PLA2G16是lncROPM的靶点,能促进乳腺癌的发展和化疗耐药
为了探讨lncROPM调控BCSCs特性的机制,通过生物信息学分析和qRT-PCR实验预测lncROPM的潜在靶基因,我们发现其邻近基因PLA2G16是lncROPM的潜在靶基因,下一步,为了进一步检测lncROPM是否会影响PLA2G16的表达,我们再不同的细胞系中进行了qRT-PCR和western blotting检测,发现在BCSC中敲除lncROPM之后明显抑制了PLA2G16及其蛋白的表达(Fig. 4A,C),而将异位lncROPM转染至non-BCSC之后,明显促进了PLA2G16及其蛋白的表达(Fig. 4B,D),通过相关性分析,发现lncROPM和PLA2G16在临床样本中表达呈正相关(Fig. 4E)。作者通过TNM分期、组织学分级、淋巴结转移、肿瘤复发情况与PLA2G16表达量,分析了PLA2G16表达水平与临床病理严重程度之间的关系,发现PLA2G16表达水平 与临床病理严重程度成正相关(Fig. 4F),此外,在耐药乳腺肿瘤组织中也观察到较高水平的PLA2G16(Fig. 4G)。通过对GEO数据库的分析,作者进一步发现,与对新辅治疗具有完全病理应答的乳腺癌组织相比,在对新辅助治疗具有部分应答的乳腺癌组织中,PLA2G16增强,这表明PLA2G16与乳腺癌患者预后不良和化疗耐药性密切相关(Fig. 4H)。说明了PLA2G16是lncROPM的靶点,能促进乳腺癌的发展和化疗耐药
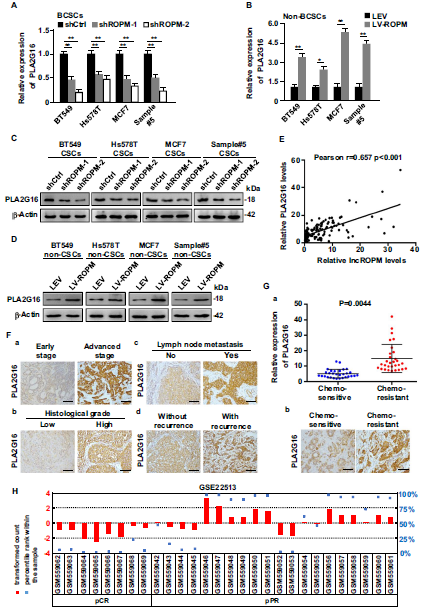
Fig4. PLA2G16是lncROPM的靶点,与乳腺癌的发展和化疗耐药有关
5. LncROPM通过增强PLA2G16 mRNA的稳定性来调控其表达
之前发现LncROPM 是定位在染色质上的,作者推测lncROPM可能在转录后水平影响PLA2G16的表达。为了验证这一假设,首先通过qRT-PCR分析检测了LncROPM缺失的BCSCs中PLA2G16 pre-mRNA和成熟mRNA的水平。结果表明,lncROPM的缺失使PLA2G16的CDS区,5‘-UTR,3‘-UTR水平明显降低,但3个内含子水平没有明显变化。说明 LncROPM参与PLA2G16转录后调控(Fig. 5A,B)。根据pull down实验发现lncROPM与PLA2G16 3‘-UTR结合(Fig. 5C)。接下来,作者将3‘-UTR分为两部分,即3‘-UTR-1和3‘-UTR-2,荧光素酶报告基因检测显示,lncROPM的下调或过表达显著降低或增强了3‘-UTR-1的活性,而不是3‘-UTR-2的活性,说明LncROPM是与3‘-UTR-1区域结合(Fig. 5E,F),构建了一套lncROPM片段质粒,分别与3 ‘-UTR-1质粒共转染,确定了与3 ‘-UTR-1结合的主要是lncROPM 1-100nt(Fig. 5G)。接下来,利用转录抑制剂放线菌素d检测了lncROPM对PLA2G16 mRNA稳定性的影响,发现lncROPM耗尽后PLA2G16 mRNA半衰期迅速降低(Fig. 5H, I)。说明LncROPM通过增强PLA2G16 mRNA的稳定性来调控其表达。
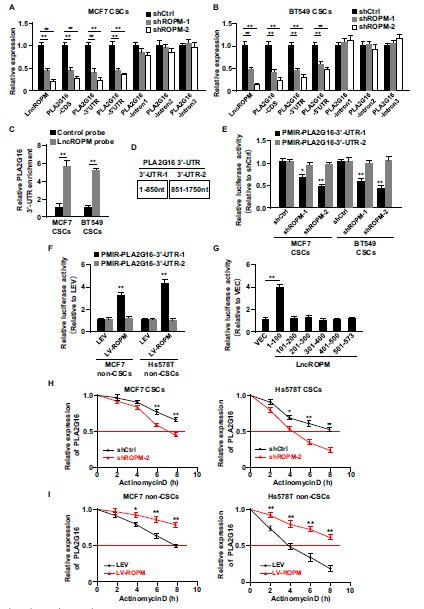
Fig5. LncROPM结合PLA2G16 mRNA的3'UTR,增强PLA2G16 mRNA的稳定性
6. PLA2G16对于lncROPM驱动的BCSCs特性至关重要
为了了解PLA2G16是否调控BCSC特性,首先通过qRT-PCR和western blotting检测,发现临床样品和不同的细胞系中,相较于Non-CSCs,PLA2G16及其蛋白的表达在BCSC中更显著(Fig. 6 ABC)。接下来,通过慢病毒构建2个稳定干扰的PLA2G16 乳腺癌细胞系,以及稳定的PLA2G16过表达的非乳腺癌细胞系。Giripladib是一种细胞质磷脂酶A2抑制剂,能抑制PLA2G16酶的活性,发现在BCSC中敲除PLA2G16或者使用Giripladib能显著降低连续传代过程中乳腺球形成效率(Fig 6D,F), 在non-BCSC中过表达PLA2G16能加速连续传代过程中乳腺球的形成效率(Fig 6E,G)。挽救实验发现,因ROPM缺失而造成的干细胞自我更新能力降低,乳腺球形成率降低 ,能通过异位的PLA2G16可以部分挽救(Fig 6H),在ROPM过表达的non-BCSC中干扰PLA2G16也能明显逆转(Fig 6 I)。说明PLA2G16对于lncROPM驱动的BCSCs特性至关重要。

Fig 6. PLA2G16是lncropm驱动BCSCs形成的关键
7.LncROPM通过PLA2G16 介导磷脂代谢调控促进BCSCs的干性
已有文献报道PLA2G16参与磷脂代谢过程,为了了解LncROPM是否通过诱导的磷脂代谢的改变而影响BCSC的特性,以及哪些代谢物起了关键作用,于是进行了脂质组学研究。发现在BCSC中 敲除LncROPM后,PLA2G16的两种代谢底物PC(磷脂酰胆碱)和PG(甘油磷酸甘油)显著增加,PLA2G16的两种代表性代谢物Cer(神经酰胺)和FFA(自由脂肪酸)显著降低。而在lncROPM沉默的BCSCs中,PC和PG显著降低,Cer(神经酰胺)和FFA(自由脂肪酸)显著升高(Fig. 7 A,B)。FFA因为变化最大作为研究对象, FFA前五个变化显著的代谢物中,花生四烯酸(AA)变化最显著(Fig. 7 C,D)。为了证实AA与PLA2G16密切相关,在PLA2G16敲除或giripladib处理的BCSCs以及PLA2G16过表达的非BCSCs中检测AA含量,发现AA受PLA2G16调控(Fig. 7E, F)。与此同时,与non-BCSCs相比,AA在BCSCs中显著富集(Fig. 7G)。
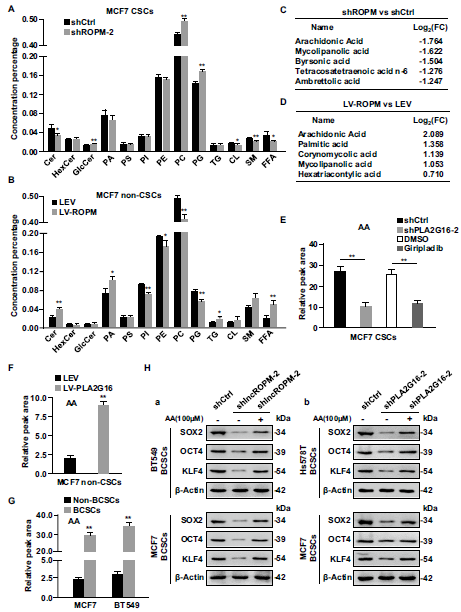
Fig 7. PLA2G16介导的磷脂代谢和代谢产物花生四烯酸(AA)参与了lncropm驱动的BCSCs维持
8. Giripladib联合化疗药物可有效清除BCSCs
为了进一步验证lncROPM和PLA2G16在乳腺癌耐药中的作用,我们研究了lncROPM和PLA2G16在化疗药物反应中对BCSCs生存的影响。我们的数据显示lncROPM或PLA2G16的敲低增加BCSCs对化疗药物的敏感性(Fig. 8A, B)。此外,lncROPM或PLA2G16在non-BCSC中的过表达降低了其对化疗药物的敏感性(Fig. 8C, D)。接下来发现与亲本相比,耐药的BCSCs中检测到和PLA2G16表达更明显,这些BCSCs具有较强的干性(Fig. 8E)。Giripladib联合药物一起使用,与单一用药物相比,能更有效地减少BCSCs数量,抑制乳腺球生成(Fig. 8F,G)。体内实验也发现联合使用能显著降低BCSC的致瘤性,抑制肿瘤生长(Fig. 8H,I)。此外,通过免疫组织化学 (IHC)染色,发现接受联合治疗的肿瘤中代表性BCSC蛋白之一的干细胞相关转录因子KLF4显著降低 (图8J)。
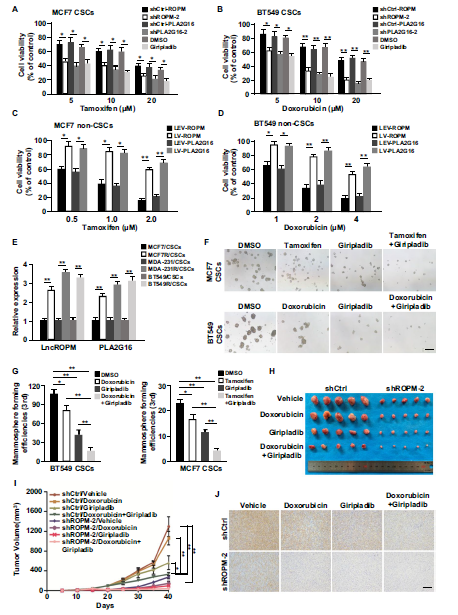
Fig 8. Giripladib联合临床治疗药物有效消除BCSCs
本文发现lncROPM, PLA2G16和花生四烯酸( AA )与BCSCs耐药有关,细胞质磷脂酶A2抑制剂Giripladib与化疗药物协同可通过抑制PLA2G16活性有效消除BCSCs。
参考文献:
1. Liu S, Sun Y, Hou Y, Yang L, Wan X, Qin Y, Liu Y, Wang R, Zhu P, Teng Y, Liu M. A novel lncRNA ROPM-mediated lipid metabolism governs breast cancer stem cell properties. J Hematol Oncol 2021; 14(1): 178.






