多发性骨髓瘤PRMT5通过沉默CASP1调节细胞焦亡
多发性骨髓瘤(MM)是一种恶性肿瘤,起源于骨髓中产生病理性抗体的浆细胞的广泛增殖,约占血液肿瘤的10%。目前,许多研究已经证明,MM患者具有相同的遗传特征;因此,MM被认为是遗传变异累积的结果。然而,MM的发展是一个复杂的病理过程,需要进一步研究。蛋白精氨酸甲基转移酶5(PRMT5)是一种参与多种血液恶性肿瘤肿瘤细胞进展的酶。有研究发现抑制PRMT5的活性增加了CASP1的表达,促进了MM细胞焦亡。PRMT5的高表达或CASP1的低表达与MM的总体生存率低相关。该研究2021年9月发表在《Cell Death and Disease》,IF: 8.469。
技术路线:

主要研究结果:
1. PRMT5在MM中过表达
作者对来自Oncomine数据库的7个MM数据集进行了生物信息学分析。与非癌组织相比,发现MM组织中PRMT5显著上调(P=0.020,图1A)。此外,结合MMRF CoMMpass(n=859)和基因型组织表达(GTEx)数据库(n=62)进行了生物信息学分析,表明PRMT5在MM组织中的表达高于非癌组织(P=0.00034,图1B)。通过分析MMRF CoMMpass数据库中787例MM患者的临床数据,发现高PRMT5表达与较差的无进展生存率相关(P=0.015,HR=1.472,图1C)。PCR结果同样发现MM样品中的PRMT5水平显著高于对照样品,而MGU样品中未观察到显著变化(图1D)。包括MGUS样本(GSE6477和GSE5900)在内的数据集显示,健康和MGUS患者之间PRMT5的表达没有差异。此外,通过使用蛋白质印迹分析,发现PRMT5蛋白在MM样本和MM细胞系中过度表达(图1E,F)。
图1 PRMT5在MM中过表达
2. PRMT5基因敲除触发MM细胞膜破裂和PI+/Annexin V+增加
设计干扰PRMT5表达的实验,通过western blotting和qRT-PCR验证(图2A,B),并且这些结果在两种细胞系中靶向PRMT5的免疫荧光也进一步证实(图2C)。通过流式细胞术证实,敲除PRMT5可增加NCI-H929和U266细胞的PI+数量,尤其是在PI+/Annexin V+结构域(图2D)。这种表型可能是指晚期凋亡或焦亡,两者都表现为细胞膜两极引起的PI染色。由于CASP3的激活是细胞凋亡执行途径的触发因素,作者分析了sh-PRMT5细胞和阴性对照细胞中裂解的CASP3的表达,但结果无显著性(图2E)。此外,TEM图像显示sh-PRMT5细胞具有细胞质肿胀和质膜破裂,这支持了细胞焦亡的形态学(图2F)。这些结果表明,PRMT5的敲除激活MM细胞系的焦亡。
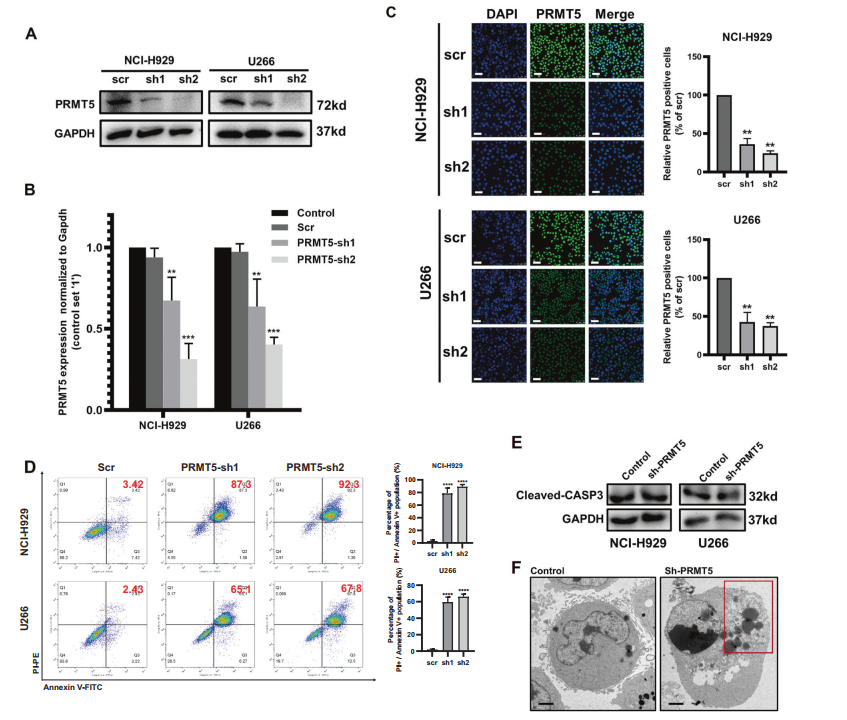
图2 PRMT5激活MM细胞系焦亡
3. PRMT5上调与CASP1呈负相关
使用Affymetrix Clariom S阵列芯片对三个NCI-H929细胞样本和三个PRMT5敲除(PRMT5 kd)NCI-H929细胞样本进行基因组阵列,以确定PRMT5在MM发病机制中的功能(图3A)。结果显示,NCI-H929和U266细胞中的CASP1均显著增加(图3B)。为了证实CASP1作为PRMT5的下游靶点,与阴性对照组相比,作者评估了转染PRMT5-shRNA-2后MM细胞系中CASP1和裂解的CASP1的蛋白表达水平。值得注意的是,PRMT5的敲除导致CASP1和裂解的CASP1显著升高,表明在MM细胞中,PRMT5使CASP1沉默(图3C)。此外,MM患者骨髓源浆细胞CASP1 mRNA表达显著降低,与PRMT5呈负相关(图3D, E)。
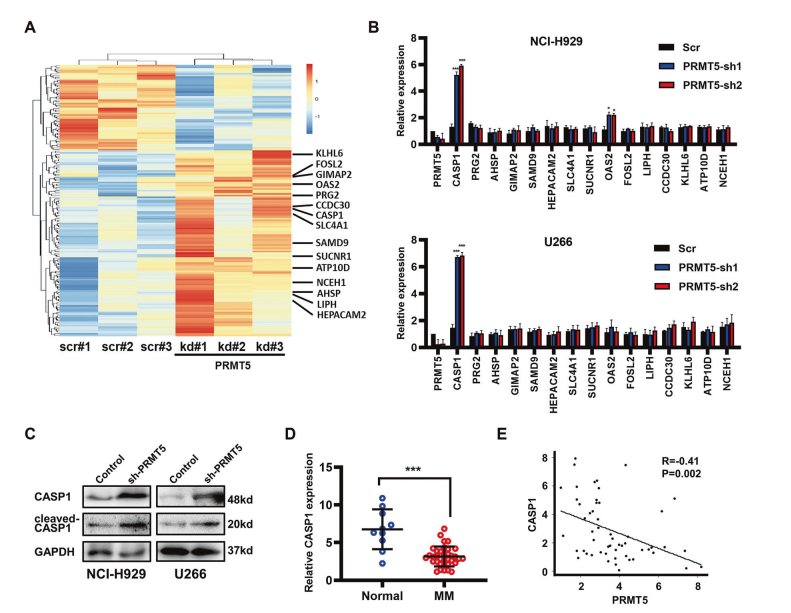
图3 PRMT5上调与CASP1呈负相关
4. 在MM细胞系中敲除CASP1可以挽救PRMT5缺失引起的焦亡现象
为了研究PRMT5是否通过抑制CASP1表达来调节细胞热下垂,在NCI-H929和U266细胞中瞬时过表达CASP1(图4A)。结果显示,CASP1过表达显著抑制了NCI-H929和U266细胞的细胞活力(补充图1B),并增加了PI+/Annexin V+细胞的数量(图4B)。结果表明,CASP1的过度表达增强了GSDMD的激活和白细胞介素-1β(IL-1b)和白细胞介素-18(IL-18)的分泌(图4C)。同样,在PRMT5缺失的细胞中,CASP1表达升高,激活了焦亡途径。然而,当PRMT5缺失细胞中的siRNA敲除CASP1时(图4D),焦亡途径的标记物显著下调,焦亡细胞的百分比显著降低(图4E,F)使用小鼠异种移植模型进行了体内实验,发现CASP1的敲除部分逆转了体内PRMT5缺失的NCI-H929细胞的增殖缺陷(图4G,H)。上述结果表明,PRMT5缺失引起的细胞焦亡通过敲除CASP1得以挽救。
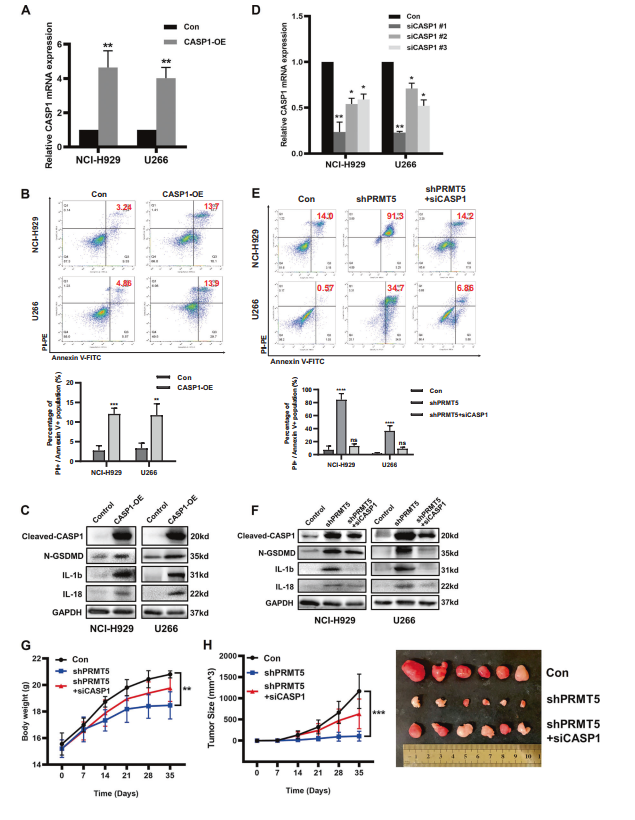
图4通过敲除CASP1挽救了PRMT5缺失引起的细胞焦亡
5. 使用PRMT5抑制剂GSK591处理可降低CASP1启动子H4R3me2s水平
检测PRMT5是否直接调控CASP1的表达,并通过ChIP检测和qRT-PCR分析了PRMT5介导的H4R3me2s在CASP1基因启动子周围的富集情况。结果表明,与对照组相比,在PRMT5缺失的NCI-H929和U266细胞中,CASP1启动子区域的H4R3me2s水平显著降低(图5A)。为了抑制CASP1基因启动子上的H4R3me2s,用PRMT5的特异性抑制剂-GSK591处理NCI-H929和U266细胞。用0、1、5和10μM GSK591(B6182,Apexbio)处理NCI-H929和U266细胞,以研究其生物学功能。结果发现,5μM GSK591处理显著触发NCIH929和U266细胞中PI+细胞比例的增加,表明膜破裂和继发性细胞死亡由热下垂引起(图5B)。接下来,作者检测了不同浓度GSK591处理的NCI-H929和U266细胞中CASP1的表达,以探讨抑制PRMT5的酶活性是否可以重新激活CASP1的表达。发现5μM GSK591增加了CASP1的表达(图5C)。这些结果表明,GSK591通过抑制PRMT5降低H4R3me2s水平,从而激活CASP1介导的细胞焦亡。
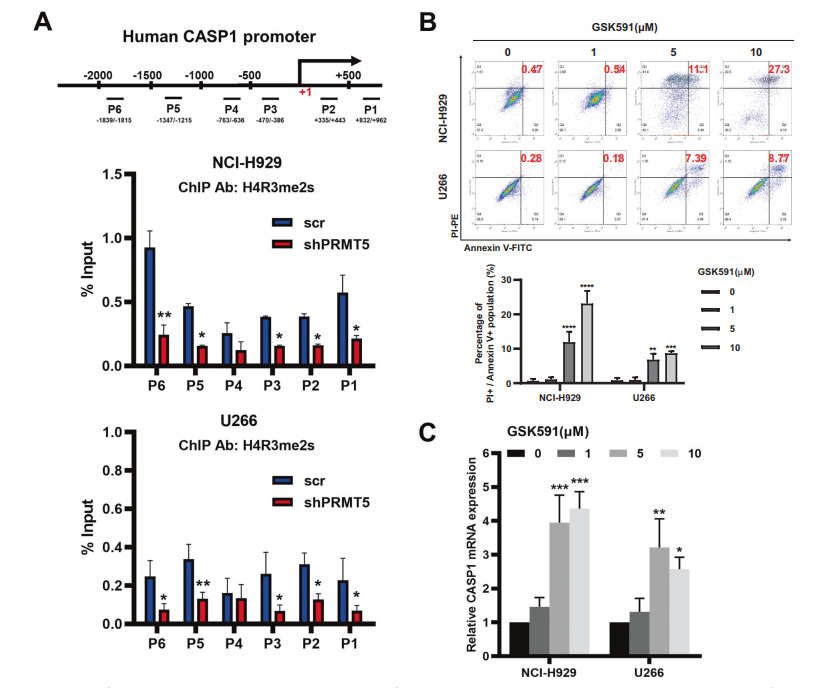
图5 PRMT5抑制剂GSK591处理后CASP1启动子H4R3me2s水平降低
6. PRMT5的高表达和CASP1的低表达与MM患者较差的临床预后相关
作者收集了108例新诊断的MM患者的临床资料,并通过免疫组织化学测定了PRMT5和CASP1的表达水平。MM患者的骨髓组织分为PRMT5高组和PRMT5低组(图6A),以及CASP1高组和CASP1低组(图6B)。在MM患者中观察到PRMT5表达与ISS分期之间存在显著相关性(表1)。此外,Kaplan-Meier曲线(图6C,D)表明,高PRMT5表达(P=0.022)和低CASP1表达(P=0.00063)与MM总体存活率低相关。合并这两种变体,发现与PRMT5高表达和CASP1低表达的患者相比,PRMT5低表达和CASP1高表达的患者的生存率显著降低(图6E,P=0.0037)。此外,单变量(P<0.001)和多变量(P=0.007)Cox比例风险回归分析均表明PRMT5上调是MM患者生存率低的独立预后风险因素(表2)。
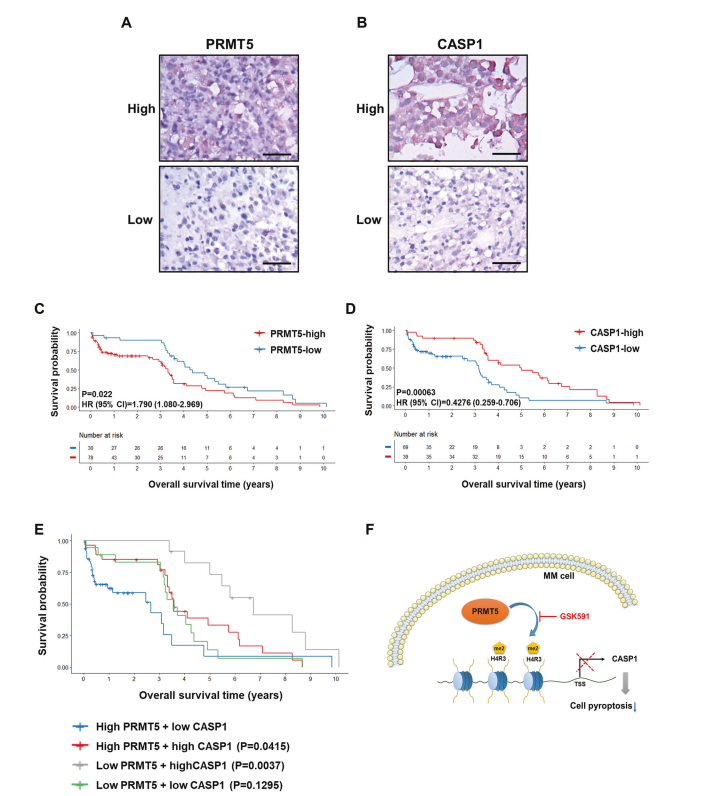
图6 在MM患者中,PRMT5的高表达和CASP1的低表达与较差的临床预后相关
表1 PRMT5表达与MM临床病理特征的关系
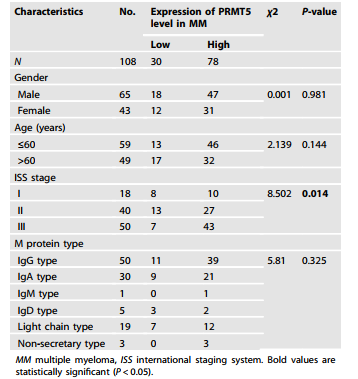
表2 MM患者生存的单因素和多因素临床病理特征分析

主要结论:
该研究结果表明,PRMT5通过沉默CASP1在MM中调节细胞焦亡,PRMT5抑制剂GSK591可能作为MM的潜在治疗药物。
参考文献:
Xia T, Liu M, Zhao Q, Ouyang J, Xu P, Chen B. PRMT5 regulates cell pyroptosis by silencing CASP1 in multiple myeloma. Cell Death Dis. 2021; 12(10):851.






