M6A RNA甲基化介导的RMRP稳定性通过调控TGFBR1/SMAD2/SMAD3通路实现非小细胞肺癌的增殖
非小细胞肺癌(NSCLC)在全球所有恶性肿瘤中死亡率最高。长链非编码 (lncRNAs)在癌症进展中的作用是当前研究的热点。鉴于RMRP对致瘤性的潜在调控作用,作者进一步研究RMRP在NSCLC中的的机制究。
技术路线:

主要结果:
1. RMRP可能是NSCLC的一种生物标志物
作者首先对癌症基因组图谱进行了综合分析,TCGA肺腺癌(LUAD)数据库分析显示,RMRP在NSCLC组织中的表达高于正常组织(Fig.1A)。RMRP高表达与T分期晚期和较差的生存率相关(Fig.1B,C)。此外,GSE43458数据库显示,与正常肺组织相比,RMRP在NSCLC组织中表达上调比较 (Fig.1D)。
共表达研究是探索基因潜在功能的一种途径。作者研究了TCGA数据库中与RMRP共同表达的mRNA(cor > 0.4, p < 0.01)。GO结果表明,RMRP在蛋白质异二聚活性、染色质DNA结合、苦味受体活性等方面发挥作用(Fig.1E)。KEGG结果显示,RMRP在酒精中毒、系统性红斑狼疮、病毒致癌、转录失调等通路中富集(Fig. 1F)。
然后进行KEGG研究的基因集富集分析(Gene Set Enrichment Analysis, GSEA)。RMRP在细胞周期、结直肠癌、蛋白出口、TGFB通路和泛素介导的蛋白水解通路中富集(Fig. 1G)。这些通路与肿瘤的发生和转移密切相关,提示RMRP可能在NSCLC中发挥重要作用。研究表明,RMRP不具有蛋白质编码潜力(Fig. 1H, I)。

Fig 1:NSCLC的综合分析表明lncRNA-RMRP是NSCLC患者潜在的分子标记物
2. m6A修饰在RMRP中富集,提高了RMRP转录本的稳定性
最近的初步研究报道,m6A的修饰广泛存在,它调控转录组,影响RNA的剪接、翻译、输出、定位和稳定性。为了探究RMRP的m6A修饰,首先使用在线生物信息学工具m6Avar (http://m6avar.renlab.org/)预测了位于RMRP中的m6A位点,并确定了两个RMRP m6A序列基序。
然后,在人正常肺上皮细胞(HBE)和两种非小细胞肺癌细胞系(A549和H1299)中进行甲基化RNA免疫沉淀(Me-RIP)检测。MeRIP-qPCR检测显示,HBE细胞系列中RMRP m6A甲基化水平低于NSCLC细胞(A549和H1299)(Fig 2A)。随后我们使用了小RNA干扰m6A甲基化酶复合物的核心组分METTL3,结果发现A549细胞系中m6A水平在总RNA和RMRP中均有降低了 (Fig 2,B, C, D)。在A549细胞中,用放线菌素D (5 μg/mL)阻断新RNA合成后,检测RMRP RNA的丢失。结果显示,下调METT3后,RMRP的RNA稳定性降低(Fig. 2E)。
此外,下调METT3后,miR-122或miR-206的表达增加,在A549细胞中过表达RMRP后,miR-122或miR-206的表达可被挽救。而METTL3过表达降低了H1299细胞中miR-122或miR-206的表达。以上结果提示,与肺正常上皮细胞相比,NSCLC细胞中RMRP的m6A水平上调,m6A的修饰可能提高了RMRP转录本的稳定性,这可能是NSCLC中RMRP显著上调的原因之一。

3. RMRP促进NSCLC细胞增殖
为了进一步探讨RMRP的作用,我们采用定量RT-PCR方法检测了RMRP在NSCLC细胞中的表达。RMRP在A549细胞中的表达明显高于H1299细胞系(Fig. 3A)。随后,作者在A549细胞系中通过两种不同的短发卡结构(shRMRP-1和shRMRP-2)转染实现RMRP干扰,同时将RMRP过表达质粒转染H1299细胞。通过定量验证转染效率(Fig.3B,C)。CCK-8和菌落形成实验表明,shRMRP转染的NSCLC细胞的生长和增殖受到明显抑制,而转染RMRP过表达质粒的NSCLC细胞的生长和增殖受到相反的影响(Fig. 3D–G)。

Fig 3 RMRP促进NSCLC细胞增殖
4. TGFBR1是RMRP促进增殖、入侵和迁移的关键靶点
TCGA数据库显示TGFBR1与RMRP的表达呈正相关(Fig 4A)。因此,作者假设RMRP可能针对TGFBR1。于是在A549或H1299细胞中敲低或过表达RMRP,TGFBR1的表达量随之变化(Fig. 4B, C)。
此外,在A549细胞系中敲低RMRP,TGFBR1表达降低,BAX/bcl - 2增加,而TGFBR1过表达则相反。在H1299细胞中,RMRP过表达后,TGFBR1的表达增加,BAX/Bcl-2的表达减少,而TGFBR1敲除后则相反(Fig. 4D)。
此外,作者进一步探讨TGFBR1参与RMRP促进NSCLC生长和增殖的机制。结果表明, shRMRP对非小细胞肺癌细胞生长和增殖的抑制作用通过TGFBR1过表达得到了缓解,而TGFBR1敲除后则发现相反的作用(Fig. 4E, F, H, J)。
接下来,我作者探讨了RMRP对侵袭、迁移和G1细胞周期进展的影响。创伤愈合、transwell和细胞周期检测表明,与对照组相比,转染shRMRP的NSCLC细胞的侵袭、迁移和G1细胞周期进展明显受到抑制,而在RMRP过表达细胞中观察到相反的作用。此外,shRMRP对NSCLC细胞侵袭、迁移和G1细胞周期进程的抑制在TGFBR1过表达后被挽救,而在TGFBR1敲除后观察到相反的作用(Fig. 4G, I, K, L, M, N)。这些结果表明,TGFBR1可能是RMRP促进增殖、入侵和迁移的关键靶点。

Fig 4 TGFBR1是RMRP促进增殖、入侵和迁移的关键靶点
5. RMRP与转录因子YBX1相互作用
为了进一步阐明RMRP的机制,作者在NSCLC细胞中进行了核和细胞质RNA的分离和荧光原位杂交(FISH)检测。结果表明,RMRP主要位于细胞质中(Fig 5A,B)。最近的一些报道发现,许多lncRNAs通过与DNA或蛋白质相互作用而发挥功能。作者使用catRAPID探索RMRP的调控作用。结果表明,YBX1是RMRP潜在的结合蛋白,在NSCLC中起重要作用(Fig 5C)。RIP检测结果显示,抗YBX1抗体显著富集RMRP(Fig 5D,E)。RNA下拉实验进一步证实了RMRP与YBX1之间的相互作用(Fig. 5F)。总之,YBX1与RMRP之间存在密切的相互作用。

Fig 5 RMRP与转录因子YBX1相关
6. RMRP通过将YBX1招募到TGFBR1启动子来促进TGFBR1的转录
接下来,通过研究TCGA-LUAD的ATAC-seq数据来确定TGFBR1可能的转录因子。该分析显示TGFBR1基因启动子区存在一个YBX1的潜在结合序列。对TCGA-LUAD数据库进行分析显示,YBX1的表达与TGFBR1呈正相关,与RMRP1无关(Fig. 6A–C)。因此,作者推测YBX1作为一个转录因子,可能被RMRP招募到TGFBR1启动子中。接下来,分别将SiYBX1、pcDNAYBX1及其对照 SiNC、Ctrl分别转染到细胞中,发现敲低YBX1会抑制TGFBR1的表达,而过表达YBX1促进了TGFBR1的表达(Fig. 6D)。
YBX1结合复合物显著富集TGFBR1启动子(Fig. 6E,F),在野生型TGFBR1 (TGFBR1- wt)的细胞中过表达YBX1增加了荧光素酶活性,而在表达突变型TGFBR1 (TGFBR1- mut)的细胞中没有增加荧光素酶活性(Fig. 6G,H)。RMRP的敲低降低了YBX1在 TGFBR1启动子上的富集,而这种作用通过共转染YBX1的 被逆转(Fig. 6I)。此外,RMRP还加强了结合能力(Fig. 6J)。荧光素酶实验进一步揭示了荧光素酶活性的变化是由于抑制或过表达RMRP引起的(Fig.6K.L)。

Fig 6 RMRP通过将YBX1招募到TGFBR1启动子来促进TGFBR1的转录
7. RMRP调控TGFBR1/SMAD2/ SMAD3通路
Western blot和免疫荧光分析显示,在非小细胞肺癌细胞中,RMRP基因敲除显著抑制了p-SMAD2/3的核转运和表达(Fig7A,B)。为进一步探讨RMRP是否可以通过调控TGFBR1转录外的其他方式影响TGFB信号传导,作者在NSCLC细胞中TGFBR1进行敲低处理,Western blot结果显示,RMRP的改变对siTGFBR1组中p-SMAD2和p-SMAD3的表达水平没有影响,说明TGFBR1在激活SMAD2/SMAD3信号通路中是不可或缺的(Fig. 7C)。TGFB通路通常与CSC特性和EMT相关。因此,作者探讨了RMRP是否促进了NSCLC中CSC的性质。通过qRT-PCR检测CSC相关基因(KLF4,SOX2、NANOG、CD133、ALDH)的表达,发现在A549细胞中,RMRP敲低后这些基因的表达都降低了。而在H1299细胞中过表达RMRP后,这些基因表达上调(Fig. 7D)。
此外,作者还探索了这些细胞中的EMT相关基因。结果显示,RMRP敲除增加了E-钙粘蛋白的表达,降低了N-钙黏蛋白和波形蛋白的表达 (Fig. 7A)。此外,我们还研究了这些细胞的成球能力。结果表明,敲低RMRP的表达降低了成球能力,而过表达RMRP增加了这种能力(Fig. 7E)。
此外,RMRP抑制增加了A549细胞对顺铂和放疗的敏感性(Fig. 7F,G)。这些数据表明,RMRP通过增强CSC的自我更新和EMT促进NSCLC的进展。

Fig 7 RMRP调控NSCLC中TGFBR1/SMAD2/ SMAD3通路
8. RMRP的下调限制了体内肿瘤的生长
为了进一步证实RMRP在体内促进肿瘤生长,将A549-shRMRP细胞和a549 - scramble细胞注射到裸鼠体内。30天后,shRMRP组肿瘤明显变小(Fig. 8A、B),在shRMRP中,肿瘤体积和重量明显降低(Fig. 8C, D)。此外,A549 -Scrambled组中Ki-67、MMP9和TGFBR1的表达量较高(Fig. 8E)。
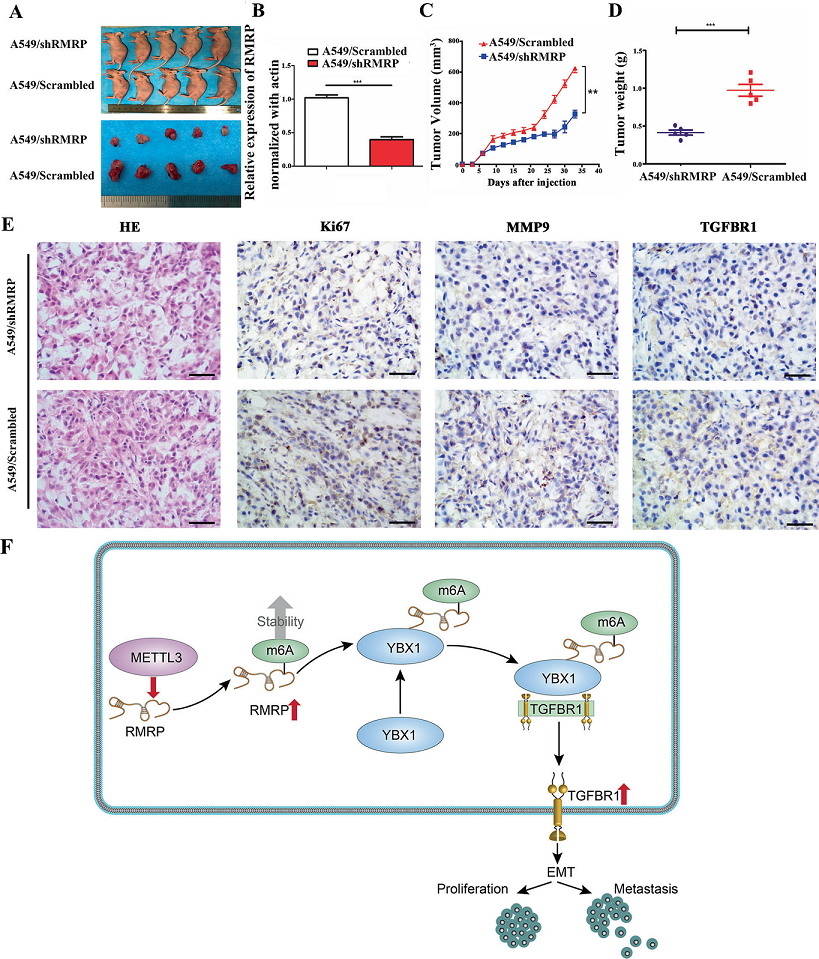
Fig8 RMRP的下调限制了体内肿瘤的生长
本研究中,作者发现研究表明,m6A RNA甲基化介导的RMRP的稳定性通过调控TGFBR1 / SMAD2 / SMAD3通路实现了NSCLC的增殖和进展。
参考文献:
Yin, H., et al., M6A RNA methylation-mediated RMRP stability renders proliferation and progression of non-small cell lung cancer through regulating TGFBR1/SMAD2/SMAD3 pathway. Cell Death Differ, 2021.






