凋亡细胞外囊泡通过恢复Fas介导的凋亡改善多发性骨髓瘤
细胞凋亡是维持机体内环境稳定的关键,并产生大量凋亡细胞外小泡(apoEV)。几种类型的癌细胞表面由于Fas表达减少,因此能够逃避Fas配体诱导的凋亡。然而,正常细胞来源的载脂蛋白EV是否能调节肿瘤生长尚不清楚。目前,有研究确定了apoEV在诱导多发性骨髓瘤(MM)凋亡中的作用,并提示了apoEV治疗MM的潜力,该研究发表于2012年9月发表在《ACS NANO》,IF:15.881。
技术路线:

主要研究结果:
1. ApoEVs抑制多发性骨髓瘤进展
作者前期先分离与表征MSC衍生apoEVs。然后为了在体内测试MSC来源的apoEVs对MM的影响,作者通过尾静脉将5TGM1骨髓瘤细胞输注到NOD/SCID小鼠中,生成一个具有侵袭性的同基因MM小鼠模型(图1A)。另外还发现apoEVs显著延长MM小鼠的寿命、抑制肿瘤生长(图1B-D)。免疫荧光染色和流式细胞分析进一步证实,与对照组相比,MM小鼠股骨骨髓中CD138+浆细胞和CD45+CD19 CD138+骨髓瘤细胞数量增加,ApoEVs显著抑制MM小鼠病理浸润的骨髓瘤细胞(图1E,F)。ELISA分析显示,apoEV治疗显著降低MM小鼠升高的IgG2b水平(图1G)。MicroCT和组织学分析显示,5TGM1细胞接种后25天,骨小梁骨密度(BMD)和骨小梁体积分数下降,ApoEVs输注显著恢复MM小鼠的骨密度和BV/TV(图1H,I)。此外,组织学分析显示MM小鼠表现出严重的急性肾损伤,而apoEV治疗显著挽救了肾损伤(图1J)。

图1间充质干细胞来源的apoEVs抑制MM细胞生长
2. ApoEVs利用FasL诱导多发性骨髓瘤细胞细胞凋亡
ApoEV在体外治疗后6、24和48 h以剂量依赖性的方式诱导5TGM1细胞死亡(图2A)。此外,流式细胞仪分析显示,apoEV处理提高了Annexin v阳性的凋亡5TGM1细胞数量,并呈剂量依赖性(图2B)。通过TUNEL染色和Western blotting检测,ApoEV处理显著诱导5TGM1细胞凋亡,上调cleaved caspase-3和cleaved caspase-8的表达(图2C,D)。ApoEV处理显著增加了股骨中cleaved caspase-3和CD138双阳性凋亡骨髓瘤细胞的数量(图2E)。ApoEV轻微提高了5TGM1细胞FasL和Fas的表达,而apoEVs显著提高了5TGM1细胞FasL相关死亡域蛋白的表达,降低了抗凋亡蛋白的表达水平(图2F)。与MSCs和5TGM1细胞相比,MSC来源的apoEV显示FasL和Fas的表达升高(图2G)。FaslprMSC-衍生的 Fas-deficient apoEV能够诱导5TGM1细胞凋亡(图2H,I)。为使用Fasl小干扰RNA (siRNA)产生Fasl-depletion apoEVs,通过流式细胞分析评估发现,它们未能诱导5TGM1细胞凋亡(图2J)。挽救Fasl表达可恢复Faslmut - apoEV诱导5TGM1细胞凋亡的能力(图2K),提示Fasl是apoev诱导骨髓瘤细胞凋亡所必需的。
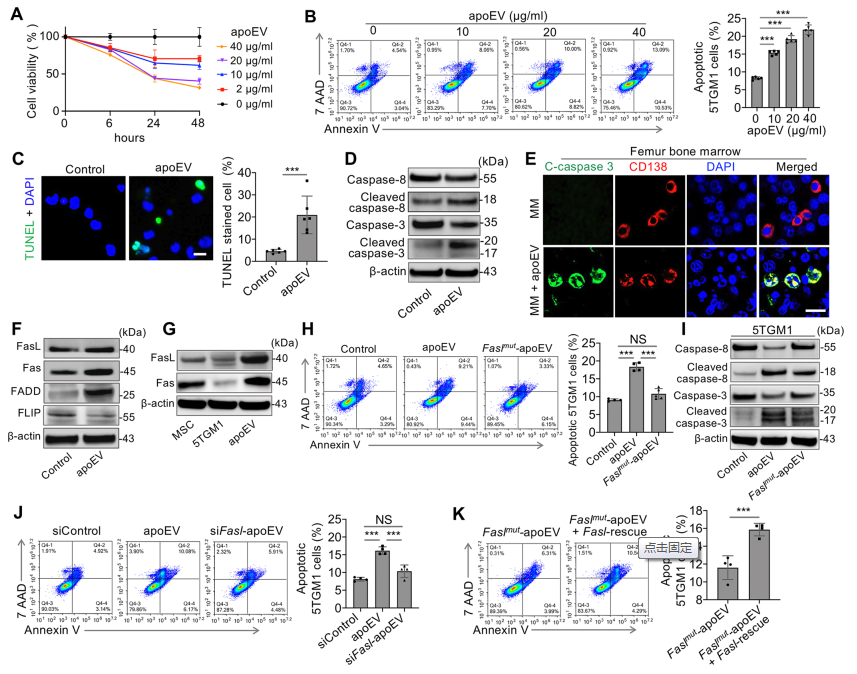
图2 ApoEVs通过FasL/Fas途径诱导MM细胞凋亡
3. FasL在apoev介导的多发性骨髓瘤治疗中是必需的
Fasl缺陷的Faslmut-apoEVs未能延长MM小鼠的寿命,也未能抑制肿瘤生长(图3A,B)。ELISA分析、MicroCT和组织学分析显示,Fasl缺陷Faslmut-apoEVs未能降低MM小鼠血清IgG2b水平,以及挽救BMD、BV/TV和肾脏损伤(图3D-F)。而挽救Fasl表达可以恢复Fasl缺陷的apoEVs受损的治疗能力 (图3A, B)。组织学分析显示,Fasl过表达恢复了Fasl缺陷apoev的能力,降低血清IgG2b水平,恢复MM小鼠的BMD、BV/TV和肾脏损伤(图3C-F)。
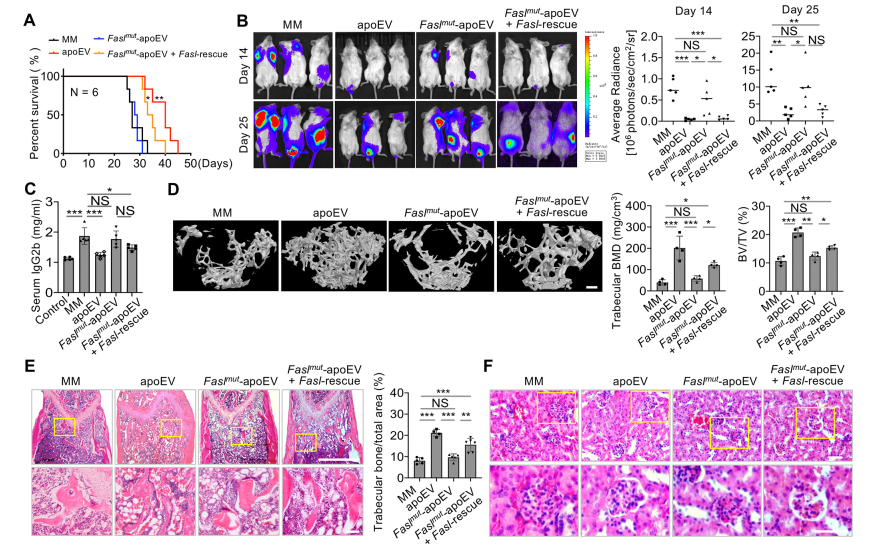
图3 ApoEVs在小鼠体内通过FasL诱导MM细胞凋亡
4. ApoEVs促进Fas从细胞质到多发性骨髓瘤细胞表面的运输
Fas激活抗体和重组FasL均未能诱导5TGM1细胞凋亡,提示MM细胞中Fas激活通路被破坏(图4A)。Fas分布在5TGM1细胞的整个细胞质中,并且pkh26标记的apoEVs聚集在骨髓瘤细胞表面,并诱导细胞表面Fas明显聚集(图4B)。Western blotting结果显示,apoEV处理提高了MM细胞细胞膜上Fas的表达,但降低了细胞质中Fas的水平(图4C)。流式细胞分析进一步证实apoEVs增加了5TGM1细胞表面的Fas表达(图4D)。ApoEVs在MM小鼠股骨骨髓中诱导Fas膜移位(图4E,F)。ApoEVs输注后,Fas明显转移到CD138阳性的骨髓浆细胞表面(图4E)。流式细胞分析也证明apoEVs显著增加了MM小鼠CD138+骨髓浆细胞表面Fas的比例(图4F)。
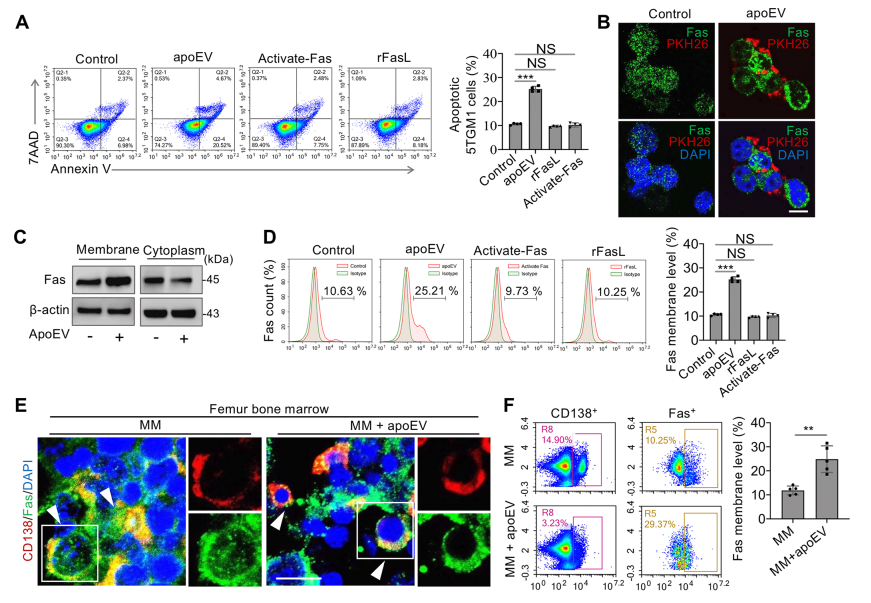
图4 ApoEVs诱导Fas进入细胞膜。
5. ApoEVs直接接触MM细胞,通过引起Ca2+内流和胞浆Ca2+升高诱导Fas膜运输
在apoEV处理后的6小时内,大多数apoEVs直接与5TGM1细胞表面区域接触,而在这段处理后的时间内,只有少数apoEVs可以在细胞质中发现(图5A)。Z-stack two-dimensional SIM显微镜图像和定量分析证实,许多apoEVs与细胞表面重叠,但不在细胞表面内部(图5B,C)。ApoEV处理显著增加了5TGM1细胞内的钙离子 (图5D)。ApoEV处理增强了5TGM1细胞中Cav1.2和Cav1.3的膜表达,但降低了它们的细胞质表达,而Cav1.1的表达没有改变(图5E)。ApoEV介导的细胞内钙内流被L型Ca2+通道抑制剂阻断,并被L型钙通道激活剂激活(图5 F,G),表明apoEV诱导的Ca2+内流依赖于L型钙通道。最重要的是,通过流式细胞术分析、免疫荧光染色和Western blotting(图5F-I)评估,L型Ca2+通道抑制剂处理5TGM1细胞可阻断apoEV治疗后Fas的细胞表面易位,降低了apoEV治疗后5TGM1细胞凋亡,而BayK处理增强了凋亡(图5J)。
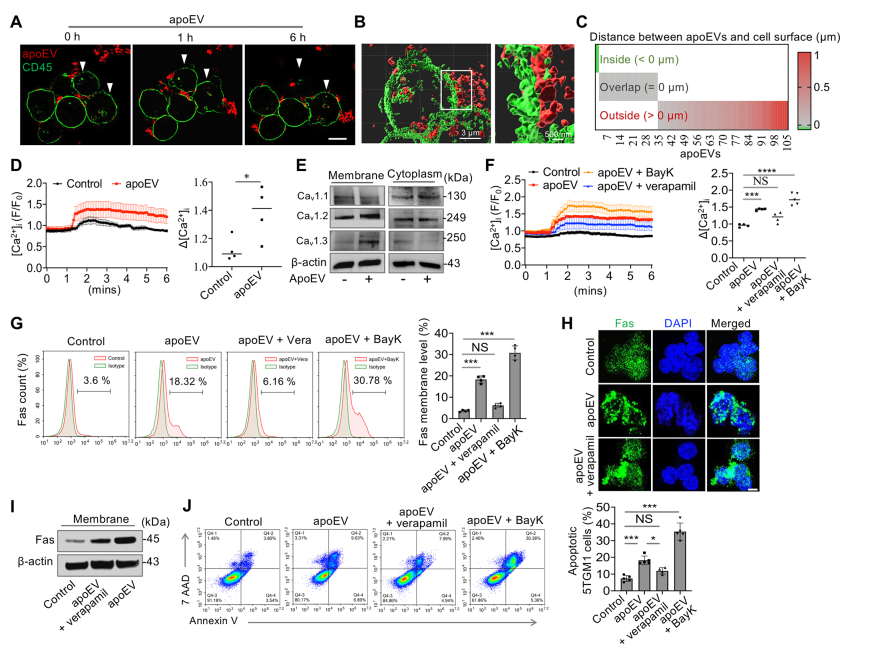
图5 apoEV诱导的Fas运输到细胞膜依赖于Ca2+的流入
6. 骨髓瘤细胞来源的apoEVs未能改善多发性骨髓瘤
5TGM1MM细胞来源的apoEVs未能延长MM小鼠的寿命(图6A)。MicroCT分析显示,与MSC来源的apoEVs相比,5TGM1细胞来源的apoEVs未能挽救BMD和BV/TV的下降(图6B,C)。5TGM1细胞源apoEVs在体外不能增加MM细胞膜中Fas的表达,也不能诱导MM细胞凋亡(图6D,E)。此外,5TGM1细胞来源的apoEVs表达的FasL水平明显低于MSC来源的apoEVs(图6F)。来自MSCs的apoEVs,而不是来自MM肿瘤细胞的apoEVs,可以诱导MM细胞凋亡和改善MM表型。因此,MSCs是临床前和临床研究中产生apoEVs的合适细胞来源。
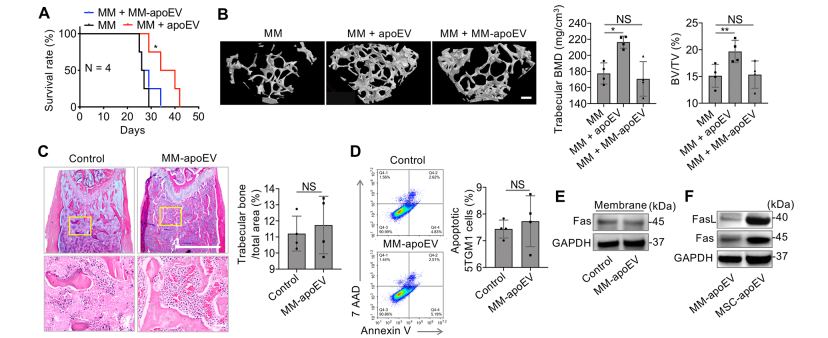
图6 5TGM1细胞源apoEVs对MM细胞的影响
主要研究结论:
MSC来源的外源性apoEVs可以通过激活FasL/ Fas信号通路抑制MM细胞生长,减轻骨髓瘤骨病。此外,apoEVs通过提高MM细胞的胞质Ca2+,促进Fas蛋白从细胞质运输到细胞膜。apoEV诱导Fas转位至MM细胞膜,apoEV表面FasL直接诱导MM细胞凋亡。这种一箭双雕的效应可能为MM的治疗策略提供了一种很有前途的方法。这一发现为目前对EVs和肿瘤相互作用的理解提供了见解,并为MSC来源的apoEV具有作为无细胞治疗肿瘤的潜力提供了证据。






