肠浆膜损伤修复的第3种巨噬细胞——GATA6 +腹腔巨噬细胞
通过体内血液循环招募骨髓来源单核细胞并随后转变为CS3CR1+巨噬细胞以响应肠道损伤的过程是依赖于CCR2,Nr4a1和微生物组的。这个过程对于适当的组织修复非常重要,然而,GATA6+腹腔巨噬细胞可能是受损肠道部位可选择性的,更容易获得和有功能性的髓细胞。本文证实了该猜想,并于2021年12月发表在《Nature Communications》IF:14919期刊上。
技术路线:
主要实验结果:
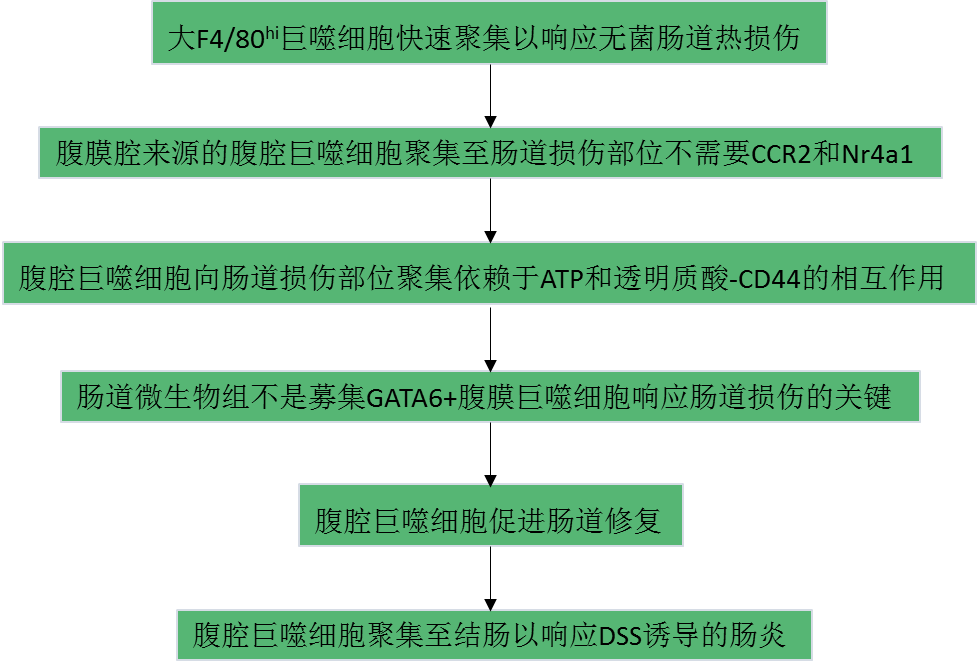
CX3CR1是肠道巨噬细胞特异性表明标志物。利用活体成像和有CX3CR1荧光报告的小鼠,观察稳态肠道固有层巨噬细胞,结果发现这些巨噬细胞在血管周围形成一个指间状的物理链(Fig. 1a)。使用Cx3cr1GFP/+Ccr2RFP/+小鼠检测单核细胞和巨噬细胞的招募对无菌性肠热损伤的反应。热探针从结肠浆膜侧创建一个500μm的局灶性坏死性病变,延伸到固有层。结果显示6h内CCR2+单核细胞浸润,而CX3CR1+单核细胞未浸润。相邻损伤部位的CX3CR1+巨噬细胞保持固着,不从原始位置向损伤部位移动(Fig. 1b–d)。尽管F4/80抗体具有固着性,但在损伤部位局部应用F4/80抗体后,C57BL/6小鼠损伤后2h内大F4/80hi巨噬细胞聚集(Fig. 1e)。这些F4/80hi细胞的积累在损伤后24h达到高峰,并持续至48小时(Fig. 1e)。为了证实它们不是来自单核细胞,在损伤后6小时用F4/80抗体对Cx3cr1GFP/+Ccr2RFP/+小鼠进行成像。损伤后24 h,CCR2+单核细胞在损伤部位周围形成环状,并通过血管积聚,而大F4/80hi细胞在血管中看不到,其在损伤中心形成大聚集体(Fig. 1f)。重要的是,这些位于肠道损伤部位的大F4/80hi细胞表达GATA6,这是一种大腹腔巨噬细胞特有的转录因子,而不是肠道F4/80+巨噬细胞(Fig. 1g,h)。
2、腹膜腔来源的腹腔巨噬细胞聚集至肠道损伤部位不需要CCR2和Nr4a1
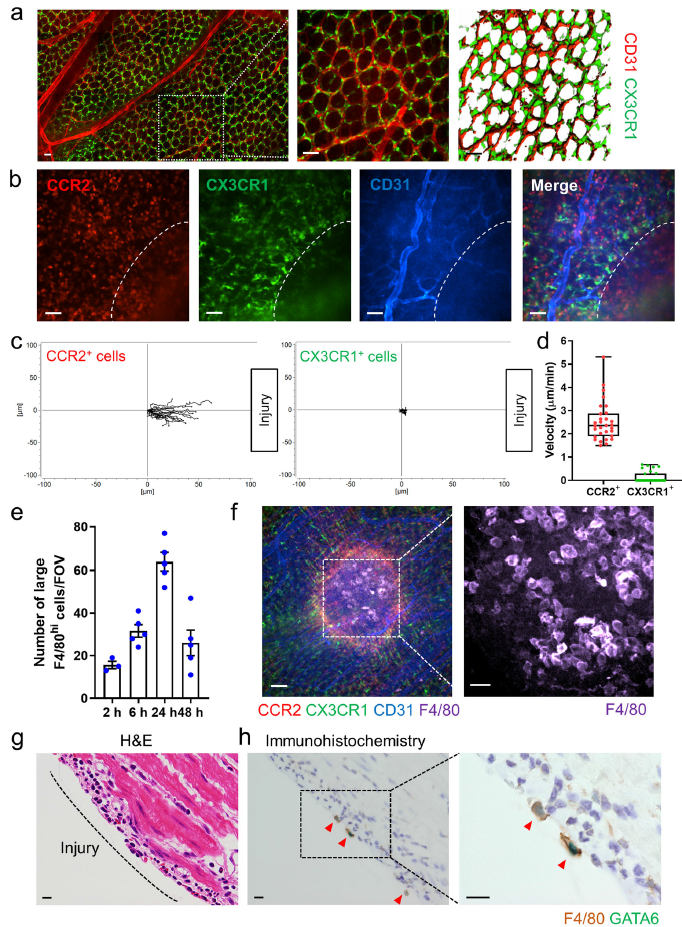
Luminex检测显示,损伤后24小时 MCP-1 (CCL2)吸引CCR2+单核细胞的关键趋化因子,以及中性粒细胞趋化因子KC在结肠中高表达(Fig. 2a)。然而,CCL2和CCL2受体缺失不影响GATA6+巨噬细胞聚集(Fig. 2b, c),表明1:CCL2与腹膜巨噬细胞的聚集无关;2:CCR2阳性单核细胞对腹膜巨噬细胞招募并不重要。与野生型小鼠相比,损伤后24和48小时,Nr4a1-/-小鼠受损肠内大F4/80hi细胞的招募没有差异,该鼠损伤部位缺乏Ly6Clo单核细胞(Fig. 2b, c)。表明大F4/80hi细胞的聚集不依赖CCR2和Nr4a1。
为了证实腹膜是大F4/80hiGATA6+巨噬细胞的来源,通过腹腔注射氯磷酸盐脂质体(CLL)敲除掉腹腔巨噬细胞。腹腔注射CLL不影响肠道内CX3CR1+巨噬细胞分布(Fig. 2d, e)或CCR2+单核细胞在损伤部分的分布,但是显著降低了大F4/80hi巨噬细胞在肠道部分的数量(Fig. 2f, g)。此外,当腹膜注射LysM-eGFP小鼠(腹膜腔中超过85%的GFP+细胞为GATA6+巨噬细胞)的腹膜细胞至C57BL/6小鼠时发现这些细胞在肠道损伤部位积累,但当静脉注射时GFP+巨噬细胞则不能进入损伤部位(Fig. 2h–j)。而当用CLL敲除掉GATA6+巨噬细胞后再腹膜注射LysM-eGFP小鼠腹膜细胞时则不能观察到细胞在损伤部位聚集。以上表明是腹膜腔来源的腹腔巨噬细胞聚集至肠道损伤部位,且该过程不需要CCR2和Nr4a1。

图2腹腔巨噬细胞聚集至肠道损伤部位直接通过腹腔途径而不需要CCR2和Nr4a1
3、腹腔巨噬细胞向肠道损伤部位聚集依赖于ATP和透明质酸-CD44的相互作用
ATP是无菌损伤中一个重要的损伤相关分子模式(DAMP),它召集中性粒细胞和巨噬细胞到损伤部位。用apyrase,一种ATPase或ATP受体拮抗剂预处理可抑制大F4/80hi巨噬细胞在肠道损伤部位的积聚(Fig. 3a, b)。为了进一步探讨腹腔巨噬细胞动力学在肠道损伤中的机制,阻断GATA6+腹腔巨噬细胞上高表达的白细胞粘附分子CD44,并对肠道损伤部位进行了成像。Anti-CD44预处理可防止F4/80hi巨噬细胞向肠道损伤部位聚集(Fig. 3c, d)。重要的是,免疫荧光染色显示,CD44的配体透明质酸暴露在肠道损伤部位,而不是浆膜表面(Fig. 3e)。用透明质酸酶(一种分解透明质酸的酶)也能阻止腹腔巨噬细胞的招募(Fig. 3f)。并且粘膜侧的损伤导致浆膜表面F4/80hi巨噬细胞的积累,这表明这些积累机制在严重的粘膜损伤中也有部分作用(Fig. 3g, h)。

图3腹腔巨噬细胞向肠道损伤部位的聚集依赖于ATP和透明质酸-CD44的相互作用
4、肠道微生物组不是募集GATA6+腹膜巨噬细胞响应肠道损伤的关键
招募CCR2+巨噬细胞至肠道和转换CX3CR1+单核/巨噬细胞是依赖于肠道微生物组的无论是在急性修复还是稳态翻转中。由于烧伤从浆膜一直延伸到固有层,所以作者预测肠道微生物群对GATA6+腹腔巨噬细胞的招募至关重要。从出生前到成年期一直使用广谱抗生素(Abx)(Fig. 4a),通过SYTOX绿色染色检测证实了小鼠肠道菌群数量的减少(Fig. 4b)。16S测序也表明了Abx处理小鼠的肠道菌群发生了显著改变(Fig. 4c),然而,这些改变对CD11bhiF4/80hiGATA6+腹腔巨噬细胞的数量没有影响,对肠道损伤部位聚集的大F4/80hiGATA6+巨噬细胞也没有影响(Fig. 4c–f),表明大腹腔巨噬细胞募集表型是不依赖于肠道微生物组的。此外,CD44的表达也没有明显受到肠道菌群巨变的影响(Fig. 4c, d)。
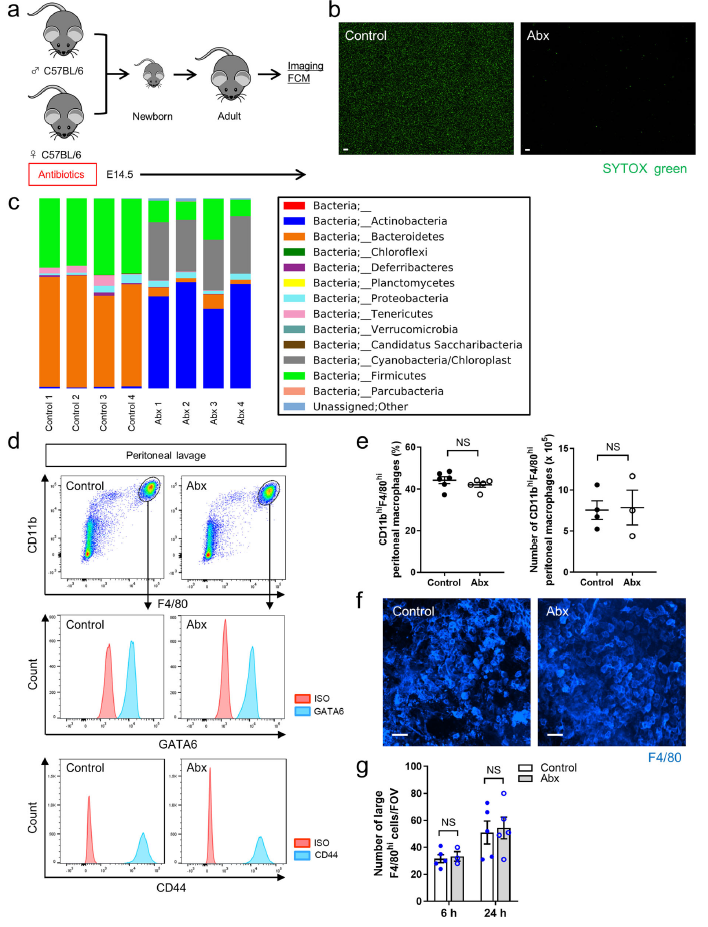
图4在肠道损伤过程中肠道微生物组不影响腹腔巨噬细胞表现和动态
5、腹腔巨噬细胞促进肠道修复
作者此前研究发现Ccr2RFP/RFP小鼠在伤后48h的愈合延迟。热损伤后24小时的结肠延时成像显示,大F4/80hi巨噬细胞已经在附近分解SYTOX+坏死细胞 (Fig. 5a)。接下来,通过腹腔注射CLL来清除腹腔巨噬细胞后,对肠道损伤部位SYTOX绿色阳性细胞进行成像。在损伤后48小时,与PBS -脂质体(PBS-L)处理的小鼠相比,CLL处理的小鼠坏死细胞的清除被延迟 (Fig. 5b, c)。此外,腹腔巨噬细胞敲除与肠损伤部位血管重建和胶原沉积明显受损有关(Fig. 5d–g)。在腹膜macrophage-depleted Ccr2RFP / RFP小鼠中SYTOX-positive细胞的清除缺乏更加明显(图5 b, c),这表明CCR2+单核细胞(可变成CX3CR1 +单核细胞/巨噬细胞)和大GATA6 +腹膜巨噬细胞都可作用于清除坏死细胞,也许发生在小肠的不同层。事实上,受损结肠的成像显示CCR2+单核细胞主要聚集在固有层,而F4/80hi巨噬细胞主要聚集在肌层。
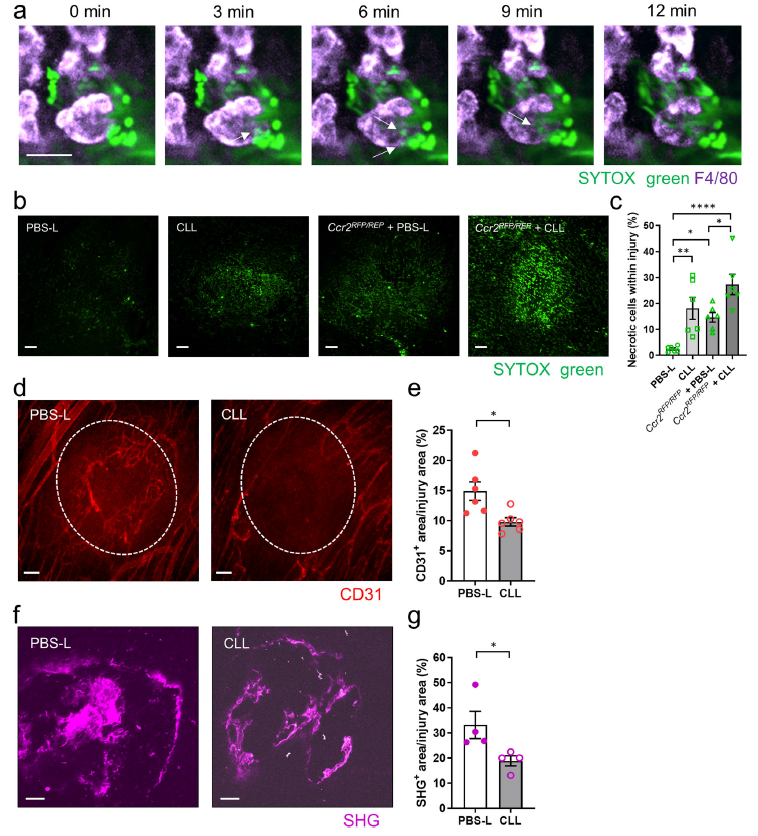
图5腹腔巨噬细胞促进肠道修复
6、腹腔巨噬细胞聚集至结肠以响应DSS诱导的肠炎
为了评估腹膜巨噬细胞是否可以对从固有层开始并向浆膜发展的炎症作出反应,小鼠口服含有 4% DSS 的水5天。F4/80抗体局部应用于浆膜的LyM- eGFP小鼠结肠活体显像显示LysM+F4/80hi大巨噬细胞浸润肌层(Fig. 6a, b)。当将来自LysM-eGFP小鼠的腹膜细胞腹腔内转移到C57BL/6小鼠,一个类似的积累即腹腔LysM+F4/80hi巨噬细胞被发现在DSS诱导的结肠炎中积累(Fig. 6c–e)。同样使用DSS诱导Cx3cr1GFP/+Ccr2RFP/+小鼠结肠炎,发现没有CCR2+或CX3CR1+信号与大F4/80hi巨噬细胞共定位(Fig. 6f),表明这些是不同的细胞谱系。这些结果表明这些大有效性巨噬细胞来源于腹腔,而不是脉管系统。关于这一点,免疫荧光染色显示,与对照组相比,DSS诱导的结肠炎结肠中透明质酸的表达增加(Fig. 6g, h)。如热损伤模型所述,Abx治疗不影响DSS诱导的结肠炎中F4/80hi腹腔巨噬细胞向结肠的聚集(Fig. 6i, j)。
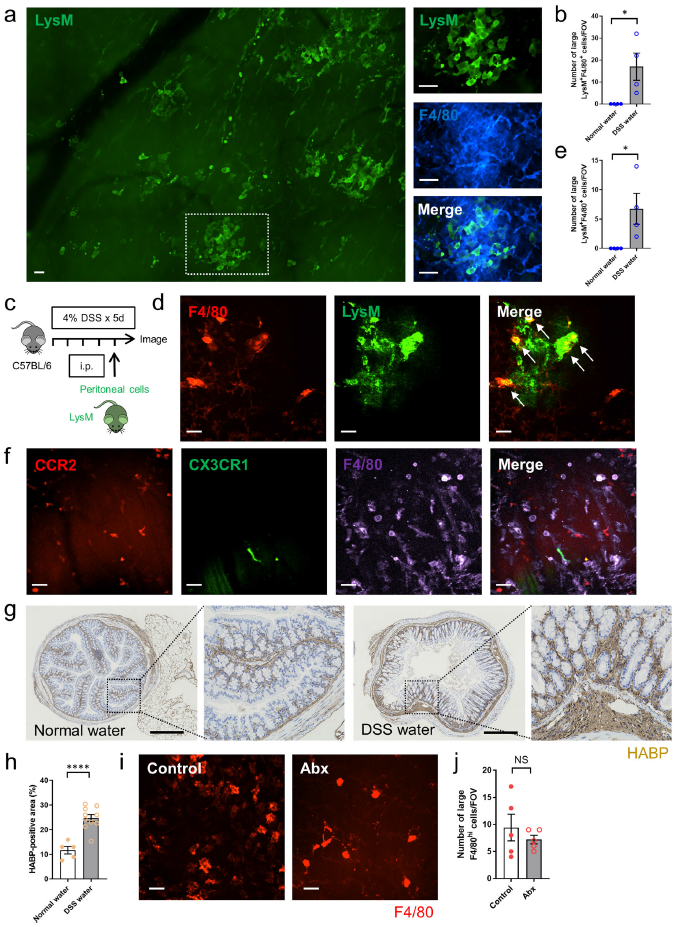
图6在DSS诱导的肠炎中腹腔巨噬细胞聚集至结肠
为了进一步分析腹腔巨噬细胞在DSS诱导的结肠炎中的作用,通过腹腔注射CLL敲除小鼠的腹腔巨噬细胞然后检测并与PBS-L处理的DSS小鼠比较小鼠的体重,疾病活性指数,结肠长度和病理发现。发现,CLL小鼠的损伤水平和炎症水平增加,包括更严重的体重丢失和显著增加的疾病活性指数(Fig. 7a, b)。此外,CLL处理小鼠的结肠长度,这是炎性损伤的标志,明显短于DSS诱导的小鼠但是和PBS处理的没有显著性差异(Fig. 7c)。此外,DSS诱导5天后的结肠组织切片显示CLL小鼠表现出更严重的病理组织损伤,包括炎性细胞浸润和肠道结构紊乱(Fig. 7d, e)。最后对DSS诱导的结肠炎进行了腹膜细胞移植实验,以评估其对炎症和症状的影响(Fig. 7f)。与PBS处理对照组相比,腹腔细胞移植组的疾病活动性指数较低,其他参数差异无统计学意义(Fig. 7g–k)。
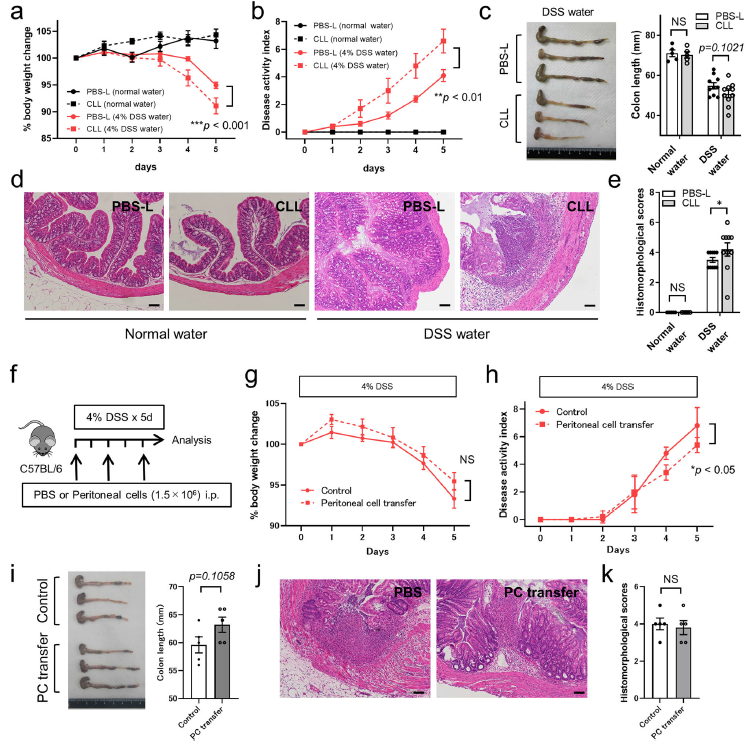
图7腹腔巨噬细胞在DSS诱导的肠炎中发挥了组织修复功能
总之,在本研究中,作者发现了第三种有助于组织修复的巨噬细胞类型,即GATA6+腹腔巨噬细胞,它们通过腹膜途径在损伤部位迅速积累,以应对浆膜内的肠道损伤。alarmin ATP和CD44 -透明质酸相互作用是其从腹腔招募到受损肠浆膜的关键,这导致GATA6+腹腔巨噬细胞组织修复独立于CCR2+单核细胞来源的CX3CR1+单核细胞/巨噬细胞(图8)。令人惊讶的是,当DSS结肠炎引起损伤时,这些细胞也可以在肠道中积累,DSS结肠炎是一种主要开始于固有层的损伤。
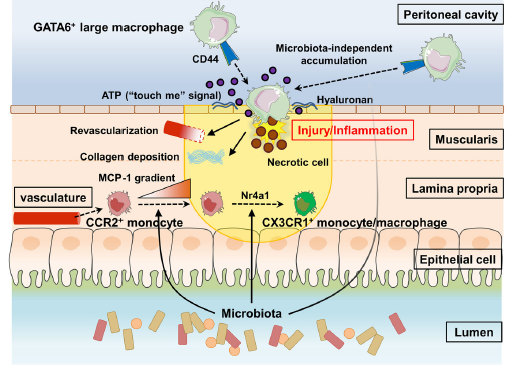
图8机制模式图:GATA6+腹腔巨噬细胞浸润损伤的肠道通过直接腹膜途径作用于组织修复。
参考文献:
Honda Masaki., Kadohisa Masashi., Yoshii Daiki., Komohara Yoshihiro., Hibi Taizo.(2021). Directly recruited GATA6 + peritoneal cavity macrophages contribute to the repair of intestinal serosal injury. Nat Commun, 12(1), 7294. doi:10.1038/s41467-021-27614-9






