Caspase-4非典型炎症小体的先天免疫感知促进细胞衰老
细胞衰老是一种以增殖细胞停止、分泌表型、大分子损伤和代谢改变为特征的细胞状态,可由几种不同的应激机制触发。本研究中,作者探讨caspase-4非典型炎症小体对细胞衰老的影响。这篇文章于2021年12月发表于《springer nature》,IF=10.717
本文技术路线:

主要结果:
1.在人二倍体成纤维细胞中,caspase-4识别的细胞质脂多糖诱导了衰老反应
虽然典型的炎症小体可以被微生物来源的胞壁酰二肽(MDP) 激活,但半胱氨酸的天冬氨酸蛋白水解酶caspase-4和caspase-5作为非典型炎症小体能识别微生物脂多糖(LPS)诱导Gasdermin-D裂解和焦亡。Gasdermin-D是非典型炎症小体的功能底物,可诱导IL-1β分泌和细胞凋亡。为了比较激活典型和非典型炎症小体在衰老中的作用,作者在人IMR90成纤维细胞中通过转染MDP或LPS激活caspase-1或caspase-4/5炎症小体。为了研究caspase对LPS转染后的衰老表型的影响,作者在转染前用shRNA下调caspase-1或caspase-4的表达(图1A)。结果发现,与caspase-1相比,caspase-4在获得衰老特征方面是必需的,能增加SA-β-半乳糖苷酶活性增加,减低细胞增殖速度,并且能在存活细胞亚群和死亡细胞中诱导p21CIP1和p16INK4a(图1B-D)。此外,在存在LPS的条件下,caspase-4过表达加速了衰老(Fig. 1E, F)。说明CASPASE-4的表达对非典型炎症小体诱导的衰老至关重要,细胞内LPS暴露后的衰老表型的获得是通过caspase-4介导的,且呈剂量依赖性。
接下来,作者研究caspase-4的底物gasdermin-D和关键的衰老调节因子p53在LPS诱导的衰老和焦亡中的作用。GSDMD是炎性caspase的共同底物,P53的敲低(TP53)和GSDMD的敲低显著降低了LPS依赖的细胞生长停滞 (图1H, I, J)。有趣的是,在LPS诱导的衰老中,GSDMD的抑制也对p16INK4a和CASPASE-4诱导有强烈的影响。总之,这些结果表明,非典型炎症小体的细胞质LPS感应诱导了一种依赖于caspase-4、gasdermin-D和p53表达的衰老反应。
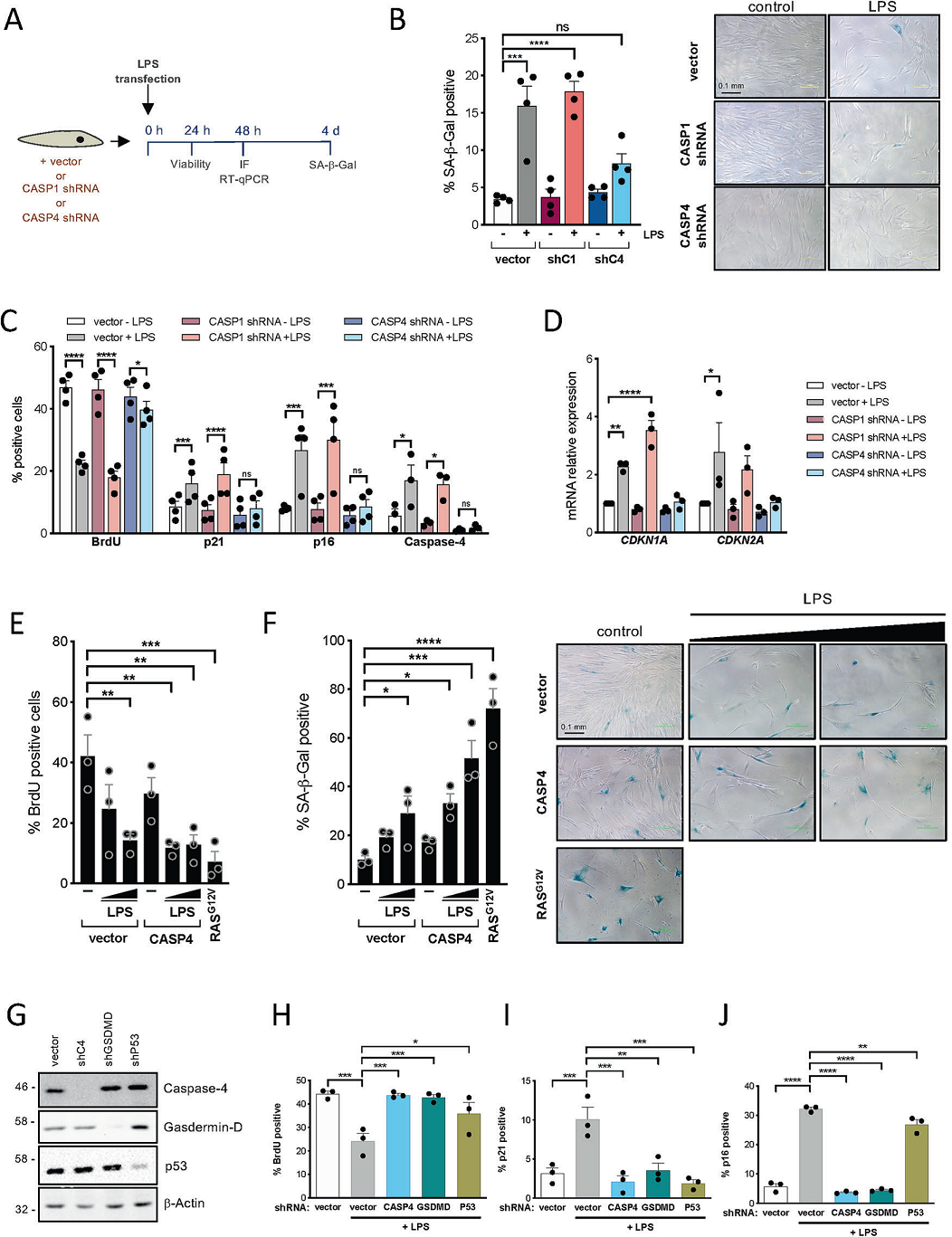
Fig1 LPS介导的caspase-4活化诱导人原代成纤维细胞衰老表型
2. Caspase-4介导的LPS诱导的衰老反应与IL-1β启动无关
炎症小体的激活受到两种机制的严格调控。首先需要提高IL1B的转录水平,之后是第二个诱导炎性小体组装的信号。有趣的是,IMR90成纤维细胞中唯一过表达CASPASE-4或CASPASE-1的衰老诱导并没有诱导IL1B的转录激活(Fig. 2A)。相反,IL1B转录水平在LPS转染后以CASPASE-4依赖的方式增加(Fig. 2B)。
作者之前已经证明TLR2在细胞衰老中控制IL1B表达和衰老相关的分泌表型SASP的作用。因此,作者决定研究TLR2介导的炎性小体启动是否与LPS介导的CASPASE-4诱导的衰老协同作用。结果发现,合成脂肽Pam2CSK4和Pam3CSK4(分别为LR2/6和TLR 2 /2激动剂) 的加入,而非LPS (TLR4激动剂)和MDP高度诱导了IL1B mRNA。然后,作者观察到用TLR2受体激动剂Pam2CKS4启动炎症小体与LPS转染显著协同产生IL-1β诱导,而CASPASE-4异位过表达进一步增强了这种诱导(Fig. 2C)。然而,添加Pam2CKS4,LPS诱导的衰老中,作者没有观察到细胞增殖或SA-β-半乳糖苷酶活性显著下降(Fig. 2D, E)。通过观察对数增长,在所有条件下,LPS转染细胞中观察到的IL1B mRNA水平的增加都是最小的Fig. 2C)。这些结果表明,CASPASE-4刺激的附加信号,如持续启动信号对IL1B和SASP在LPS介导的细胞衰老中的诱导。此外,这些数据也表明LPS诱导的caspase-4衰老反应是独立于IL1B和SASP的。
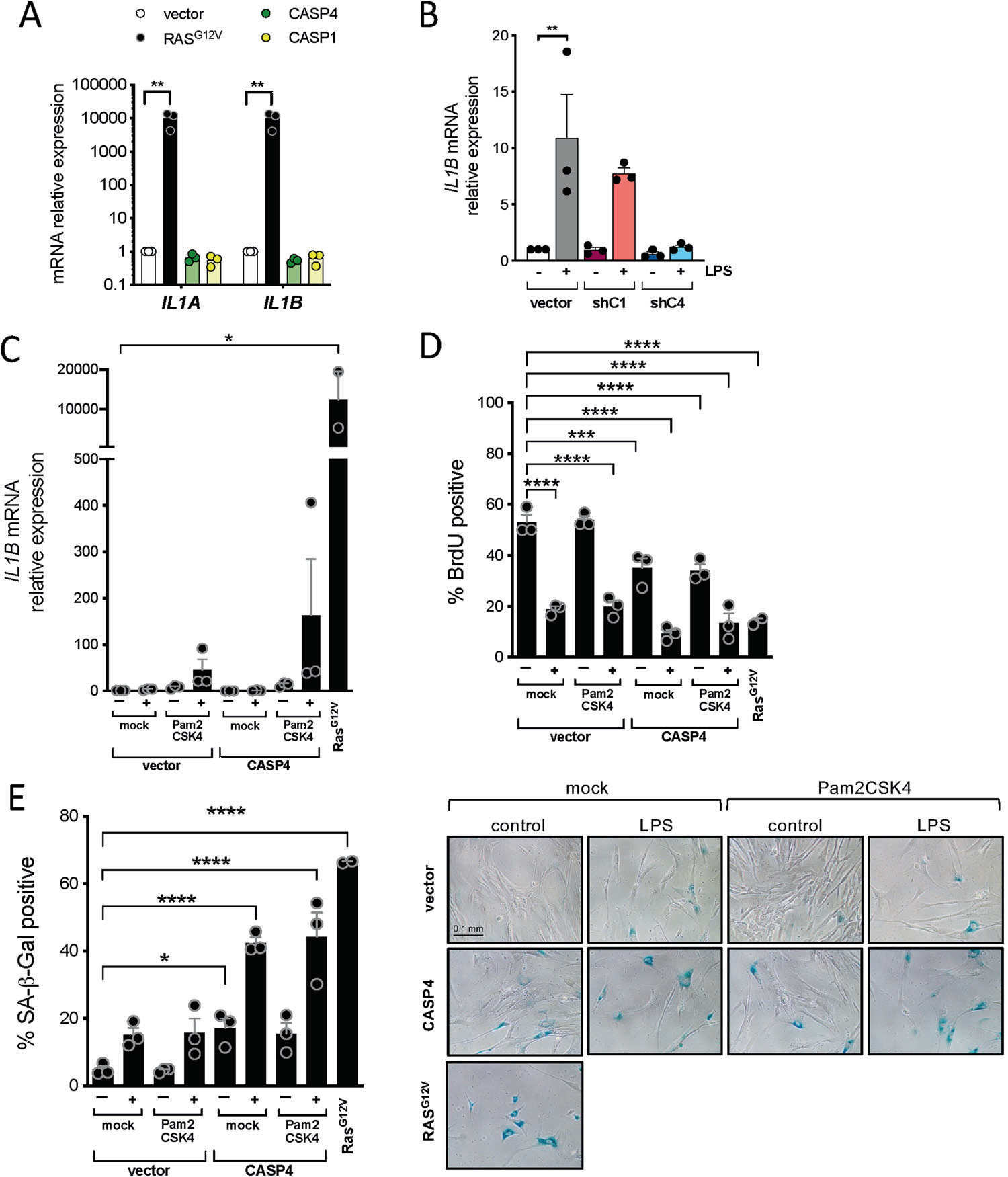
Fig2 LPS介导的caspase-4诱导的衰老与炎性小体启动无关
3. Caspase-4蛋白水解活性对LPS诱导的衰老不是必需的
Caspase-4的活性位点已经被鉴定为与残基C258相关,该氨基酸的点突变使该蛋白催化失活。为了进一步研究Caspase-4蛋白酶的酶活对衰老的影响,作者在IMR90细胞中过表达CASPASE-4野生型和催化死亡的突变体C258A (CASPASE-4C258A) (Fig. 3A), 并对表型结果进行评估。过表达野生型caspase-4或caspase-4C258A可使细胞增殖降低,SA-β-半乳糖苷酶活性增加(Fig. 3B, C)。接下来,在LPS转染前,在IMR90成纤维细胞中稳定过表达野生型caspase-4和caspase-4C258A (Fig. 3D)。结果发现过表达caspase-4C258A而非野生型caspase-4的 IMR90细胞对LPS转染后的细胞死亡具有耐药性(Fig. 3E)。表明CASPASE-4野缺陷形式在焦亡中具有负作用。然而,CASPASE-4野生型和CASPASE-4C258A过表达的细胞在LPS刺激后仍然对衰老特征敏感(Fig. 3F, G)。这些结果表明,与caspase-4介导的细胞焦亡相反,caspase-4在在脂多糖诱导的衰老与caspase-4催化活性无关。
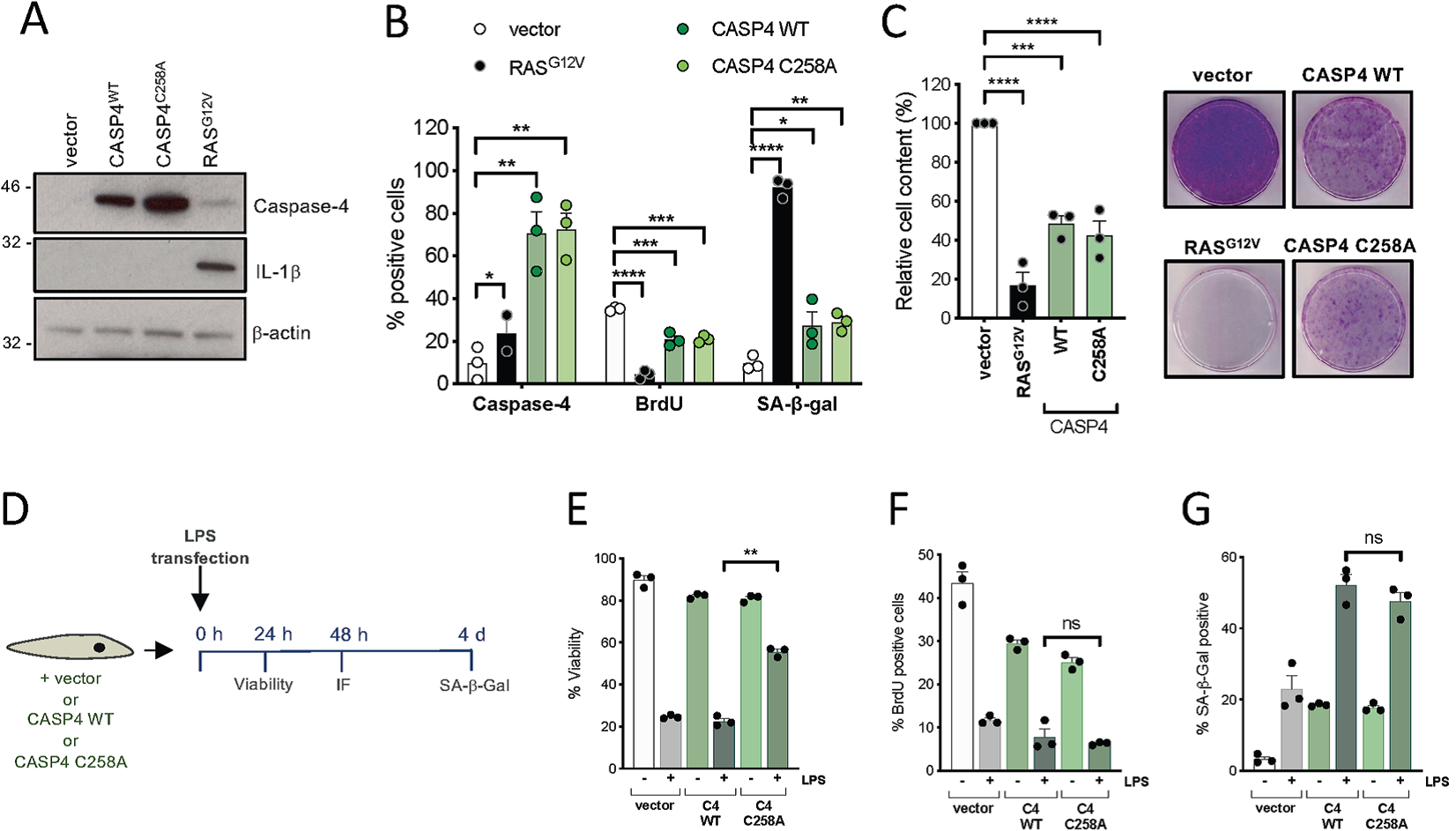
Fig 3 Caspase-4介导的衰老调控独立于其催化功能
4.Caspase-4在癌基因诱导的衰老过程中被诱导和组装
接下来,作者研究了caspases在癌基因诱导衰老中(OIS)的作用。为诱导OIS,在IMR90人成纤维细胞中过表达RASG12V。HRASG12V过表达降低细胞增殖,增加SA-β-半乳糖苷酶活性(Fig. 4A)。与细胞周期抑制剂p21CIP1、p16INK4a和p15INK4b的上调相一致,RASG12V过表达后,Caspase-4在mRNA和蛋白水平上的表达均增加(Fig. 4B, C)。接下来,作者利用诱导系统来严格控制衰老进程。在这个系统中,雌激素受体(ER)配体结合域的突变体与感兴趣蛋白(RAS)融合;结果发现ER:RAS细胞在添加4-羟他莫西芬(4OHT)后发生致癌基因诱导衰老(Fig. 4D)。与未处理的IMR90 ER:RAS相比,加入4OHT后,IMR90 ER:RAS细胞出现细胞增殖停滞,SA-β-半乳糖苷酶活性增加(Fig. 4D)。在OIS处理的细胞中,caspase-4 mRNA水平、IL1B mRNA水平、以及Caspase-4蛋白表达呈指数增长 (Fig. 4E, F,G)。此外,内源性caspase-4寡聚化在IMR90 ER:RAS衰老细胞中检测到,但在4OHT处理后3天的对照组细胞中未检测到(Fig. 4H)。此外,加入4OHT之后的第4天和第8天,IMR90 ER:RAS细胞中caspase-4蛋白水解活性也有所提高(Fig. 4I)。这些结果表明,在OIS中,caspase-4的表达被诱导,非典型炎症小体被组装。
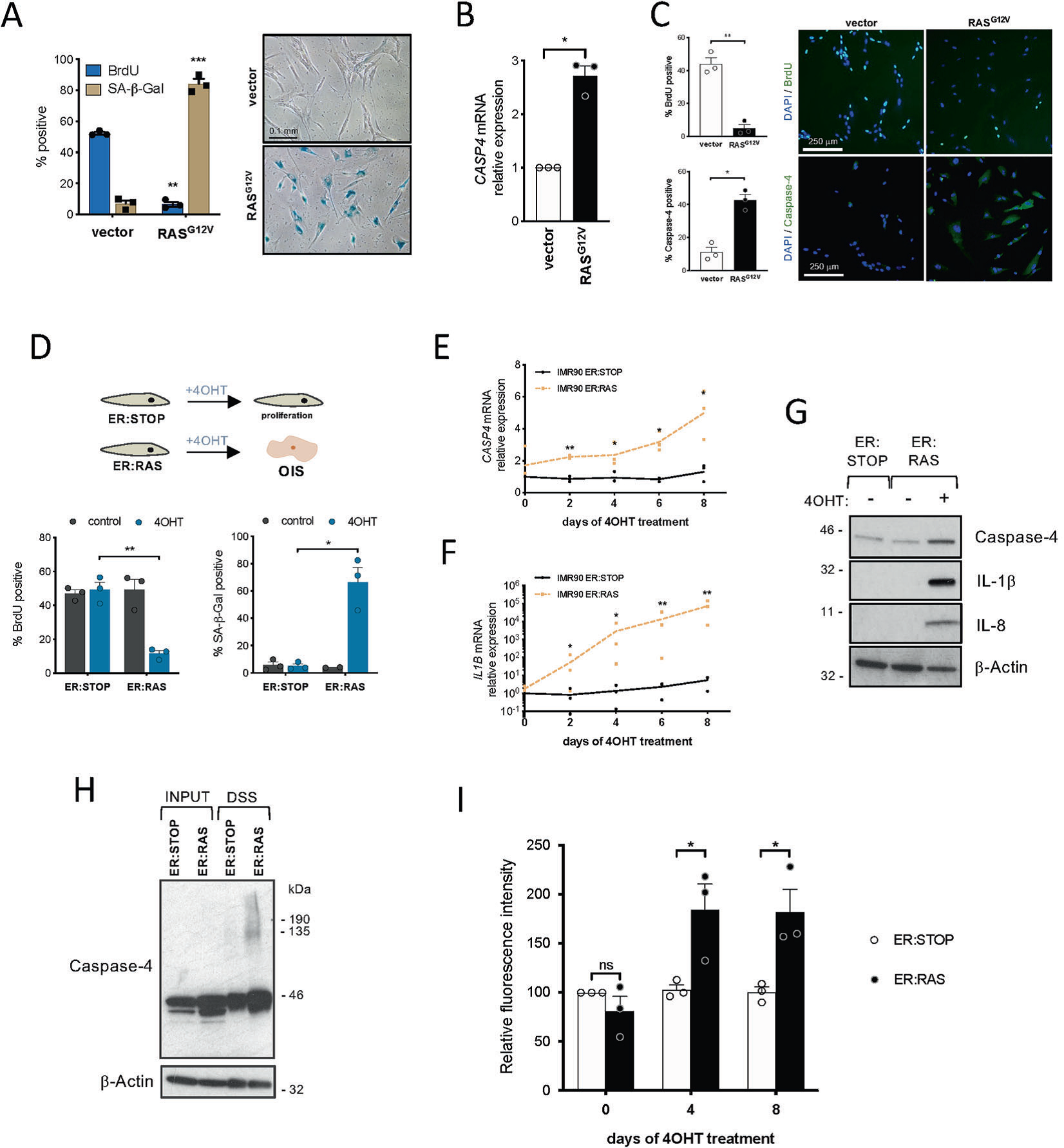
图4 Caspase-4非典型炎症小体在癌基因诱导的衰老中被激活
5.在OIS中,Caspase-4非典型炎症小体是炎症信号转导所必需的
接下来,作者用IMR90 ER: RAS系统研究了caspase-4在OIS中的功能作用,分析CASPASE-4缺失后mRNA表达的整体变化。IMR90 ER:stop和ER: RAS 细胞转染CASPASE-4和CASPASE-4 干扰序列,5天后和8天后采集样本,在caspase-4激活和SASP完全形成后立即加入4OHT,并进行转录组分析(Fig. 5A)。转录组测序分析发现有557个和478个基因显著差异表达,RASG12V-OIS 细胞中添加OHT添加的第5天和第8天分别有340个和240个CASPASE-4依赖方式诱导的基因(Fig. 5A)。对50个标志性基因的转录组数据进行基因集富集分析(GSEA),结果显示RASG12V-OIS细胞CASPASE-4依赖调控与炎症过程相关,包括TNF-α信号和干扰素反应。热图显示,如果靶向CASP4(包括SASP因子),那么衰老过程中炎症相关基因的增加表达会被消除(Fig. 5C-E)。血清淀粉样蛋白SAA1和SAA2属于载脂蛋白家族,能激活先天和适应性免疫细胞,最近被确认为SASP因子。作者发现当CASPASE-4成为OIS的靶点时,SAA1和SAA2的表达也降低了(Fig. 5F, G)。此外,当CASPASE-1或CASPASE-4被靶向时,细胞内成熟IL-1β的水平也显著降低(Fig. 5H, I, J)。在RASG12V诱导的细胞中,当CASPASE-4靶向时,分泌的IL-1β浓度显著降低(Fig. 5K)。此外,通过抑制CASPASE-4的表达,OIS中IL1B、IL6和IL8 mRNA的诱导也受到了影响 (Fig. 5L)。这些结果表明caspase-4参与了caspase-1介导的OIS中SASP的激活。

Fig 5 Caspase-4激活控制促炎SASP
6.在OIS中,caspase-4非典型炎症小体有助于抑制细胞增殖
为了研究非典型炎症小体在OIS中调节细胞增殖中的作用,作者对 CASPASE-4进行干扰。结果发现caspase-4靶向siRNA转染显著挽救了OIS期间的早期细胞增殖停滞(Fig. 6A),增加了总细胞含量(Fig. 6B, C)。事实上,靶向CASPASE-4降低了p16INK4a的表达,挽救了pRb的磷酸化(Fig. 6E),并导致E2F靶基因水平的转录增加(Fig. 6E), 这表明在OIS中CASPASE-4是通过控制p16INK4a和p15INK4b的表达来调节细胞增殖。总之,CASPASE-有助于阻止细胞衰老过程中的增殖,最终影响pRb的磷酸化状态,从而导致E2F靶基因的转录抑制。
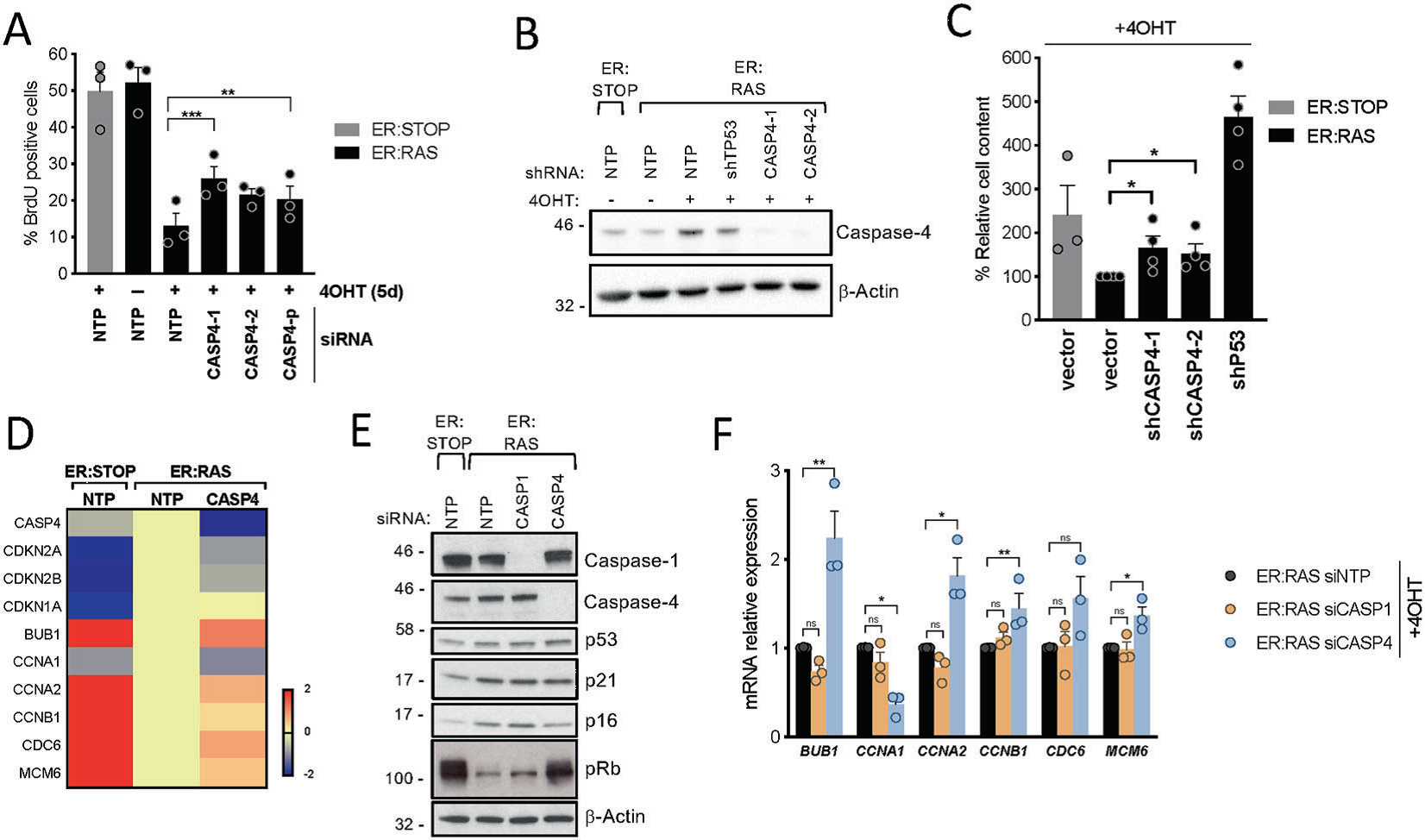

Fig6 在OIS中,Caspase-4有助于抑制细胞增殖
7.在体内, Caspase-11细胞衰老过程中被诱导
作者已经证明caspase-4表达水平在细胞衰老中尤为关键。为了研究非典型炎症小体在体内衰老中的表达,作者使用了三种特征良好的小鼠衰老模型。作者首先在一个OIS模型中分析了caspase-4小鼠同源caspase-11的表达,该模型由Pdx-CRE诱导表达小鼠胰腺胰上皮内瘤变(PanIN) (Fig. 7A)。作者观察到与周围胰腺腺泡细胞、高级别、野生型小鼠导管和腺泡细胞相比,低档PanINs显示caspase-11染色阳性(Fig. 7A)。重要的是,PanINs中Ki-67染色定量显示,caspase-11的表达局限于早期增生指数低的衰老病灶(Fig. 7B),这表明caspase-11的表达与PanIN病变的低级别细胞增殖低相关。然后,作者研究了caspase-11在两种与体内衰老相关的细胞衰老模型中的表达。首先,作者通过敲除NF-κ b调控因子nfkb1-/- (p50-/-),构建NF-κ b结构激活的加速衰老的小鼠模型,该模型显示了包括肺在内的不同组织的衰老。在这个模型中,脂褐素积累已被证明与衰老有关,并且与野生型小鼠相比,nfkb1-/-在肺中脂褐素积累增加(Fig. 7C)。在caspase-11表达的细胞中也检测到脂褐素积累的类似增加(Fig. 7C)。此外,作者还发现了在野生型和nfkb1-/-小鼠中小气道上皮细胞中p21和caspase-11的相关性,发现caspase-11与小鼠加速衰老模型中的衰老标记物相关(Fig.7D)。
然后,作者研究了caspase-11在小鼠自然机体衰老过程中肺泡细胞衰老中的表达,发现老年小鼠(24月龄)肺泡细胞数量端粒相关DNA损伤反应(DDR)病灶(TAFs)增加(Fig.7E), 这是组织中衰老细胞积累的标志,作者发现这与caspase-11的增加同时发生(Fig.7F)。总之,这些结果验证了非典型炎症小体促进体内衰老的模型。


Fig7 Caspase-11在体内衰老过程中被诱导表达
本研究中,作者表明细胞衰老是由非典型炎症小体的胞质LPS识别诱导的,并且这一途径在细胞对致癌应激的反应中是保守的。
参考文献:
Fernández-Duran I, Quintanilla A, Tarrats N, Birch J, Hari P, Millar FR, Lagnado AB, Smer-Barreto V, Muir M, Brunton VG, Passos JF, Acosta JC. Cytoplasmic innate immune sensing by the caspase-4 non-canonical inflammasome promotes cellular senescence. Cell Death Differ. 2021 Dec 16. doi: 10.1038/s41418-021-00917-6. Epub ahead of print. PMID: 34916628.






