“线粒体学—自噬”强强联手打造高分文章
肾小管上皮细胞(RTECs)是最富线粒体的细胞类型之一,因而容易发生线粒体失调事件,这也被认为是糖尿病肾病(DN)中肾小管损伤的关键事件。然而,其潜在机制仍在很大程度上未知。在此,我们研究了肿瘤坏死因子α诱导蛋白8-like 1 (TNFAIP8L1/TIPE1)在高糖(HG)诱导的RTECs和DN进展中的线粒体功能障碍中的作用和机制。本研究于2022年4月发表在《Redox Biology》IF:11.799期刊上。
技术路线:

主要实验结果:
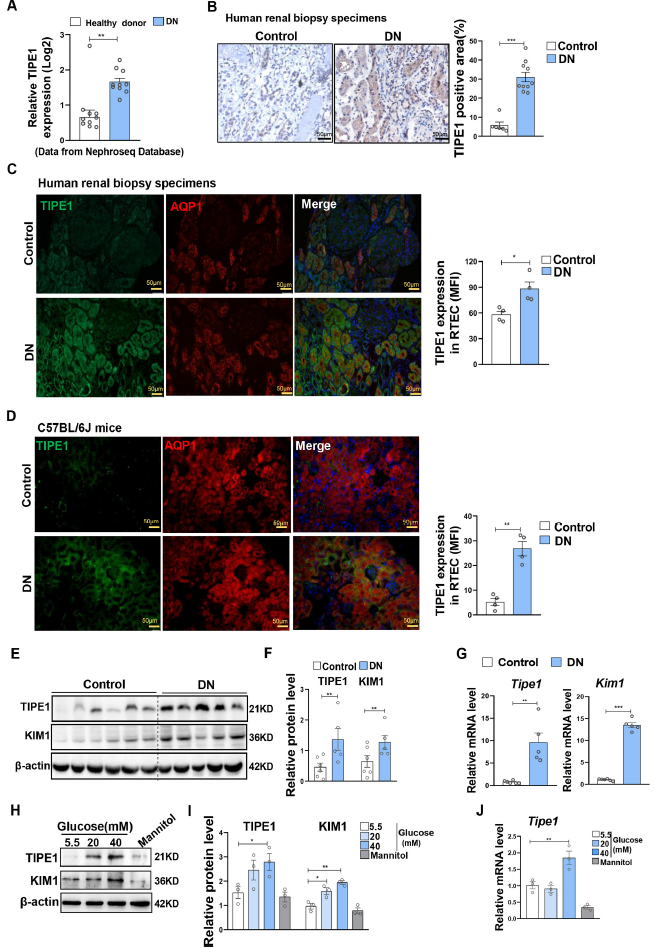
为了初步评估TIPE1在DN中的潜在作用,作者首先分析了TIPE1在Nephroseq数据库DN患者中表达,结果显示,相比于健康组,TIPE1在DN组的表达显著升高(Fig. 1A),免疫组化进一步确认了该结果(Fig. 1B)。免疫荧光染色显示TIPE1表达主要在DN患者和小鼠的肾小管上皮细胞中观察到(Fig. 1C- D)。Western blot和RT-qPCR分析进一步验证了TIPE1在DN小鼠肾组织中的表达上调,这与肾小管损伤标志物KIM1的水平升高相吻合(Fig. 1E–G)。与此一致,在HK-2细胞中,不同浓度(20 mM、40 mM)葡萄糖和不同时间点(24 h、48 h)诱导后TIPE1表达上调,同时KIM1、N-cadherin、α-SMA表达上调(Fig. 1H–J)。这些结果说明TIPE1在DN患者和小鼠的RTECs中显著上调并可能参与DN的发病机制。
为了进一步评估TIPE1在DN进展中肾小管上皮细胞中的功能,作者构建了肾小管上皮细胞特异性敲除TIPE1的小鼠(T1KO)(Fig. 2A-B)。Tipe1缺失降低了尿蛋白的含量(Fig. 2C)并显著减轻了STZ诱导的肾小管损伤(Fig. 2D)和肾小管损伤标志蛋白的表达,如KIM1和NGAL(Fig. 2E-G)。肾小管间质中细胞外基质(ECM)蛋白的过度沉积是DN进展的关键事件。因此,进一步评估肾小管细胞间质纤维化和EMT的程度。Tipe1缺失导致胶原积累减少,以Sirius染色和α-SMA的表达表征(Fig. 2H-I)。一致的,STZ处理后Tipe1缺失小鼠间充质细胞标志物vimentin、N-cadherin和TFs表达显著下调,E-cadherin表达升高(Fig. 2J-L)。这些结果表明RTECs中Tipe1缺失可减轻糖尿病肾损伤和纤维化。
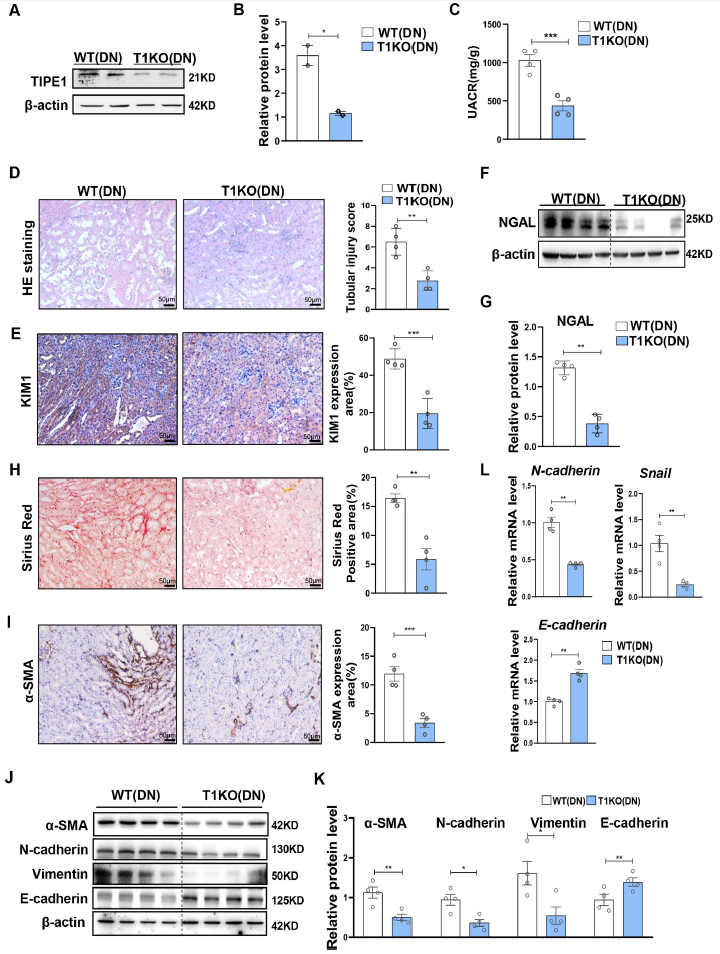
图2 RTECs中缺乏Tipe1可减轻糖尿病肾损伤和纤维化。
作者使用人肾小管上皮细胞HK-2进一步验证了TIPE1在HG诱导肾小管损伤中的作用。与体内实验结果一样,在HG诱导下,相比于Lv-NC,慢病毒携带Tipe1 shRNA (Lv-shTipe1)显著降低了HK-2细胞中KIM1的表达(Fig. 3A and B)。一致地,在HK-2细胞中,沉默Tipe1也下调了间充质细胞标志物和TFs的表达,但上调了上皮标志物的表达,尤其是在HG条件下(Fig. 3C–E)。总之,这些结果强烈支持TIPE1表达促进肾小管细胞损伤、EMT和肾纤维化,从而加速DN进展的观点。
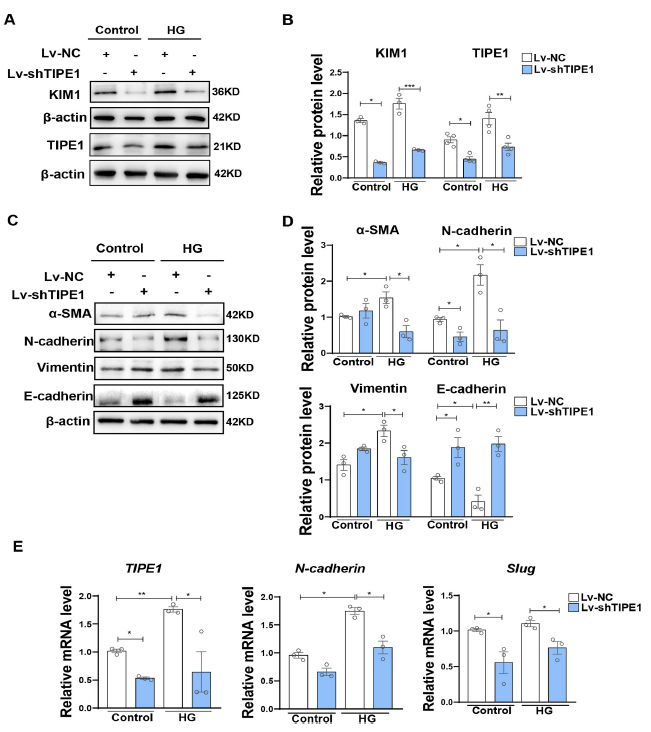
图3 敲除TIPE1可改善HG环境下HK-2细胞损伤和EMT
3、在HG环境下Tipe1缺乏可改善线粒体稳态并减少RTECs的凋亡
为了探究TIPE1调控HG诱导损伤和EMT进程的分子机制,对野生型和TIKO突变型的STZ诱导的DN鼠的肾皮质进行转录组测序,总计筛选到1166个差异表达基因(DEGs)。对这些DEGs进行GSEA分析,与WT小鼠相比,T1KO小鼠的肾皮质组织中与三羧酸(TCA)循环相关的基因正富集(Fig. 4A)。一致地,T1KO小鼠肾组织中的ATP水平高于WT小鼠(Fig. 4B)。透射电镜显示,STZ诱导T1KO小鼠RTECs线粒体损伤率(表现为线粒体肿胀,内外膜断裂,线粒体嵴断裂)明显降低(Fig. 4C)。此外,DHE染色显示T1KO小鼠肾组织中ROS水平降低(图4D)。与体内数据一致,氧消耗率(OCR)分析表明,在HK-2细胞中沉默Tipe1提高了氧化磷酸化能力和ATP生成(图4E)。此外,MitoTracker Red和MitoSOX染色显示,在HG处理的HK-2细胞中,下调Tipe1可上调线粒体膜电位,下调线粒体ROS水平(Fig. 4F and G)。与线粒体控制细胞活力的决定作用一致,RTECs中Tipe1缺失显著降低了肾组织中TUNEL阳性细胞核的比例(Fig. 4H)。在HG条件下,Lv-shTIPE1感染的HK-2细胞凋亡也减少(Fig. 4I)。综上所述,这些结果表明TIPE1具有调节管状细胞线粒体稳态和细胞活力的能力,进而决定DN的进展。
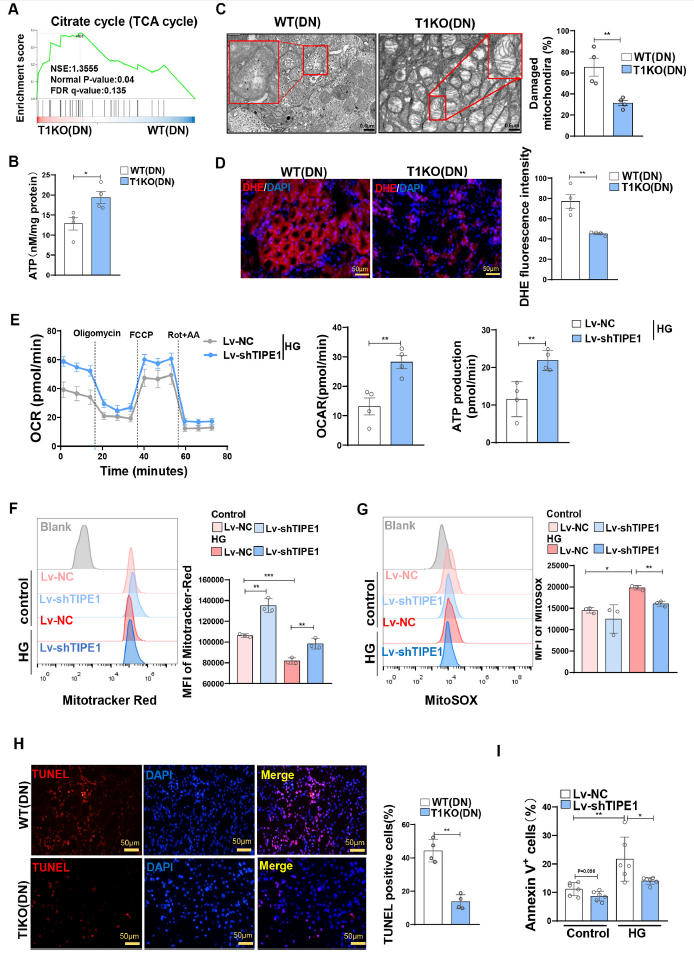
图4在HG环境下,Tipe1缺乏可改善线粒体稳态并减少RTECs的凋亡
4、通过Tipe1消融增强线粒体自噬,可减轻高糖诱导的RTECs损伤和EMT
接下来,探究TIPE1如何控制RTECs的线粒体稳态。线粒体自噬是清除损伤线粒体维持线粒体稳态的过程。KEGG结果显示相比于WT小鼠,线粒体自噬相关基因显著富集于TIPE1敲除鼠的肾组织(Fig. 5A),这些基因与线粒体自噬诱导有关,例如Pink1,Parkin,Atg12,Mfn1/2上调,Sqstm1/p62,Rps27a基因下调(Fig. 5B)。Western blot分析证实,与WT小鼠相比,T1KO小鼠肾组织线粒体中PINK1、Parkin和LC3II蛋白水平上调,p62表达降低(Fig. 5C-D)。TEM也显示T1KO小鼠肾组织中线粒体自噬小体数量明显高于WT小鼠(Fig. 5E)。与WT小鼠相比,T1KO小鼠的肾组织中LC3与线粒体自噬的标志基因COX-IV的共定位更为显著(Fig. 5F and G)。HG条件下Lv-shTIPE1感染的HK-2细胞也有类似的结果(Fig. 5H and I)。这些结果表明,TIPE1在RTECs中是一种潜在的线粒体自噬抑制剂。
积累的数据表明,线粒体自噬是有缺陷线粒体选择性降解的重要机制,参与肾损伤和修复。为了进一步验证线粒体自噬失调在TIPE1促进小管细胞损伤中的重要性,我们用线粒体自噬抑制剂Mdivi-1对HK-2细胞进行预处理。观察到,在Lv-shTIPE1感染的HK-2细胞中,PINK1表达的上调几乎被消除。更重要的是,Mdivi-1可以减轻HK-2细胞中因TIPE1敲除引起的KIM1下调表达(Fig. 5J and K)。一致地,Mdivi-1处理显著挽救了HK-2细胞中TIPE1沉默引起的EMT增强促进作用,在Mdivi-1处理的对照细胞或TIPE1敲除的HK-2细胞中显示相似水平的EMT标记物(α-SMA、波形蛋白、N-cadherin和E-cadherin) (Fig. 5L-M)。综上所述,这些数据表明,消融Tipe1增强了RTECs中的线粒体自噬,从而减缓了小管细胞损伤和EMT。
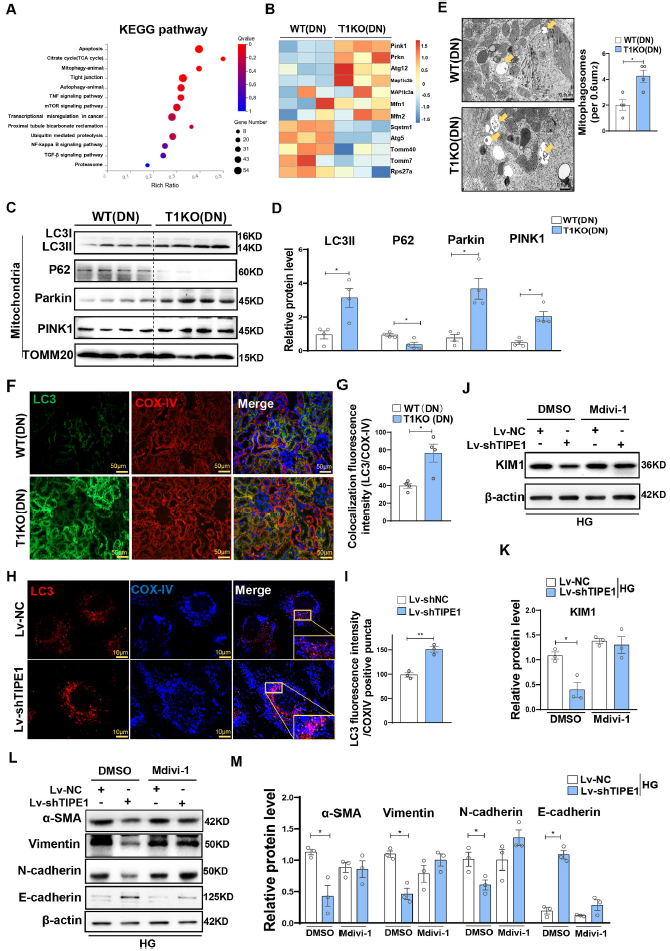
图5通过Tipe1消融增强线粒体自噬,可减轻高糖诱导的RTECs损伤和EMT
5、TIPE1与PHB2相互作用并促进PHB2的蛋白酶体降解
接下来,研究了TIPE1调控RTECs线粒体自噬的机制。越来越多的证据表明,TIPE1与多种蛋白质相互作用,调节细胞生物学。因此,使用pcTIPE1-HA转染细胞的免疫沉淀进行LC-MS/MS (Fig. 6A)。有30个潜在相互作用蛋白的蛋白质得分大于200,其中(Fig. 6B),有报道称,prohibitin 2 (PHB2)是一种线粒体膜内蛋白,在哺乳动物细胞和线虫中都发挥着重要的线粒体吞噬受体的作用。共免疫沉淀试验表明,在pcTIPE1-HA转染的HEK293细胞中,TIPE1和PHB2相互作用(Fig. 6C)。内源性关联在对照组或HG处理的HK-2细胞中得到进一步验证(Fig. 6D)。HG条件下,Lv-shTIPE1感染HK-2细胞后,PHB2蛋白主要在线粒体中上调,而PHB2 mRNA与lv - NC感染细胞相当(Fig. 6E–G)。环己酰亚胺(CHX)追踪实验进一步发现,敲除TIPE1可增加HK-2细胞中PHB2蛋白的半衰期(Fig. 6H and I)。此外,用蛋白酶体抑制剂(MG132)而不是自噬抑制剂氯喹(CQ)处理可以消除TIPE1沉默引起的HK-2细胞中PHB2的上调(Fig. 6J and K),明TIPE1促进PHB2的蛋白酶体降解。一致地,TIPE1的异位表达导致HEK293细胞中PHB2泛素化的增加(Fig. 6L)。这些结果表明,TIPE1与PHB2相互作用,并通过泛素-蛋白酶体途径加速PHB2的降解。

图6 TIPE1与PHB2相互作用并促进PHB2的蛋白酶体降解
6、敲低PHB2消除Tipe1缺失对RTECs线粒体自噬、损伤和EMT的改善作用
为了验证TIPE1在RTECs细胞线粒体吞噬和损伤中的调控作用,给WT或T1KO小鼠注射编码PHB2 shRNA的慢病毒(Lv-shPHB2)或阴性对照慢病毒(Lv-NC)。发现敲除PHB2几乎可以消除Tipe1缺失对RTECs线粒体自噬的作用,表现为Parkin、PINK1、LC3II/I和PHB2水平在WT和T1KO小鼠中相当(Fig. 7A and B)。PHB2的沉默也消除了NGAL、EMT标志物的表达差异(Fig. 7C-F)。HE和免疫组化染色进一步证实,敲除PHB2几乎消除了肾小管细胞Tipe1缺乏对肾损伤和纤维化的改善作用(Fig. 7G)。总之,这些结果支持管状细胞TIPE1通过失调PHB2的表达抑制线粒体自噬并促进DN进展的观点。
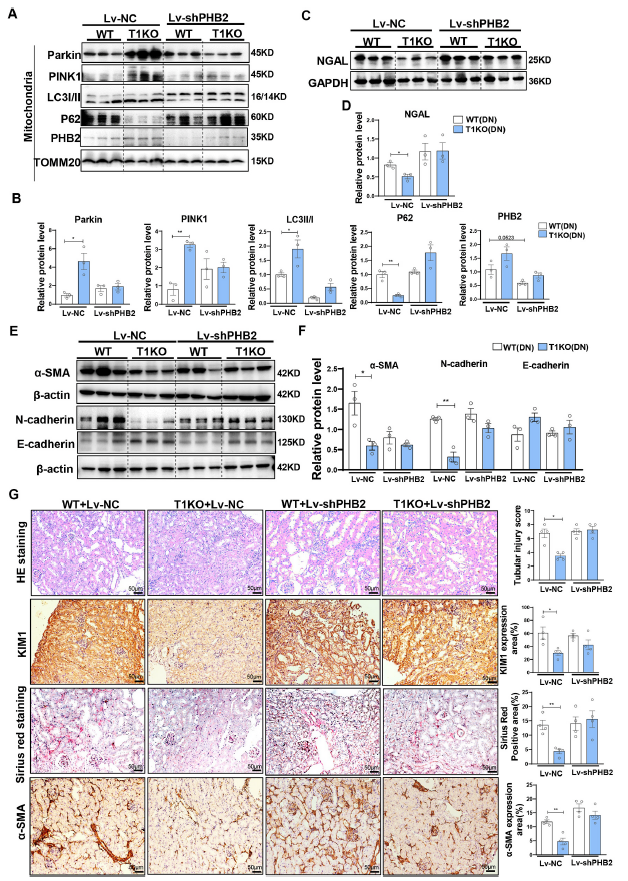
图7敲低PHB2消除Tipe1缺失对RTECs线粒体自噬、损伤和EMT的改善作用
7、TIPE1在RTECs中的表达与DN患者的肾功能、线粒体吞噬和纤维化相关
为了探讨TIPE1在人类DN中的临床意义,进一步分析了TIPE1表达与肾功能的相关性。自Nephroseq数据库的数据显示,TIPE1表达与DN患者的肾小球滤过率(GFR)呈负相关(Fig. 8A)。然后在DN患者的肾活检中检测TIPE1、PHB2和α-SMA的表达(Fig. 8B)。统计分析显示,在DN患者中TIPE1表达与UACR呈负相关(Fig. 8C)。此外,TIPE1水平与α-SMA表达呈正相关,与PHB2表达呈负相关(Fig. 8D and E)。些结果进一步支持了TIPE1在DN进展中起促进作用的观点。
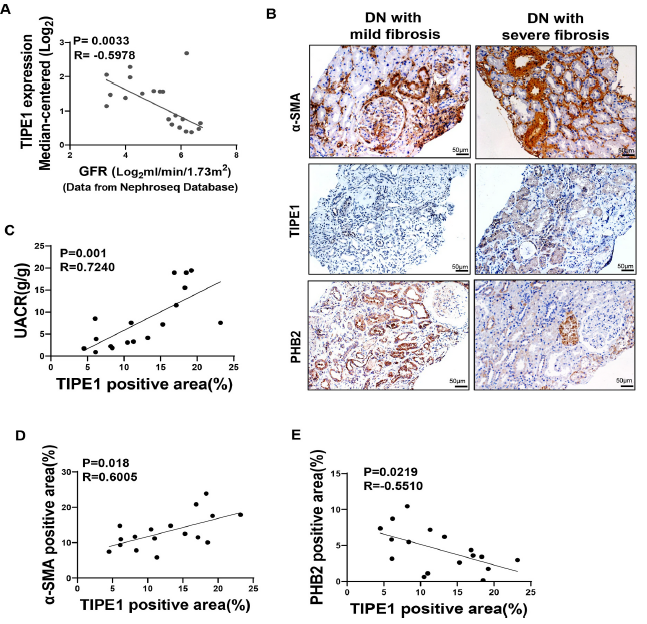
图8 TIPE1在RTECs中的表达与DN患者的肾功能、线粒体吞噬和纤维化相关
总之,本研究确定了TIPE1在RTECs中调控DN进展的关键作用。在HG条件下,TIPE1破坏PINK1/ parkin介导的线粒体自噬,并破坏RTECs的线粒体稳态。TIPE1上调是RTEC损伤和EMT的催化剂,最终促进DN的发展。
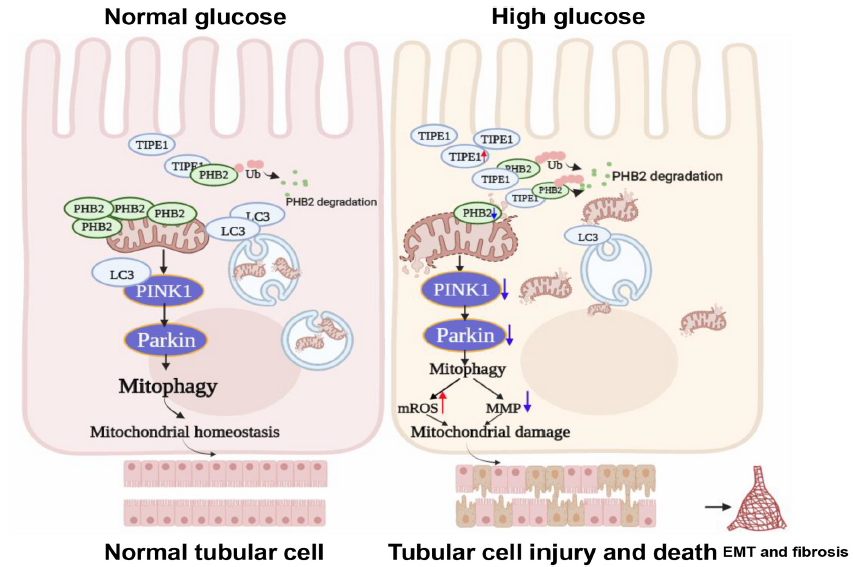
图9 TIPE1在RTECs中的上调通过干扰PHB2介导的线粒体自噬而加重DN的进展。HG环境下RTECs中TIPE1的上调与PHB2相互作用并触发其蛋白酶体降解,进而破坏线粒体自噬和线粒体稳态,促进DN的进展。
参考文献:
Liu Lei., Bai Fang., Song Hui., Xiao Rong., Wang Yuzhen., Yang Huimin., Ren Xiaolei., Li Shuangjie., Gao Lifen., Ma Chunhong., Yang Xiangdong., Liang Xiaohong.(2022). Upregulation of TIPE1 in tubular epithelial cell aggravates diabetic nephropathy by disrupting PHB2 mediated mitophagy. Redox Biol, 50(undefined), 102260. doi:10.1016/j.redox.2022.102260






